Ontwikkeling van een Uterosacraal Ligament Suspension Rat Model
Summary
Bekkenorgaanprolaps treft miljoenen vrouwen over de hele wereld en toch hebben sommige veel voorkomende chirurgische ingrepen faalpercentages tot 40%. Het ontbreken van standaard diermodellen om deze aandoening te onderzoeken belemmert de vooruitgang. We stellen het volgende protocol voor als model voor uterosacrale ligamentsuspensie en in vivo trekproeven.
Abstract
Bekkenorgaanverzakking (POP) is een veel voorkomende bekkenbodemaandoening (PFD) met het potentieel om de kwaliteit van leven van een vrouw aanzienlijk te beïnvloeden. Ongeveer 10% -20% van de vrouwen ondergaat een bekkenbodemreparatieoperatie om verzakking in de Verenigde Staten te behandelen. PFD-gevallen resulteren alleen al in de Verenigde Staten in een totale jaarlijkse kosten van $ 26,3 miljard. Deze multifactoriële aandoening heeft een negatieve invloed op de kwaliteit van leven en toch zijn de behandelingsopties in het recente verleden alleen maar afgenomen. Een veel voorkomende chirurgische optie is uterosacraal ligament suspension (USLS), die meestal wordt uitgevoerd door het vaginale gewelf aan te brengen op het uterosacrale ligament in het bekken. Deze reparatie heeft een lagere incidentie van complicaties in vergelijking met die met mesh-augmentatie, maar is opmerkelijk voor een relatief hoog uitvalpercentage van maximaal 40%. Gezien het gebrek aan standaard diermodellen om bekkenbodemdisfunctie te bestuderen, is er een dringende klinische behoefte aan innovatie op dit gebied met een focus op het ontwikkelen van kosteneffectieve en toegankelijke diermodellen. In dit manuscript beschrijven we een rattenmodel van USLS met een volledige hysterectomie gevolgd door fixatie van het resterende vaginale gewelf op het uterosacrale ligament. Het doel van dit model is om de procedure na te bootsen die bij vrouwen wordt uitgevoerd om het model te kunnen gebruiken om vervolgens reparatiestrategieën te onderzoeken die de mechanische integriteit van de ligamentaanhechting verbeteren. Belangrijk is dat we ook de ontwikkeling beschrijven van een in situ trekproefprocedure om de integriteit van de interface te karakteriseren op gekozen tijdstippen na chirurgische ingreep. Over het algemeen zal dit model een nuttig hulpmiddel zijn voor toekomstige studies die behandelingsopties voor POP-reparatie via USLS onderzoeken.
Introduction
Bekkenorgaanverzakking (POP) is een veel voorkomende bekkenbodemaandoening die miljoenen vrouwen wereldwijd treft met het potentieel om vele aspecten van het leven van een vrouw aanzienlijk te beïnvloeden, vooral met de leeftijd van1 jaar. Met name ongeveer 13% van de vrouwen in de Verenigde Staten zal een operatie ondergaan voor verzakking of urine-incontinentie2. Een aandoening die het meest voorkomt na zwangerschap en bevalling, verzakking wordt gekenmerkt door de afdaling van bekkenorganen, voornamelijk de verschillende compartimenten van de vagina en / of baarmoeder, buiten hun normale positie in de peritoneale holte. Dit leidt tot vervelende symptomen van vaginale uitstulping of druk, darm, blaas en seksuele disfunctie, en algehele verminderde kwaliteit van leven. Andere risicofactoren voor POP zijn obesitas, tabaksgebruik, chronische hoest en constipatie3.
Bij gezonde vrouwen worden de bekkenbodemorganen ondersteund door de levator ani-spieren, uterosacrale ligamenten (USL’s), kardinale ligamenten, bindweefselaanhechtingen aan de bekkenzijwand en de distale structuren van het perineale lichaam 4,5. De USL’s behoren tot de belangrijkste apicale ondersteunende structuren voor zowel de baarmoeder als de apicale vagina en worden daarom vaak gebruikt bij chirurgische correctie van POP (figuur 1). Structurele ondersteuning van de USL komt voort uit het dichte collageenachtige bindweefsel in het sacrale gebied dat overgaat in dicht opeengepakte gladde spieren. Door deze compositorische gradiënt raakt de USL verweven met de baarmoeder en vaginale musculatuur om de bekkenorganen stevig te ondersteunen 6,7. In de uterosacrale ligamentsuspensie (USLS) worden de USL’s na een hysterectomie aan het vaginale gewelf bevestigd, waardoor de vagina en de omliggende structuren worden hersteld naar hun anatomische positie in het abdominale compartiment. Ongeacht een transvaginale of laparoscopische route wordt de USLS-procedure echter geplaagd door een relatief hoog uitvalpercentage van maximaal 40% in sommige onderzoeken 8,9. Het recidiefpercentage van hinderlijke vaginale uitstulpingssymptomen 5 jaar na reparatie voor apicale compartimentprolaps, zoals USL’s, was ongeveer 40% in een grote multicenter gerandomiseerde gecontroleerde studie9. In hetzelfde onderzoek was de herbehandeling voor recidiverende prolaps na 5 jaar ongeveer 10%. Het mechanisme van dit hoge uitvalpercentage is niet onderzocht, maar het herstellen van de vagina en de omliggende structuren naar hun anatomische positie vereist hechtplaatsing in het dichte collageengebied van de USL10,11 in plaats van het gladde spiergebied. Daarom kan het hoge uitvalpercentage te wijten zijn aan de mechanische en compositorische mismatch van de chirurgisch gevormde vagina-USL-interface in vergelijking met de volledige integratie die wordt gezien in de inheemse cervicale-USL-hechting.
De economische impact van de behandeling van deze aandoeningen is ook opmerkelijk, met ongeveer $ 300 miljoen jaarlijks uitgegeven in de VS aan ambulante zorg12, en meer dan $ 1 miljard jaarlijks uitgegeven aan directe kosten voor chirurgische ingrepen13. Ondanks de enorme economische middelen die zijn gewijd aan de behandeling van deze aandoeningen, blijven de complicaties die voortvloeien uit veel verzakkingsoperaties ontmoedigend. Polypropyleen op gaas gebaseerde apicale prolapsreparaties, zoals sacrocolpopexie, bieden bijvoorbeeld hogere slagingspercentages in vergelijking met inheemse weefselreparaties14, maar ten koste van mogelijke complicaties zoals blootstelling aan gaas of erosie. De FDA ontving alleen al tussen 2008 en 2010 bijna 3.000 klachten met betrekking tot mesh-complicaties. Dit culmineerde in een bevel van de FDA om de productie en verkoop van alle transvaginaal geplaatste mesh-producten voor POP in april 2019te stoppen 15. Daarom is er een sterke klinische behoefte aan andere materialen dan polypropyleen en modellen om ze te testen, die inheemse weefselprolapsreparaties kunnen vergroten en de slagingspercentages kunnen verhogen in vergelijking met traditionele technieken met alleen hechting.
Sinds de aankondiging van de FDA in 2019 zijn de meeste bekkenchirurgen gestopt met het gebruik van transvaginaal geplaatst gaas voor verzakkingsreparaties, wat onderzoekers ertoe aanzet om nieuwe weefselmanipulatiebenaderingen te zoeken om inheemse weefselreparatieste vergroten 16,17,18, zoals met mesenchymale stromale cellen (MSC’s)9,20 . Met deze verschuiving in focus is er een dringende behoefte aan de verfijning van diermodellen die kunnen helpen bij de ontwikkeling van nieuwe materialen; De uitdaging in dit proces is het balanceren van klinische relevantie met kosten. Hiertoe hebben basiswetenschap en klinische onderzoekers die bekkenorgaanprolaps bestuderen tot nu toe gebruik gemaakt van verschillende diermodellen, waaronder ratten, muizen, konijnen, schapen, varkens en niet-menselijke primaten19. Het proces van het identificeren van een optimaal diermodel is een uitdaging, omdat mensen tweevoetig zijn, geen staart hebben en een traumatisch geboorteproces hebben in vergelijking met andere zoogdiersoorten20. Varkens21 zijn gebruikt om robotische sacrocolpopexie te simuleren, terwijl schapen zijn gebruikt om vaginale prolapsreparaties te simuleren22. Deze diermodellen, hoewel klinisch relevant, zijn beperkt in haalbaarheid door kosten en onderhoud. Niet-menselijke primaten zijn gebruikt om de pathogenese van verzakking te bestuderen; Vooral eekhoornapen zijn een van de weinige andere soorten dan mensen die spontane verzakking kunnen ontwikkelen, waardoor ze een van de meest relevante diermodellen zijn20. Niet-menselijke primaten zijn ook gebruikt om gynaecologische chirurgische procedures zoals sacrocolpopexie23 en baarmoedertransplantatie24 te bestuderen. Net als hun tegenhangers van schapen en varkens, is de primaire beperking van niet-menselijke primaten als een diermodel van verzakking de kosten van onderhoud, verzorging en pensionering19.
Hoewel het knaagdierbekken horizontaal is georiënteerd met een veel kleinere verhouding tussen de grootte van het hoofd-geboortekanaal in vergelijking met mensen19, zijn ratten geschikt voor kleine dierstudies van USLS-chirurgie omdat ze vergelijkbare USL-anatomie, cellulariteit, histologische architectuur en matrixsamenstelling hebben in vergelijking met de menselijke USL25. Bovendien zijn ze gunstig op het gebied van onderhoud en boarding. Ondanks deze gunstige eigenschappen zijn er geen gepubliceerde rapporten van een rattenmodel van USLS-reparatie. Daarom is het doel om een protocol voor hysterectomie en USLS in de multiparous Lewis rat te beschrijven. Dit protocol zal gunstig zijn voor onderzoekers die de pathofysiologie en chirurgische componenten van POP willen bestuderen met behulp van dit toegankelijke diermodel.
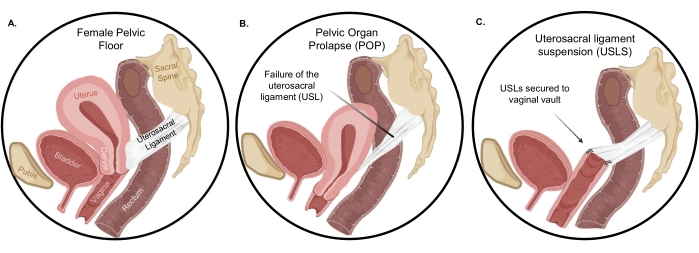
Figuur 1: Verzakking van het bekkenorgaan. (A) De normale oriëntatie van organen in de peritoneale holte en (B) de dramatische orgaandescensie bij verzakking. Na hysterectomie herstelt (C) uterosacrale ligamentsuspensie de vagina en de omliggende structuren naar hun juiste anatomische positie. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Het protocol valt op door verschillende voordelen. Voor zover wij weten, is het de eerste gepubliceerde beschrijving van USLS in het rattenmodel en zal het toekomstige onderzoekers reproduceerbare stappen bieden voor het uitvoeren van deze procedure in de onderzoeksomgeving. Ten tweede nemen we een nieuw protocol op voor trektesten van de native en chirurgische interface van de USL. Het trektestprotocol kan worden gebruikt in vergelijkbare studies die nieuwe weefselmanipulatiebenaderingen onderzoeken om inheemse weefselreparaties zoals USLS te vergroten. Bovendien is het rattenmodel zelf nuttig voor de studie van bekkenbodemaandoeningen vanwege het gebruiksgemak / boarden, de korte levensduur en de kostenefficiëntie in vergelijking met grotere diermodellen. Beperkingen van het protocol omvatten een onvermogen om een van de belangrijkste complicaties van USLS, ureterale knikken, te beoordelen. Desondanks hadden we in deze studie geen gevallen van vermoedelijk ureteraal letsel. Een andere overweging is dat de horizontale oriëntatie van het bekken, de verhouding tussen het kleine foetale hoofd-geboortekanaal en het ontbreken van spontane verzakking in het rattenmodel enige toepasbaarheid van resultaten op mensen beperken. Het gebruik van multiparous ratten is echter een kracht van deze studie, omdat dit de belangrijkste risicofactor is in de ontwikkeling van POP3.
De vaststelling van een succesvol protocol voor hysterectomie en USLS bij de Lewis-rat zal een nuttig hulpmiddel zijn voor toekomstige onderzoekers die chirurgische componenten van POP onderzoeken, terwijl de variabiliteit bij het testen van het mechanische gedrag van de USL wordt geminimaliseerd. Chirurgische diermodellen zijn gunstig omdat ze onderzoekers in staat stellen klinisch relevante experimenten te ontwerpen die pariteit, lichaamsmassa, ziekte en voedingcontroleren 34, terwijl het ethische risico van initiële studie bij mensen wordt beperkt. Verder stellen gestandaardiseerde modellen voor POP onderzoekers in staat om de beperkingen van het verzamelen van menselijk weefsel te omzeilen. Met name de in dit protocol beschreven trekproefmethoden zullen consistentie tussen de studies mogelijk maken. Eerdere knaagdiermodellen testten de mechanische eigenschappen van het hele bekkengebied, waaronder de baarmoederhals, vagina en de meerdere bekkenondersteunende ligamenten29,42. De hier beschreven methoden maken het mogelijk om de USL te meten op een manier die de inheemse spinale en cervicale aanhechtingen handhaaft. Opgemerkt moet worden dat de trekproefmethoden niet alleen de USL beoordelen, maar eerder de USL in combinatie met het inbrengen ervan op het heiligbeen en de baarmoederhals. Dit is een kracht van de studie omdat het de gebruikelijke in situ krachten weerspiegelt waaraan het ligament wordt blootgesteld. We erkennen dat het mechanische gedrag van het geïsoleerde ligament anders zou zijn als het ex vivo zou worden getest zonder zijn oorspronkelijke aanhechtingen. Dit geldt vooral omdat de rattenstructuren klein zijn en de haalbaarheid van het verzamelen van een monster dat geschikt is voor ex vivo testen beperken. De USL’s ervaren belasting in meerdere richtingen in situ, dus de uniaxiale aard van de test is een beperking, maar het gebruik van deze methode maakt zinvolle vergelijkingen mogelijk tussen eerdere studies van rat USL-mechanica29,42. Hoewel er momenteel geen algemeen aanvaard standaard mechanisch testprotocol is, zal dit model een nuttig hulpmiddel zijn voor toekomstige weefselmanipulatiestudies in het veld.
Verschillende stappen die in dit protocol worden beschreven, zijn van cruciaal belang voor de gezondheid en het welzijn van de dieren, evenals de reproduceerbaarheid van de USLS-operatie en de daaropvolgende trekproeven. Ten eerste is het essentieel om zowel de pijnstillende als de ontstekingsremmende geneesmiddelen te verkrijgen die worden beschreven als de pijnstiller alleen bleek onvoldoende te zijn voor pijnbestrijding. Het profylactische antibioticum vermindert het risico op infectie van de operatieplaats en is de standaardzorg bij menselijke chirurgie. Met betrekking tot de USLS chirurgische procedure zijn het vermijden van schade aan de eierstokken en het minimaliseren van bloedverlies essentieel voor een succesvolle operatie. In de stappen 1.3.3 en 1.3.4 wordt beschreven hoe de bovenkant van de baarmoederhoorn wordt gescheiden van de aangrenzende eierstok; Er moet voor worden gezorgd dat deze dissectie aan de zijkant van de baarmoederhoorn wordt gehandhaafd om verstoring van delicate bloedvaten rond de eierstok te voorkomen, wat kan leiden tot overmatig bloeden. Van belang is dat andere onderzoekers hebben aangetoond dat de ovariële functie behouden blijft na verwijdering van de baarmoederhoorns43. Bovendien, als de eierstokken worden verstoord of verwijderd, zal de algehele collageenfibrilarchitectuur worden verstoord, waardoor de mechanische eigenschappen van de weefsels veranderen44,45. Zodra de baarmoederhoorn veilig is gescheiden van de eierstok, is er een duidelijk vlak van dissectie waardoor de baarmoederhoorn kan worden geïsoleerd van de omliggende vetkussentjes en vasculatuur. Ondanks het duidelijke vlak van dissectie, moeten de steeltjes langs de baarmoederhoorn worden vastgezet met een klem voorafgaand aan de transsectie met een microschaar. In tegenstelling tot de chirurgische praktijk bij mensen, hebben we ontdekt dat hechtligatie van de hysterectomie-pedikels onnodig is, omdat het klemmen van de pedikel voorafgaand aan de transsectie zorgt voor voldoende hemostase. Stap 1.3.6 van het protocol beschrijft dit zorgvuldige proces om bloedverlies te minimaliseren. Terwijl de hysterectomie wordt uitgevoerd, moet grote zorg worden besteed aan het identificeren van de urineleiders zoals vermeld in stap 1.3.6 en 1.3.8. Het begrijpen van de anatomische nabijheid van de urineleider is van cruciaal belang, omdat een van de meest voorkomende complicaties geassocieerd met de USL’s bij mensen ureterale schade is46.
Tot slot presenteren we een nieuw protocol voor het uitvoeren van hysterectomie, uterosacrale ligamentsuspensie en trektesten van de USL in een rattenmodel. We verwachten dat onze bevindingen toekomstige fundamentele wetenschappelijke onderzoekers zullen helpen door een duidelijke, reproduceerbare beschrijving van deze procedures te geven en daardoor vooruitgang te boeken in het onderzoek naar bekkenorgaanprolaps.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We danken Prof. Silvia Blemker voor het gebruik van haar Instron en Prof. George Christ voor het gebruik van zijn chirurgische ruimte, evenals de 3D-geprinte houder en grip. Dit werk werd ondersteund door het UVA-Coulter Translational Research Partnership en de DoD (W81XWH-19-1-0157).
Materials
| Alcohol prep pad | BD | 326895 | |
| Artificial Tear Ointment | American Health Service Sales Corp | PH-PARALUBE-O | |
| Bluehill software | Instron | Bluehill 3 | |
| Cavicide 1 disinfectant | Fisher Scientific | 22 998 800 | |
| Compression platean | Instron | 2501-163 | |
| Cotton swabs | Puritan Medical | 806-WC | |
| Gauze Sponge, 8-Ply | VWR | 95038-728 | |
| Mosquito Forceps | Medline Industries | MMDS1222115 | |
| Needle Holder | Medline Industries | DYND04045 | |
| Operating Scissors, 5½", Sharp | American Health Service Sales Corp | 4-222 | |
| Opioid Analgesic (Buprenorphine XR) | Fidelis Animal Health | Ethiqa XR | 0.65 mg/kg SC Q72 |
| NSAID Analgesic (Meloxicam SR) | Wildlife Pharmaceuticals, LLC | Meloxicam SR | 1 mg/kg SC q72 |
| PDS II, 3-0 Polydioxanone Suture, SH-1 | Ethicon | Z316H | |
| PDS II, 5-0 P olydioxanone Suture, RB-1 | Ethicon | Z303H | |
| Retractor | Medline Industries | MDS1862107 | |
| Scalpel Blade Stainless Surgical #10 | Miltex | 4-310 | |
| Scalpel Handle | Medline Industries | MDS15210 | |
| Scissor, Micro, Curved, 4.5" | Westcott | MDS0910311 | |
| Single Column Universal Testing System | Instron | 5943 S3873 | 1 kN force capacity, 10 N load cell |
| Sterile Natural Rubber Latex Gloves | Accutech | 91225075 | |
| Suture,Vicryl,6-0,P-3 | Ethicon | J492G | |
| Tape,Umbilical,Cotton,1/8X18" | Ethicon | U10T | |
| Tension and Compression Load Cell | Instron | 2530-10N | 10N load cell (1 kgf, 2 lbf) |
| Veterinary surgical adhesive (skin glue) | Covetrus | 31477 |
References
- Olsen, A. L., et al. Epidemiology of surgically managed pelvic organ prolapse and urinary incontinence. Obstetrics and Gynecology. 89 (4), 501-506 (1997).
- Wu, J. M., et al. Lifetime risk of stress urinary incontinence or pelvic organ prolapse surgery. Obstetrics and Gynecology. 123 (6), 1201-1206 (2014).
- Kenton, K., Mueller, E. R. The global burden of female pelvic floor disorders. BJU International. 98, 1-7 (2006).
- Herschorn, S. Female pelvic floor anatomy The pelvic floor, supporting structures, and pelvic organs. Reviews in Urology. 6, 2-10 (2004).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 369 (9566), 1027-1038 (2007).
- Campbell, R. M. The anatomy and histology of the sacrouterine ligaments. American Journal of Obstetrics and Gynecology. 59 (1), 1-12 (1950).
- Reisenauer, C., et al. The role of smooth muscle in the pathogenesis of pelvic organ prolapse – An immunohistochemical and morphometric analysis of the cervical third of the uterosacral ligament. International Urogynecology Journal and Pelvic Floor Dysfunction. 19 (3), 383-389 (2008).
- Lavelle, R. S., Christie, A. L., Alhalabi, F., Zimmern, P. E. Risk of prolapse recurrence after native tissue anterior vaginal suspension procedure with intermediate to long-term followup. Journal of Urology. 195 (4), 1014-1020 (2016).
- Jelovsek, J. E., et al. Effect of uterosacral ligament suspension vs sacrospinous ligament fixation with or without perioperative behavioral therapy for pelvic organ vaginal prolapse on surgical outcomes and prolapse symptoms at 5 years in the OPTIMAL randomized clinical trial. JAMA – Journal of the American Medical Association. 319 (15), 1554-1565 (2018).
- Bradley, M. S., et al. Vaginal uterosacral ligament suspension: A retrospective cohort of absorbable and permanent suture groups. Female Pelvic Medicine & Reconstructive Surgery. 24 (3), 207-212 (2018).
- Cola, A., et al. Native-tissue prolapse repair: Efficacy and adverse effects of uterosacral ligaments suspension at 10-year follow up. International Journal of Gynecology and Obstetrics. , (2022).
- Sung, V. W., Washington, B., Raker, C. A. Costs of ambulatory care related to female pelvic floor disorders in the United States. American Journal of Obstetrics and Gynecology. 202 (5), 1-4 (2010).
- Subak, L. L., et al. Cost of pelvic organ prolapse surgery in the United States. Obstetrics and Gynecology. 98 (4), 646-651 (2001).
- Siddiqui, N. Y., et al. Mesh sacrocolpopexy compared with native tissue vaginal repair: A systematic review and meta-analysis. Obstetrics & Gynecology. 125 (1), 44-55 (2015).
- FDA takes action to protect women’s health, orders manufacturers of surgical mesh intended for transvaginal repair of pelvic organ prolapse to stop selling all devices. FDA News Release Available from: https://www.fda.gov/news-events/press-announcements/fda-takes-action-protect-womens-health-orders-manufacturers-surgical-mesh-intended-transvaginal (2019)
- Brincat, C. A. Pelvic organ prolapse reconsidering treatment, innovation, and failure. JAMA – Journal of the American Medical Association. 322 (11), 1047-1048 (2019).
- Cundiff, G. W. Surgical innovation and the US Food and Drug Administration. Female Pelvic Medicine & Reconstructive Surgery. 25 (4), 263-264 (2019).
- Luchristt, D., Weidner, A. C., Siddiqui, N. Y. Urinary basement membrane graft-augmented sacrospinous ligament suspension: a description of technique and short-term outcomes. International Urogynecology Journal. 33 (5), 1347-1350 (2022).
- Couri, B. M., et al. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics and Gynecology. 7 (3), 249-260 (2012).
- Mori da Cunha, M. G. M. C., et al. Animal models for pelvic organ prolapse: systematic review. International Urogynecology Journal. 32 (6), 1331-1344 (2021).
- Kasabwala, K., Goueli, R., Culligan, P. J. A live porcine model for robotic sacrocolpopexy training. International Urogynecology Journal. 30 (8), 1371-1375 (2019).
- Mansoor, A., et al. Development of an ovine model for training in vaginal surgery for pelvic organ prolapse. International Urogynecology Journal. 28 (10), 1595-1597 (2017).
- Liang, R., et al. Impact of prolapse meshes on the metabolism of vaginal extracellular matrix in rhesus macaque. American Journal of Obstetrics and Gynecology. 212 (2), 1-7 (2015).
- Johannesson, L., et al. Preclinical report on allogeneic uterus transplantation in non-human primates. Human Reproduction. 28 (1), 189-198 (2013).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- National Research Council. . Guide for the Care and Use of Laboratory Animals: Eighth Edition. , (2011).
- Federal Animal Welfare Regulations. National Archives Available from: https://www.ecfr.gov/current/title-9/chapter-l/subchapter-A/part-2/subpart-C/section-2.31 (2022)
- Ma, Y., et al. Knockdown of Hoxa11 in vivo in the uterosacral ligament and uterus of mice results in altered collagen and matrix metalloproteinase activity. Biology of Reproduction. 86 (4), 100 (2012).
- Moalli, P. A., et al. A rat model to study the structural properties of the vagina and its supportive tissues. American Journal of Obstetrics and Gynecology. 192 (1), 80-88 (2005).
- Yoshida, K., et al. Mechanics of cervical remodelling: Insights from rodent models of pregnancy. Interface Focus. 9 (5), 20190026 (2019).
- Christ, G. J., Sharma, P., Hess, W., Bour, R. . Modular biofabrication platform for diverse tissue engineering applications and related method thereof. , (2020).
- Smith, K., Christ, G. J. . Incorporation of in vitro double seeding for enhanced development of tissue engineered skeletal muscle implants. , (2019).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Baah-Dwomoh, A., McGuire, J., Tan, T., De Vita, R. Mechanical properties of female reproductive organs and supporting connective tissues: A review of the current state of knowledge. Applied Mechanics Reviews. 68 (6), 1-12 (2016).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Kurtaliaj, I., Golman, M., Abraham, A. C., Thomopoulos, S. Biomechanical testing of murine tendons. Journal of Visualized Experiments. (152), e60280 (2019).
- Griffin, M., et al. Biomechanical characterization of human soft tissues using indentation and tensile testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Feola, A., et al. Parity negatively impacts vaginal mechanical properties and collagen structure in rhesus macaques. American Journal of Obstetrics and Gynecology. 203 (6), 1-8 (2010).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics and Gynecology and Reproductive Biology. 144, 146-158 (2009).
- Lowder, J. L., et al. Adaptations of the rat vagina in pregnancy to accommodate delivery. Obstetrics and Gynecology. 109 (1), 128-135 (2007).
- Koebele, S. V., et al. Hysterectomy uniquely impacts spatial memory in a rat model: A role for the nonpregnant uterus in cognitive processes. Endocrinology. 160 (1), 1-19 (2019).
- Kafantari, H., et al. Structural alterations in rat skin and bone collagen fibrils induced by ovariectomy. Bone. 26 (4), 349-353 (2000).
- Daghma, D. E. S., et al. Computational segmentation of collagen fibers in bone matrix indicates bone quality in ovariectomized rat spine. Journal of Bone and Mineral Metabolism. 36 (3), 297-306 (2018).
- Manodoro, S., Frigerio, M., Milani, R., Spelzini, F. Tips and tricks for uterosacral ligament suspension: how to avoid ureteral injury. International Urogynecology Journal. 29 (1), 161-163 (2018).

