Desarrollo de un modelo de rata con suspensión del ligamento uterosacro
Summary
El prolapso de órganos pélvicos afecta a millones de mujeres en todo el mundo y, sin embargo, algunas intervenciones quirúrgicas comunes tienen tasas de fracaso de hasta el 40%. La falta de modelos animales estándar para investigar esta condición impide el progreso. Proponemos el siguiente protocolo como modelo para la suspensión del ligamento uterosacro y la prueba de tracción in vivo .
Abstract
El prolapso de órganos pélvicos (POP) es un trastorno común del suelo pélvico (PFD) con el potencial de afectar significativamente la calidad de vida de una mujer. Aproximadamente del 10% al 20% de las mujeres se someten a cirugía de reparación del piso pélvico para tratar el prolapso en los Estados Unidos. Los casos de PFD resultan en un costo anual total de $ 26.3 mil millones solo en los Estados Unidos. Esta condición multifactorial tiene un impacto negativo en la calidad de vida y, sin embargo, las opciones de tratamiento solo han disminuido en el pasado reciente. Una opción quirúrgica común es la suspensión del ligamento uterosacro (USLS), que generalmente se realiza fijando la bóveda vaginal al ligamento uterosacro en la pelvis. Esta reparación tiene una menor incidencia de complicaciones en comparación con aquellos con aumento de malla, pero es notable por una tasa de fracaso relativamente alta de hasta el 40%. Teniendo en cuenta la falta de modelos animales estándar para estudiar la disfunción del suelo pélvico, existe una necesidad clínica urgente de innovación en este campo con un enfoque en el desarrollo de modelos animales rentables y accesibles. En este manuscrito, describimos un modelo de rata de USLS que implica una histerectomía completa seguida de la fijación de la bóveda vaginal restante al ligamento uterosacro. El objetivo de este modelo es imitar el procedimiento realizado en mujeres para poder utilizar el modelo para luego investigar estrategias reparadoras que mejoren la integridad mecánica de la fijación del ligamento. Es importante destacar que también describimos el desarrollo de un procedimiento de prueba de tracción in situ para caracterizar la integridad de la interfaz en los puntos de tiempo elegidos después de la intervención quirúrgica. En general, este modelo será una herramienta útil para futuros estudios que investiguen las opciones de tratamiento para la reparación de POP a través de USLS.
Introduction
El prolapso de órganos pélvicos (POP) es un trastorno común del suelo pélvico que afecta a millones de mujeres en todo el mundo con el potencial de afectar significativamente muchos aspectos de la vida de una mujer, particularmente con la edad de1 año. En particular, aproximadamente el 13% de las mujeres en los Estados Unidos se someterán a cirugía por prolapso o incontinencia urinaria2. Una condición más común después del embarazo y el parto, el prolapso se caracteriza por el descenso de los órganos pélvicos, predominantemente los diversos compartimentos de la vagina y / o el útero, más allá de su posición normal en la cavidad peritoneal. Esto conduce a síntomas molestos de protuberancia o presión vaginal, intestino, vejiga y disfunción sexual, y reducción general de la calidad de vida. Otros factores de riesgo para el POP incluyen obesidad, consumo de tabaco, tos crónica y estreñimiento3.
En mujeres sanas, los órganos del suelo pélvico están soportados por los músculos elevadores del ano, los ligamentos uterosacros (USL), los ligamentos cardinales, las uniones del tejido conectivo a la pared lateral pélvica y las estructuras distales del cuerpo perineal 4,5. Las USL se encuentran entre las estructuras de soporte apical más importantes tanto para el útero como para la vagina apical, y por lo tanto, se usan a menudo en la corrección quirúrgica del POP (Figura 1). El soporte estructural de la USL proviene del denso tejido conectivo colágeno en la región sacra que se transforma en músculo liso estrechamente empaquetado. Debido a este gradiente composicional, la USL se entrelaza con la musculatura uterina y vaginal para proporcionar un soporte robusto para los órganos pélvicos 6,7. En la suspensión del ligamento uterosacro (USLS), las USL se aseguran a la bóveda vaginal después de una histerectomía, restaurando la vagina y las estructuras circundantes a su posición anatómica en el compartimiento abdominal. Sin embargo, independientemente de la vía transvaginal o laparoscópica, el procedimiento USLS está plagado de una tasa de fracaso relativamente alta de hasta 40% en algunos estudios 8,9. La tasa de recurrencia de síntomas molestos de protuberancias vaginales a los 5 años después de la reparación para el prolapso del compartimiento apical, como las USL, fue de aproximadamente 40% en un gran ensayo controlado aleatorizado multicéntrico9. En el mismo ensayo, el retratamiento para el prolapso recurrente a los 5 años fue de aproximadamente 10%. El mecanismo de esta alta tasa de fracaso no se ha estudiado, pero restaurar la vagina y las estructuras circundantes a su posición anatómica requiere la colocación de suturas en la región densa de colágeno de la USL10,11 en lugar de la región del músculo liso. Por lo tanto, la alta tasa de fracaso podría deberse al desajuste mecánico y de composición de la interfaz vagina-USL formada quirúrgicamente en comparación con la integración completa observada en el accesorio cervical-USL nativo.
El impacto económico del tratamiento de estos trastornos también es notable, con aproximadamente $ 300 millones gastados anualmente en los Estados Unidos en atención ambulatoria12, y más de $ 1 mil millones gastados anualmente en costos directos para procedimientos quirúrgicos13. A pesar de los vastos recursos económicos dedicados al tratamiento de estas afecciones, las complicaciones derivadas de muchas cirugías de prolapso siguen siendo desalentadoras. Por ejemplo, las reparaciones del prolapso apical basadas en malla de polipropileno, como la sacrocolpopexia, ofrecen mayores tasas de éxito en comparación con las reparaciones de tejidos nativos14, pero a costa de complicaciones potenciales como la exposición a la malla o la erosión. La FDA recibió casi 3,000 quejas relacionadas con complicaciones de malla solo entre 2008 y 2010. Esto culminó en una orden de la FDA para detener la fabricación y venta de todos los productos de malla colocados transvaginalmente para POP en abril de 201915. Por lo tanto, existe una fuerte necesidad clínica de materiales distintos del polipropileno, y modelos con los que probarlos, que puedan aumentar las reparaciones del prolapso del tejido nativo y aumentar las tasas de éxito en comparación con las técnicas tradicionales con sutura sola.
Desde el anuncio de la FDA en 2019, la mayoría de los cirujanos pélvicos han dejado de usar malla colocada transvaginalmente para las reparaciones del prolapso, lo que llevó a los investigadores a buscar nuevos enfoques de ingeniería de tejidos para aumentar las reparaciones de tejidos nativos16,17,18 como con las células del estroma mesenquimal (MSC)9,20 . Con este cambio de enfoque, existe una necesidad urgente de refinar los modelos animales que puedan ayudar con el desarrollo de nuevos materiales; El desafío en este proceso es equilibrar la relevancia clínica con el costo. Con este fin, la ciencia básica y los investigadores clínicos que estudian el prolapso de órganos pélvicos han aprovechado varios modelos animales hasta el momento, incluyendo ratas, ratones, conejos, ovejas, cerdos y primates no humanos19. El proceso de identificación de un modelo animal óptimo es un desafío, ya que los humanos son bípedos, no tienen cola y tienen un proceso de nacimiento traumático en comparación con otras especies de mamíferos20. Los cerdos21 se han utilizado para simular la sacrocolpopexia robótica, mientras que las ovejas se han utilizado para simular reparaciones del prolapso vaginal22. Estos modelos animales, aunque clínicamente relevantes, están limitados en viabilidad por el costo y el mantenimiento. Se han utilizado primates no humanos para estudiar la patogénesis del prolapso; Los monos ardilla en particular son una de las únicas especies, aparte de los humanos, que pueden desarrollar prolapso espontáneo, lo que los convierte en uno de los modelos animales más relevantes20. Los primates no humanos también se han utilizado para estudiar procedimientos quirúrgicos ginecológicos como la sacrocolpopexia23 y el trasplante uterino24. Al igual que sus homólogos ovinos y porcinos, la principal limitación de los primates no humanos como modelo animal de prolapso es el costo de mantenimiento, cuidado y alojamiento19.
Aunque la pelvis de los roedores está orientada horizontalmente con una relación mucho menor entre el tamaño del canal de cabeza a nacimiento en comparación con los humanos19, las ratas son adecuadas para estudios con animales pequeños de la cirugía USLS, ya que tienen anatomía, celularidad, arquitectura histológica y composición de matriz similares en comparación con la USL25 humana. Además, son beneficiosos en términos de mantenimiento y embarque. A pesar de estos atributos beneficiosos, no hay informes publicados de un modelo de rata de reparación de USLS. Por lo tanto, el objetivo es describir un protocolo para histerectomía y USLS en la rata Lewis multípara. Este protocolo será beneficioso para los investigadores que tienen como objetivo estudiar la fisiopatología y los componentes quirúrgicos de POP utilizando este modelo animal accesible.
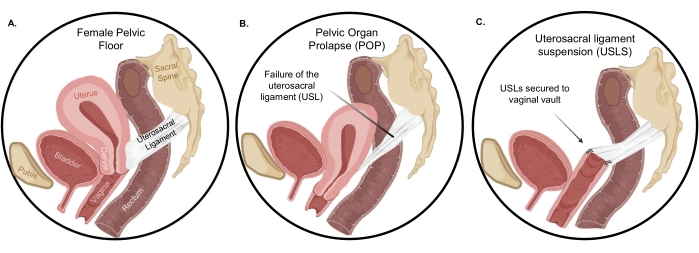
Figura 1: Prolapso de órganos pélvicos . (A) La orientación normal de los órganos en la cavidad peritoneal y (B) la dramática descensión de órganos cuando ocurre el prolapso. Después de la histerectomía, (C) la suspensión del ligamento uterosacro restaura la vagina y las estructuras circundantes a su posición anatómica adecuada. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El protocolo es notable por varias ventajas. Hasta donde sabemos, es la primera descripción publicada de USLS en el modelo de rata y proporcionará a los futuros investigadores pasos reproducibles para realizar este procedimiento en el entorno de investigación. En segundo lugar, incluimos un protocolo novedoso para la prueba de tracción de la interfaz nativa y quirúrgica de la USL. El protocolo de prueba de tracción podría utilizarse en estudios similares que investigan nuevos enfoques de ingeniería de tejidos para aumentar las reparaciones de tejidos nativos, como USLS. Además, el modelo de rata en sí es útil para el estudio de los trastornos del suelo pélvico debido a la facilidad de manejo / embarque, la corta vida útil y la rentabilidad en comparación con los modelos animales más grandes. Las limitaciones del protocolo incluyen la incapacidad de evaluar una de las principales complicaciones del USLS, el torcimiento ureteral. A pesar de esto, no tuvimos casos de presunta lesión ureteral en este estudio. Otra consideración es que la orientación horizontal de la pelvis, la pequeña proporción de canales de cabeza fetal a parto y la falta de prolapso espontáneo en el modelo de rata limitan cierta aplicabilidad de los resultados a los humanos. Sin embargo, el uso de ratas multíparas es una fortaleza de este estudio, ya que esto explica el principal factor de riesgo en el desarrollo de POP3.
El establecimiento de un protocolo exitoso para la histerectomía y el USLS en la rata Lewis será una herramienta útil para futuros investigadores que investiguen los componentes quirúrgicos del POP, al tiempo que minimiza la variabilidad en las pruebas del comportamiento mecánico del USL. Los modelos animales quirúrgicos son beneficiosos porque permiten a los investigadores diseñar experimentos clínicamente relevantes que controlan la paridad, la masa corporal, la enfermedad y la nutrición34 al tiempo que mitigan el riesgo ético del estudio inicial en humanos. Además, los modelos estandarizados para POP permiten a los investigadores eludir las limitaciones de la recolección de tejido humano. En particular, los métodos de ensayo de tracción descritos en este protocolo permitirán la coherencia entre los estudios. Los modelos anteriores de roedores probaron las propiedades mecánicas de toda la región pélvica, que incluye el cuello uterino, la vagina y los múltiples ligamentos de soporte pélvico29,42. Los métodos descritos aquí permiten medir el USL de una manera que mantiene las inserciones espinales y cervicales nativas. Cabe señalar que los métodos de prueba de tracción no evalúan el USL solo, sino el USL en combinación con su inserción en el sacro y el cuello uterino. Esta es una fortaleza del estudio, ya que refleja las fuerzas in situ habituales a las que se somete el ligamento. Reconocemos que el comportamiento mecánico del ligamento aislado sería diferente si se probara ex vivo sin sus uniones nativas. Esto es especialmente cierto ya que las estructuras de rata son pequeñas y limitan la viabilidad de recolectar una muestra adecuada para pruebas ex vivo. Las USL experimentan carga en múltiples direcciones in situ, por lo que la naturaleza uniaxial de la prueba es una limitación, pero el uso de este método permite comparaciones significativas entre estudios previos de mecánica de USL en ratas29,42. Si bien actualmente no existe un protocolo de prueba mecánica estándar ampliamente aceptado, este modelo será una herramienta útil para futuros estudios de ingeniería de tejidos en el campo.
Varios pasos descritos en este protocolo son críticos para la salud y el bienestar de los animales, así como para la reproducibilidad de la cirugía USLS y las posteriores pruebas de tracción. En primer lugar, es esencial obtener tanto el analgésico como los medicamentos antiinflamatorios descritos como el analgésico solo resultó ser inadecuado para el manejo del dolor. El antibiótico profiláctico disminuye el riesgo de infección del sitio quirúrgico y es el estándar de atención en la cirugía humana. Con respecto al procedimiento quirúrgico USLS, evitar el daño a los ovarios y minimizar la pérdida de sangre son esenciales para una cirugía exitosa. Los pasos 1.3.3 y 1.3.4 describen la separación de la parte superior del cuerno uterino del ovario adyacente; Se debe tener cuidado para mantener esta disección en el lado del cuerno uterino para evitar la interrupción de los vasos delicados alrededor del ovario, lo que puede provocar un sangrado excesivo. Cabe destacar que otros investigadores han demostrado que la función ovárica se conserva después de la extirpación de los cuernos uterinos43. Además, si los ovarios son alterados o eliminados, la arquitectura general de las fibrillas de colágeno se verá alterada, alterando las propiedades mecánicas de sus tejidos44,45. Una vez que el cuerno uterino se separa de forma segura del ovario, hay un plano claro de disección que permite el aislamiento del cuerno uterino de las almohadillas de grasa circundantes y la vasculatura. A pesar del plano claro de disección, los pedículos a lo largo del cuerno uterino deben asegurarse con una pinza antes de la transección con microtijeras. Contrariamente a la práctica quirúrgica en humanos, hemos encontrado que la ligadura de sutura de los pedículos de histerectomía es innecesaria, ya que el pinzamiento del pedículo antes de la transección asegura una hemostasia adecuada. El paso 1.3.6 del protocolo describe este proceso cuidadoso para minimizar la pérdida de sangre. A medida que se realiza la histerectomía, se debe tener mucho cuidado para identificar los uréteres como se menciona en los pasos 1.3.6 y 1.3.8. Comprender la proximidad anatómica del uréter es fundamental, ya que una de las complicaciones más comunes asociadas con las USL en humanos es la lesión ureteral46.
En conclusión, presentamos un protocolo novedoso para realizar histerectomía, suspensión del ligamento uterosacro y prueba de tracción de la USL en un modelo de rata. Anticipamos que nuestros hallazgos ayudarán a los futuros investigadores de ciencias básicas al proporcionar una descripción clara y reproducible de estos procedimientos y, por lo tanto, permitirán el avance de la investigación del prolapso de órganos pélvicos.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a la Prof. Silvia Blemker por el uso de su Instron y al Prof. George Christ por el uso de su espacio quirúrgico, así como al soporte y agarre impresos en 3D. Este trabajo fue apoyado por la Asociación de Investigación Traslacional UVA-Coulter y el Departamento de Defensa (W81XWH-19-1-0157).
Materials
| Alcohol prep pad | BD | 326895 | |
| Artificial Tear Ointment | American Health Service Sales Corp | PH-PARALUBE-O | |
| Bluehill software | Instron | Bluehill 3 | |
| Cavicide 1 disinfectant | Fisher Scientific | 22 998 800 | |
| Compression platean | Instron | 2501-163 | |
| Cotton swabs | Puritan Medical | 806-WC | |
| Gauze Sponge, 8-Ply | VWR | 95038-728 | |
| Mosquito Forceps | Medline Industries | MMDS1222115 | |
| Needle Holder | Medline Industries | DYND04045 | |
| Operating Scissors, 5½", Sharp | American Health Service Sales Corp | 4-222 | |
| Opioid Analgesic (Buprenorphine XR) | Fidelis Animal Health | Ethiqa XR | 0.65 mg/kg SC Q72 |
| NSAID Analgesic (Meloxicam SR) | Wildlife Pharmaceuticals, LLC | Meloxicam SR | 1 mg/kg SC q72 |
| PDS II, 3-0 Polydioxanone Suture, SH-1 | Ethicon | Z316H | |
| PDS II, 5-0 P olydioxanone Suture, RB-1 | Ethicon | Z303H | |
| Retractor | Medline Industries | MDS1862107 | |
| Scalpel Blade Stainless Surgical #10 | Miltex | 4-310 | |
| Scalpel Handle | Medline Industries | MDS15210 | |
| Scissor, Micro, Curved, 4.5" | Westcott | MDS0910311 | |
| Single Column Universal Testing System | Instron | 5943 S3873 | 1 kN force capacity, 10 N load cell |
| Sterile Natural Rubber Latex Gloves | Accutech | 91225075 | |
| Suture,Vicryl,6-0,P-3 | Ethicon | J492G | |
| Tape,Umbilical,Cotton,1/8X18" | Ethicon | U10T | |
| Tension and Compression Load Cell | Instron | 2530-10N | 10N load cell (1 kgf, 2 lbf) |
| Veterinary surgical adhesive (skin glue) | Covetrus | 31477 |
References
- Olsen, A. L., et al. Epidemiology of surgically managed pelvic organ prolapse and urinary incontinence. Obstetrics and Gynecology. 89 (4), 501-506 (1997).
- Wu, J. M., et al. Lifetime risk of stress urinary incontinence or pelvic organ prolapse surgery. Obstetrics and Gynecology. 123 (6), 1201-1206 (2014).
- Kenton, K., Mueller, E. R. The global burden of female pelvic floor disorders. BJU International. 98, 1-7 (2006).
- Herschorn, S. Female pelvic floor anatomy The pelvic floor, supporting structures, and pelvic organs. Reviews in Urology. 6, 2-10 (2004).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 369 (9566), 1027-1038 (2007).
- Campbell, R. M. The anatomy and histology of the sacrouterine ligaments. American Journal of Obstetrics and Gynecology. 59 (1), 1-12 (1950).
- Reisenauer, C., et al. The role of smooth muscle in the pathogenesis of pelvic organ prolapse – An immunohistochemical and morphometric analysis of the cervical third of the uterosacral ligament. International Urogynecology Journal and Pelvic Floor Dysfunction. 19 (3), 383-389 (2008).
- Lavelle, R. S., Christie, A. L., Alhalabi, F., Zimmern, P. E. Risk of prolapse recurrence after native tissue anterior vaginal suspension procedure with intermediate to long-term followup. Journal of Urology. 195 (4), 1014-1020 (2016).
- Jelovsek, J. E., et al. Effect of uterosacral ligament suspension vs sacrospinous ligament fixation with or without perioperative behavioral therapy for pelvic organ vaginal prolapse on surgical outcomes and prolapse symptoms at 5 years in the OPTIMAL randomized clinical trial. JAMA – Journal of the American Medical Association. 319 (15), 1554-1565 (2018).
- Bradley, M. S., et al. Vaginal uterosacral ligament suspension: A retrospective cohort of absorbable and permanent suture groups. Female Pelvic Medicine & Reconstructive Surgery. 24 (3), 207-212 (2018).
- Cola, A., et al. Native-tissue prolapse repair: Efficacy and adverse effects of uterosacral ligaments suspension at 10-year follow up. International Journal of Gynecology and Obstetrics. , (2022).
- Sung, V. W., Washington, B., Raker, C. A. Costs of ambulatory care related to female pelvic floor disorders in the United States. American Journal of Obstetrics and Gynecology. 202 (5), 1-4 (2010).
- Subak, L. L., et al. Cost of pelvic organ prolapse surgery in the United States. Obstetrics and Gynecology. 98 (4), 646-651 (2001).
- Siddiqui, N. Y., et al. Mesh sacrocolpopexy compared with native tissue vaginal repair: A systematic review and meta-analysis. Obstetrics & Gynecology. 125 (1), 44-55 (2015).
- FDA takes action to protect women’s health, orders manufacturers of surgical mesh intended for transvaginal repair of pelvic organ prolapse to stop selling all devices. FDA News Release Available from: https://www.fda.gov/news-events/press-announcements/fda-takes-action-protect-womens-health-orders-manufacturers-surgical-mesh-intended-transvaginal (2019)
- Brincat, C. A. Pelvic organ prolapse reconsidering treatment, innovation, and failure. JAMA – Journal of the American Medical Association. 322 (11), 1047-1048 (2019).
- Cundiff, G. W. Surgical innovation and the US Food and Drug Administration. Female Pelvic Medicine & Reconstructive Surgery. 25 (4), 263-264 (2019).
- Luchristt, D., Weidner, A. C., Siddiqui, N. Y. Urinary basement membrane graft-augmented sacrospinous ligament suspension: a description of technique and short-term outcomes. International Urogynecology Journal. 33 (5), 1347-1350 (2022).
- Couri, B. M., et al. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics and Gynecology. 7 (3), 249-260 (2012).
- Mori da Cunha, M. G. M. C., et al. Animal models for pelvic organ prolapse: systematic review. International Urogynecology Journal. 32 (6), 1331-1344 (2021).
- Kasabwala, K., Goueli, R., Culligan, P. J. A live porcine model for robotic sacrocolpopexy training. International Urogynecology Journal. 30 (8), 1371-1375 (2019).
- Mansoor, A., et al. Development of an ovine model for training in vaginal surgery for pelvic organ prolapse. International Urogynecology Journal. 28 (10), 1595-1597 (2017).
- Liang, R., et al. Impact of prolapse meshes on the metabolism of vaginal extracellular matrix in rhesus macaque. American Journal of Obstetrics and Gynecology. 212 (2), 1-7 (2015).
- Johannesson, L., et al. Preclinical report on allogeneic uterus transplantation in non-human primates. Human Reproduction. 28 (1), 189-198 (2013).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- National Research Council. . Guide for the Care and Use of Laboratory Animals: Eighth Edition. , (2011).
- Federal Animal Welfare Regulations. National Archives Available from: https://www.ecfr.gov/current/title-9/chapter-l/subchapter-A/part-2/subpart-C/section-2.31 (2022)
- Ma, Y., et al. Knockdown of Hoxa11 in vivo in the uterosacral ligament and uterus of mice results in altered collagen and matrix metalloproteinase activity. Biology of Reproduction. 86 (4), 100 (2012).
- Moalli, P. A., et al. A rat model to study the structural properties of the vagina and its supportive tissues. American Journal of Obstetrics and Gynecology. 192 (1), 80-88 (2005).
- Yoshida, K., et al. Mechanics of cervical remodelling: Insights from rodent models of pregnancy. Interface Focus. 9 (5), 20190026 (2019).
- Christ, G. J., Sharma, P., Hess, W., Bour, R. . Modular biofabrication platform for diverse tissue engineering applications and related method thereof. , (2020).
- Smith, K., Christ, G. J. . Incorporation of in vitro double seeding for enhanced development of tissue engineered skeletal muscle implants. , (2019).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Baah-Dwomoh, A., McGuire, J., Tan, T., De Vita, R. Mechanical properties of female reproductive organs and supporting connective tissues: A review of the current state of knowledge. Applied Mechanics Reviews. 68 (6), 1-12 (2016).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Kurtaliaj, I., Golman, M., Abraham, A. C., Thomopoulos, S. Biomechanical testing of murine tendons. Journal of Visualized Experiments. (152), e60280 (2019).
- Griffin, M., et al. Biomechanical characterization of human soft tissues using indentation and tensile testing. Journal of Visualized Experiments. (118), e54872 (2016).
- Feola, A., et al. Parity negatively impacts vaginal mechanical properties and collagen structure in rhesus macaques. American Journal of Obstetrics and Gynecology. 203 (6), 1-8 (2010).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics and Gynecology and Reproductive Biology. 144, 146-158 (2009).
- Lowder, J. L., et al. Adaptations of the rat vagina in pregnancy to accommodate delivery. Obstetrics and Gynecology. 109 (1), 128-135 (2007).
- Koebele, S. V., et al. Hysterectomy uniquely impacts spatial memory in a rat model: A role for the nonpregnant uterus in cognitive processes. Endocrinology. 160 (1), 1-19 (2019).
- Kafantari, H., et al. Structural alterations in rat skin and bone collagen fibrils induced by ovariectomy. Bone. 26 (4), 349-353 (2000).
- Daghma, D. E. S., et al. Computational segmentation of collagen fibers in bone matrix indicates bone quality in ovariectomized rat spine. Journal of Bone and Mineral Metabolism. 36 (3), 297-306 (2018).
- Manodoro, S., Frigerio, M., Milani, R., Spelzini, F. Tips and tricks for uterosacral ligament suspension: how to avoid ureteral injury. International Urogynecology Journal. 29 (1), 161-163 (2018).

