6.3: Energia Interna
O total de todos os tipos possíveis de energia presentes em uma substância é chamado de energia interna (U), às vezes simbolizada como E. Suponha que um sistema com energia interna inicial, Uinicial, sofre uma mudança de energia (transferência de trabalho ou calor), e a energia interna final do sistema é Ufinal. A alteração na energia interna é igual à diferença entre Ufinal e Uinicial.
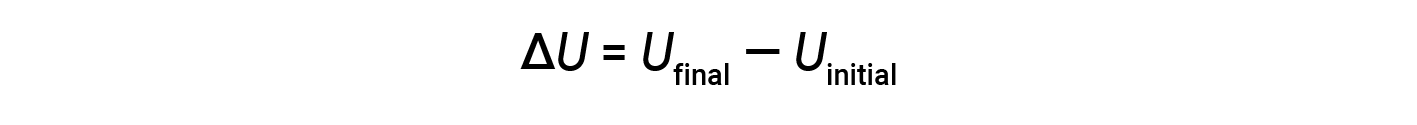
Embora os valores de Ufinal e Uinicial não possam ser determinados para um sistema, a primeira lei da termodinâmica requer apenas o valor de ΔU, que pode ser determinado mesmo sem conhecer os valores de Ufinal e Uinicial. Um valor positivo de ΔU resulta quando Ufinal > Uinicial, e indica que o sistema ganhou energia das imediações. Um valor negativo de ΔU é obtido quando Ufinal < Uinicial e indica que o sistema perdeu energia para as imediações.
O calor (energia térmica) e o trabalho (energia mecânica) são as duas maneiras diferentes que um sistema pode trocar energia com as suas imediações. A energia é transferida para um sistema quando absorve calor (q) das imediações ou quando as imediações realizam trabalho (W) sobre o sistema.
Por exemplo, a energia é transferida para um fio metálico à temperatura ambiente se estiver imerso em água quente (o fio absorve calor da água) ou quando o fio é rapidamente dobrado para a frente e para trás (o fio fica mais quente devido ao trabalho realizado). Ambos os processos aumentam a energia interna do fio, o que se reflecte em um aumento da temperatura do fio. Por outro lado, a energia é transferida para fora de um sistema quando o calor é perdido do sistema ou quando o sistema realiza trabalho sobre as imediações. Por exemplo, a queima de combustível de um foguete liberta uma quantidade tremenda de calor e também realiza trabalho sobre as imediações ao aplicar uma força ao longo de uma distância (fazendo com que um vaivém espacial se levante do solo). Ambos os processos diminuem a energia interna do sistema.
A relação entre energia interna, calor, e trabalho pode ser representada pela equação:
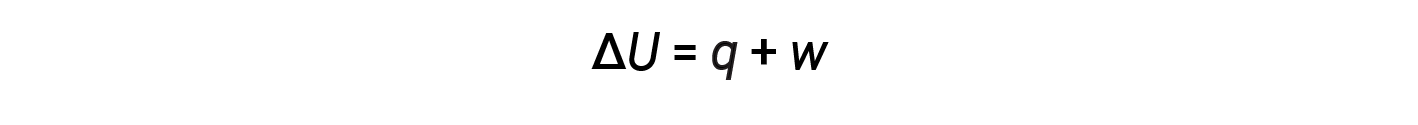
Esta é uma versão da primeira lei da termodinâmica, e mostra que a energia interna de um sistema muda através do fluxo de calor para dentro ou para fora do sistema ou quando é realizado trabalho sobre ou pelo sistema. Os sinais para calor e trabalho dependem de se o sistema ganha ou perde energia. q positivo é o fluxo de calor para o sistema a partir das imediações, enquanto que q negativo é o fluxo de calor para fora do sistema. O trabalho, w, é positivo se for feito sobre o sistema e negativo se for feito pelo sistema.
Quando q e w são ambos positivos (>0), ΔU é sempre positivo (>0), e a energia interna do sistema aumenta. Quando q e w são ambos negativos (<0), ΔU é sempre negativo (<0), e a energia interna do sistema diminui. Se q e w tiverem convenções diferentes de sinais, o sinal de ΔU depende das magnitudes relativas de q e w.
A unidade SI de energia, calor, e trabalho é o joule (J).
Este texto é adaptado de OpenStax Chemistry 2e, Section 5.3: Enthalpy.


