Singola lunghezza d'onda Ombra Imaging di<em> Caenorhabditis elegans</em> Stime Locomotion compresa Forza
Summary
La tecnica qui presentata misura il percorso di nuotare liberamente specie microscopiche con esposizione singola lunghezza d'onda. C. elegans sono utilizzati per dimostrare l'imaging ombra come un'alternativa economica ai costosi microscopi. Questa tecnica può essere adattata per ospitare diversi orientamenti, ambienti e specie per misurare direzione, velocità, accelerazione e forze.
Abstract
Questo studio dimostra una tecnica poco costoso e semplice che permette la misura di proprietà fisiche come posizione, velocità, accelerazione e forze coinvolte nel comportamento locomotorio di nematodi sospesi in una colonna di acqua in risposta a singole lunghezze d'onda della luce. Dimostriamo come valutare la locomozione di un organismo microscopico utilizzando Lunghezza d'onda singola ombra Imaging (SWSI) utilizzando due diversi esempi.
Il primo esempio è uno studio sistematico e statisticamente valida della discesa media di C. elegans in una colonna d'acqua. Per questo studio, abbiamo utilizzato vivi e morti di tipo selvatico C. elegans. Quando abbiamo confrontato la velocità e la direzione del nematode movimento attivo con la discesa passivo di vermi morti all'interno del campo gravitazionale, questo studio ha mostrato alcuna differenza nella discesa volte. La discesa media è stata di 1,5 mm / sec ± 0.1 mm / sec per entrambi i vermi vivi e morti con 633 nm coerenteluce.
Il secondo esempio è un caso di studio di selezione individuale C. elegans cambiare direzione durante la discesa in una colonna d'acqua verticale. Accelerazione e forza vengono analizzati in questo esempio. Questo studio dimostra la portata di altre proprietà fisiche che possono essere valutati utilizzando SWSI durante la valutazione del comportamento utilizzando singole lunghezze d'onda in un ambiente che non è accessibile con microscopi tradizionali. Utilizzando questa analisi abbiamo stimato un individuo nematode è in grado di spingere con una forza superiore a 28 nN.
I nostri risultati indicano che i nematodi vivono esercitano 28 nN quando si gira, o muoversi contro il campo gravitazionale. I risultati suggeriscono inoltre che nematodi passivamente discendono in una colonna d'acqua, ma possono resistere attivamente la forza di gravità principalmente dal senso di rotazione.
Introduction
Caenorhabditis elegans è un nematode terreno favorevole a vita libera che è un potente organismo modello per lo studio dei meccanismi di regolazione genica, sviluppo e più recentemente per la comprensione della biologia e del comportamento sensoriale. Pur avendo solo 302 neuroni, C. elegans sono capaci di modelli complessi locomotoria, comportamenti riproduttivi, la navigazione, la chemiotassi e molti altri comportamenti. C. elegans possiedono meccanocettori, chemiorecettori e persino di rilevare le lunghezze d'onda di luce blu (Ward et al., 2008) 1. Mentre si sa molto circa i circuiti neurali della funzione sensomotoria e modelli locomotore generali in C. elegans, meno si sa circa le risposte a molteplici stimoli simultanei o condizioni ambientali più complessi di quanto può essere modellata sotto un microscopio. Alcuni studi hanno rivelato modelli locomotore più complessi che sono 2,3,4 altamente plastica. Il nostro approccio metodologico permetterà studi di nematodes in soluzione in tempo reale in cui possiamo facilmente fornire molteplici condizioni ambientali contemporaneamente. Questa domanda è difficile da affrontare utilizzando tecniche di imaging basata microscopio convenzionali. Abbiamo sviluppato una tecnica di imaging che ci permette di collocare nematodi all'interno di una colonna d'acqua di esaminare comportamenti locomotoria, nonché determinare le capacità di nematodi cambiare locomozione in risposta a differenti condizioni ambientali.
Singola lunghezza d'onda Ombra Imaging (SWSI) viene presentato in questo lavoro per la prima volta ad affrontare le carenze di microscopi tradizionali. Microscopi tradizionali sono limitati a osservare specie in un piano focale orizzontale pochi micron di profondità 5,6. Per quanto riguarda gli studi singola lunghezza d'onda, la maggior parte dei microscopi tradizionali usano filtri colorati per filtrare la luce bianca molto ampia, in genere, 50-100 nm. Utilizzando un laser per SWSI restringe la selezione di lunghezza d'onda inferiore a 1 nm mantenendo segnoificant intensità della luce 7. Analogamente, singole lunghezze d'onda sono state utilizzate per misurare frequenze nuoto di C. elegans in tempo reale 8.
Per la prima dimostrazione del nostro metodo, abbiamo monitorare la posizione orizzontale, x, e la posizione verticale, y, di una C. banche nuoto elegans in una colonna d'acqua, per una distanza di circa un centimetro. In particolare, ci interessa il movimento verticale da gravità agisce anche in verticale. La pendenza di una misura lineare alla posizione verticale fornisce la velocità verticale, v y, del nematode mentre scende nella colonna d'acqua: 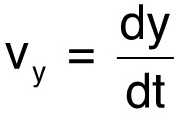 (1)
(1)
Il quadratico medio dell'errore (RMSE) 9 indica la qualità della forma e indica se la velocità di discesa è generalmente costante. Le velocità verticali sono poi mediati per each specie e vermi morti. L'utilizzo di questi risultati, la resistenza, che l'esperienza worm può essere stimato.
Per la seconda dimostrazione del nostro metodo, abbiamo selezionato C. elegans che non scendono a velocità costante a differenza della maggior parte dei vermi osservati. I vermi selezionati sia girato e nuotato verso l'alto o aleggiava per un po 'prima di continuare la discesa. Fisicamente, questo caso studio mostra che la spinta di un microrganismo nuoto può essere calcolato. Leggi di Newton dettano che un corpo che cambia indicazioni accelera, il che implica una forza netta, ![]() , Agisce su quel corpo 10:
, Agisce su quel corpo 10: 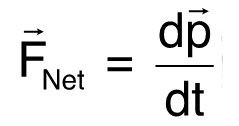 (2)
(2)
dove ![]() èla quantità di moto e t è il tempo. L'accelerazione del verme è direttamente proporzionale alla forza che agisce sul verme poiché la massa del verme rimane costante. Come risultato, la forza netta verticale è:
èla quantità di moto e t è il tempo. L'accelerazione del verme è direttamente proporzionale alla forza che agisce sul verme poiché la massa del verme rimane costante. Come risultato, la forza netta verticale è: 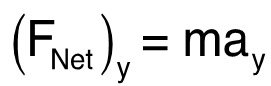 (3)
(3)
dove m è la massa di un verme e un y rappresenta l'accelerazione verticale. La forza netta nella direzione verticale rappresenta la propulsione verme nella stessa direzione. La spinta totale può essere calcolato dalla componente orizzontale in considerazione.
Protocol
Representative Results
Discussion
La tecnica SWSI fornisce un ulteriore modo per capire le capacità locomotorie di organismi microscopici, come i nematodi a vita libera. Con questa tecnica abbiamo distinto tra locomozione attiva (nuoto) e la deriva passive dovute alla circolazione gravità su nematodi morti. Inoltre, quando nematodi privo di nuoto cambiare direzione durante la locomozione in acqua, siamo in grado di misurare le forze di resistenza e le forze angolari, che operano sui nematodi e esercitate dai nematodi.
Nematodi incontrano diverse condizioni ambientali nel suolo. Ci sono sacche d'acqua all'interno del suolo, nonché particelle solide e materiali biologici di diverse forme e texture. Inoltre, esistono nematodi in un ambiente gravitazionale che rispondono a 14. Inoltre, nematodi vicino alla superficie del terreno sono esposti a differenti lunghezze d'onda della luce, variazioni di temperatura e umidità, e anche biologicovariabili come batteri, funghi predatori e altri organismi del suolo. Nematodi devono rispondere a tutte queste diverse variabili, il nuoto e strisciando in diversi media, trasformando e modificando le strategie di navigazione. Tutti questi calcoli complessi vengono svolte solo da 302 neuroni, un sottoinsieme dei quali sono coinvolti nella locomozione, e 95 cellule muscolari della parete del corpo. Misure del genere descritto dalla tecnica SWSI forniscono importante comprendere come i nematodi realizzare questa complessità di navigazione.
Per la prima parte, abbiamo misurato il tasso complessivo discendente di tipo selvatico C. elegans a 633 nm luce. Utilizzando queste misure, possiamo stimare la forza di resistenza un verme incontri.
Per il caso di studio di un nematode accelerazione, le forze coinvolte cambiamento continuo in quanto i cambiamenti di forza di trascinamento con la velocità. Ci sono alcune affermazioni che siamo in grado di fare circa le forze che agiscono sul verme. Come il worm rallenta e cerca di swim verso l'alto la componente verticale della forza di resistenza diminuisce fino a raggiungere zero al punto più basso della traiettoria del nematode. A questo punto, il verme deve avere una forza verso l'alto per swim up.
Questo metodo può essere modificata in diversi modi. Tutte le specie microscopiche che naviga in un liquido trasparente si possono seguire con SWSI. Studi possono essere condotti con eventuali lunghezze d'onda che sono accessibili a fotocamere digitali. Le fotocamere digitali in genere raccogliere lunghezze d'onda che vanno dal UV al vicino IR. Inoltre, studi orizzontali possono essere condotte da dirigere il laser verticalmente verso l'alto. La specie possono essere collocati su una superficie orizzontale trasparente, come un vetrino da microscopio. Regolare l'espansore trave o la lente d'ingrandimento dopo l'expander fascio può affinare le immagini sfocate. L'utente deve assicurarsi di fissare tutti i componenti al tavolo per garantire l'allineamento coerente e facile trave.
Il metodo è limitato dalla wavelengt laserhs e la risoluzione. In sostanza i vantaggi di questo metodo rispetto microscopi esistenti, che sono la flessibilità in direzioni e lunghezze d'onda, sono anche debolezze poiché la configurazione è semplice. L'ottica sofisticati e macchie di laser limitano la risoluzione. Alcuni di questi inconvenienti può certamente essere migliorato in futuro includendo filtro spaziale e proietta l'immagine direttamente su una telecamera CCD.
Le fasi più critiche del protocollo possono essere facilmente apprese come l'esperimento viene eseguita per la prima volta. Posizionamento del nematode nella cuvetta senza creare turbolenze è critica. Inoltre, le vibrazioni possono disturbare la configurazione e modificare il comportamento dei vermi. Assicurarsi di limitare la potenza, che viene utilizzato per ombra dell'immagine. 2 mW per un fascio laser che è di 1 mm di diametro dovrebbe essere il massimo per evitare effetti di riscaldamento. L'installazione dovrebbe essere testato per la dispersione effetti quando si utilizzano liquidi diversi dall'acqua distillata.
Attualmente la maggior parte microscopes operano su un piano orizzontale mediante luminosi o di colore bianco filtri, che sono ancora molto ampio nella gamma di lunghezza d'onda. Microscopi che utilizzano veramente singole lunghezze d'onda e hanno flessibilità nello scenario visualizzazione, cioè posizionamento orizzontale, di solito non è un vantaggio o l'altro. Inoltre, questi tipi di microscopi sono solitamente molto costosi e ancora limitata ai piani focali differenza nostro metodo. La nostra impostazione può essere facilmente costruito con un budget estremamente basso. Questo metodo è pronto per essere utilizzato da scuole, aziende ambientali nonché altri soggetti che operano con risorse limitate. In futuro, questo metodo può essere usato in una configurazione molto sofisticato per studiare effetti in tempo reale su locomozione e mechanosensation di specie microscopiche. Questo metodo rende studi singola lunghezza d'onda in una vasta gamma di angoli e profondità di visione facilmente disponibili.
Declarações
The authors have nothing to disclose.
Acknowledgements
Siamo grati per il sostegno del Research Institute Vassar College Undergraduate Summer (URSI), il salmone Fondo di ricerca Lucy Maynard, premio NASA No. NX09AU90A, National Science Foundation Center for Research Excellence in Scienza e Tecnologia (NSF-CREST) award No. 0630388 e la NSF premio n ° 1058385.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Tunable Helium-Neon laser | Research Electro-Optics | 30602 | Four wavelengths can be selected between 543 nm and 633 nm. |
| 2 Front Surface Aluminum Mirrors | Thorlabs | PF10-03-F01 | |
| High Speed Exilim Camera | Casio | ||
| Quartz Cuvette | Starna Cells | 21/G/5 | |
| LoggerPro (Software) | Vernier | http://www.vernier.com/products/software/lp/ | |
| Mathematica 8 | Wolfram | http://www.wolfram.com/ | |
| 5x – 10x variable zoom Galilean beam expander | Thorlabs | BE05-10-A | |
| Plano-convex lens with a positive focal length of 75 mm | Thorlabs | LA1257 |
Referências
- Ward, A., Lie, J., Feng, Z., Xu, Z. S. Light-sensitive neurons and channels mediate phototaxis in C. elegans. Nature Neurosci. 11, 916-922 (2008).
- Pierce-Shimomura, J. T., Chen, B. L., Mun, J. J., Ho, R., Sarkis, R., McIntire, S. L. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc. Natl. Acad. Sci. USA. , 105-20987 (2008).
- Vidal-Gadea, A. G., Davis, S., Becker, L., Pierce-Shimomura, J. T. Coordination of behavioral hierarchies during environmental transitions in Caenorhabditis elegans. Worm. 1, 5-11 (2012).
- Berri, S., Boyle, J. H., Tassieri, M., Hope, I. A., Cohen, N. Forward locomotion of the nematode C. elegans is achieved through modulation of a single gait. HFSP Journal. 3, 186-193 (2009).
- Keller, H. E., Pawley, J. B. . Objective Lenses for Confocal Microscopy. Handbook of Biological Confocal Microscopy. , (2006).
- Conrad, J. Depth of Field in Depth. Large Format Page Retrieved. , (2011).
- Demtröder, W. . Laser Spectroscopy Basic Concepts and Instrumentation. , (2003).
- Magnes, J., Raley-Susman, K., Melikechi, N., Sampson, A., Eells, R., Bello, A., Lueckheide, M. Analysis of Freely Swimming C. elegans Using Laser Diffraction. Open J. Biophys. 2 (3), 101-107 (2012).
- Mood, A., Graybill, F., Boes, D. . Introduction to the Theory of Statistics. , (1974).
- Taylor, J. R. . Classical Mechanics. , (2005).
- Magnes, J., Susman, K., Eells, R. Quantitative Locomotion Study of Freely Swimming Micro-organisms Using Laser Diffraction. J. Vis. Exp. (68), (2012).
- Bevington, P. R. . Data Reduction and Error Analysis for the Physical Sciences. , (1969).
- Lyche, T., Schumaker, L. L. Local spline approximation methods. Journal of Approximation Theory. 15 (4), 294-325 (1975).
- Kim, N., Dempsey, C. M., Kuan, C. -. J., Zoval, J. V., O’Rourke, E., Ruvkun, G., Madou, M. J., Sze, J. Y. Gravity Force Transduced by the MEC-4/MEC-10 DEG/ENaC Channel Modulates DAF-16/FoxO Activity in Caenorhabditis elegans. Genética. 177, 835-845 (2007).

