Une simple critique de taille fémorale défauts modèle chez la souris
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
On estime que la moitié de la population américaine l'expérience d'une fracture à l'âge de 65 1. Pour les patients atteints de fractures traitées chirurgicalement, 500 000 procédures impliquent l'utilisation d'un greffon osseux 2 et ce nombre devrait augmenter avec une population vieillissante de plus en plus 3 . Bien que l'os est l'un des rares organes qui a la capacité de guérir complètement sans laisser de cicatrices, il ya des cas où le processus échoue 3,4. Selon les circonstances et la qualité du traitement, 2-30% des fractures des os longs, provoquant ainsi non syndiqué 3,5. Bien qu'il reste un débat sur la définition, la pseudarthrose, lésions osseuses critiques taille ou non syndiqués se réfère généralement à une blessure qui ne guérit pas sur la durée de vie naturelle de l'objet 6. À des fins expérimentales, cette durée est ramenée à la durée moyenne nécessaire pour la guérison complète d'une blessure de taille moyenne os. Lésions osseuses non syndiqués se produisent pour numbreuses raisons, mais les principaux facteurs comprennent traumatismes extrêmes résultant en un écart de taille critique, une infection, une mauvaise angiogenèse, l'usage du tabac, ou la capacité de osteoregenerative inhibée en raison de maladie ou d'âge de 7 ans. Même si les non-syndicats sont traités avec succès, il peut coûter plus de $ 60 000 par la procédure, selon le type de blessure et les approches utilisées 8.
Dans les cas modérés, greffe osseuse autologue est employé. Cette stratégie implique la récupération de l'os à partir d'un site donneur et l'implantation sur le site de la blessure. Bien que cette approche est extrêmement efficace, le volume de l'os disponible des donateurs dérivés est limité et la procédure implique une intervention chirurgicale supplémentaire, qui se traduit par une douleur persistante dans de nombreux patients 9,10. En outre, l'efficacité de la greffe osseuse autologue dépend de la santé du patient. substituts osseux synthétiques fabriqués à partir de matériaux ou de la moelle cadavérique traitées sont abondamment disponibles 11-13, mais ils Have des limitations importantes, y compris les pauvres propriétés d'adhérence hôte cellulaire, ostéoconductivité réduite, et le potentiel de rejet immunitaire 14. Il ya donc un besoin urgent de technologies de régénération osseuse qui sont sûrs, efficaces et largement disponible.
Notre capacité à améliorer les stratégies de régénération osseuse dépend essentiellement de la capacité d'imiter graves traumatismes des os chez les animaux d'essai, mais la génération et la stabilisation de grandes lésions osseuses est techniquement difficile. Dans la plupart des cas, de graves traumatismes des os longs est imité expérimentalement en établissant un défaut qui ne seront pas guérir naturellement. Bien qu'elle puisse varier avec les espèces 15, ceci est obtenu par l'élimination complète d'un segment d'os qui est supérieure à 1,5 fois le diamètre de l'os en coupe 16. L'os est ensuite stabilisé avec un implant métallique pour maintenir une orientation correcte des bords de la fracture et permettre la mobilité. En raison de leur petite taille et la fragilité deleurs os longs, l'établissement de telles lésions chez les souris sont au-delà des capacités de la plupart des groupes de recherche. En tant que tel, les modèles de défauts des os longs sont confinés à des rats et des animaux plus gros. Néanmoins, les souris présentent des avantages significatifs de recherche en ce sens qu'ils peuvent être génétiquement modifiés et élevés que les souches immunodéprimés qui ne rejettent cellules et de tissus humains.
Pour les applications à base de cellules humaines, des souris immunodéprimées sont attrayants pour travailler avec, car ils sont physiologiquement bien caractérisés, facile à la maison, rentables, et facilement analysés radiologiquement et histologiquement. Est d'une importance primordiale que les souris immunodéprimées ne rejettent pas les cellules de différentes espèces, dont les humains. Leur petite taille permet également l'essai de très petits nombres de cellules ou des volumes d'échafaudages expérimentaux dans des applications orthopédiques. Plusieurs modèles murins orthopédiques ont été signalé que permettre différents degrés de stabilité osseuse 17,18. Ceux systems qui aboutissent à des niveaux très élevés de stabilité, tels que des fixateurs externes et plaques de verrouillage guérissent principalement par l'ossification endochondrale intramembranaire bien la guérison a été rapporté 19. En revanche, celles qui permettent certaines micro et / ou macro-mouvement, tels que ceux employant broches médullaires non fixées ou partiellement fixes, guérir généralement avec une prédominance de l'ossification endochondrale 20,21. Union retardée ou défauts non syndiqués de os long sont particulièrement difficiles à obtenir chez des souris en raison du niveau supplémentaire de stabilisation requise. Cependant, un certain nombre d'approches ont été signalés, y compris broches médullaires avec des clous de verrouillage, plaques de verrouillage et des fixateurs externes 22. Ces systèmes fonctionnent généralement bien, mais étant donné leur conception compliquée ils peuvent être techniquement difficile à installer. Par exemple, Garcia et al. 23 conçu un élégant système d'axe de verrouillage pour une utilisation chez les souris, mais la procédure implique des incisions à deux site distincts et une modification importante du fémur pour recevoir les tiges. Ces procédures ont été effectuées sous un microscope à dissection.
Nous décrivons ici d'une simple broche médullaire fémoral d'une collerette centrale destinée à empêcher la fermeture d'un déficit osseux de 3 mm et également délimiter les bords d'origine du défaut. Bien que la broche n'a pas été fixé à l'os lui-même, le dimensionnement précis du diamètre de la broche et l'alésage du résultat de la cavité médullaire interférence suffisante pour minimiser le mouvement de torsion (figure 1). Avec une sélection rigoureuse de consanguin âge, du sexe et des souris de souche appariés, le résultat est une non-uniondefect hypertrophique hautement reproductible 22 qui peut être facilement évaluée par radiologie. De plus les régions d'intérêt peuvent être définies de manière reproductible après la micro-tomographie (μCT) pour la mesure de la formation de novo de l'os et les paramètres histomorphologiques. Les broches ont été prototypé dans notre laboratoire en utilisant des outils facilement disponibles.
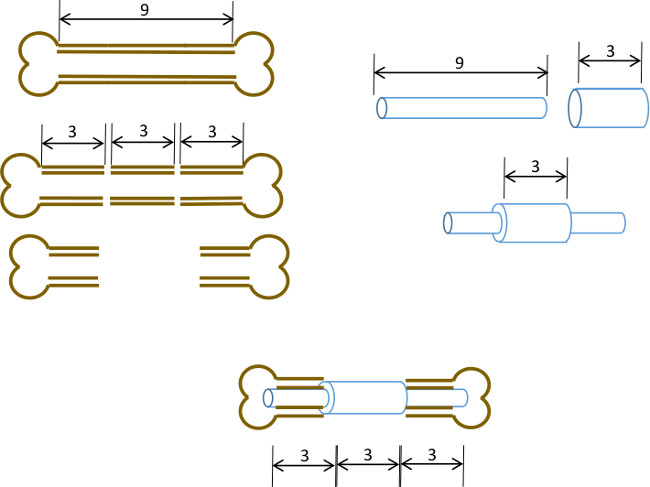
Figure 1: principe expérimental résumé schématique du modèle de défaut segmentaire.. Le segment central 3 mm d'un fémur de souris 9-10 mm est excisé chirurgicalement (à gauche). Un tube en acier chirurgical de calibre 19 3 mm de long est passé sur un 9 mm de long, 22 G tube en acier inoxydable et fixe avec colle exactement au centre (à droite). La tige résultante est ajusté dans les canaux médullaires des parties proximale et distale du fémur restant avec le collier 19 G en remplaçant le segment de 3 mm d'os (ci-dessous, au centre).
Protocol
Representative Results
Discussion
Nous décrivons ici une méthode simple pour générer un défaut critique taille pin-stabilisé du fémur murin utilisant laboratoire standard et vétérinaire. Tandis que l'ensemble des broches et la procédure chirurgicale elle-même exige de la pratique, ce est bien dans les capacités d'un scientifique de recherche biomédicale bien formé ou un vétérinaire.
La broche est positionnée dans le canal médullaire sans fixation supplémentaire, rendant la procédure plus faisable …
Declarações
The authors have nothing to disclose.
Acknowledgements
Nous remercions le personnel et les vétérinaires au ministère Scott & Blanc Hôpital de médecine comparée, Temple, Texas, pour leurs conseils et une aide précieuse lors de la mise au point de cette technique. Ce travail a été financé en partie par l'Institut for Regenerative Medicine Fonds du Programme, Scott & White RGP subvention # 90172, NIH et le NIH 2P40RR017447-07 R01AR066033-01 (NIAMS). Nous remercions le Dr Suzanne Zeitouni pour l'épreuvage le manuscrit.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
Referências
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

