Farelerde Basit Kritik ölçekli Femoral Hata Modeli
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Bu tedavi kırıklı hastalar için cerrahi, 500.000 prosedürleri kemik grefti 2 kullanımını içerir. ABD nüfusunun yarısı 65 1 yaşına göre bir kırık yaşadıklarını tahmin edilmektedir ve bu sayı giderek yaşlanan nüfus 3 artması bekleniyor . Kemik nedbe bırakmadan iyileşmesi kapasitesine sahip birkaç organlardan biri olmasına rağmen işlem 3,4 başarısız nerede, örnekleri vardır. Koşullar ve tedavi kalitesine bağlı olarak, uzun kemik kırıklarının% 2-30 sendikasız 3,5 sonuçlanan başarısız. Tanımı, psödoartroz, boy-kritik veya sendika üyesi olmayan kemik yaralanmaları üzerinde bazı tartışmalar var olmaya devam ederken, genellikle konu 6 doğal ömrü boyunca iyileşmeyen bir yaralanma anlamına gelir. Deneysel amaçlı, bu süre ortalama büyüklükteki bir kemik yaralanması tam iyileşme için gerekli ortalama süre kısaltılır. Sigara sendika kemik lezyonları num için ortayaerous nedenleri, ama önemli faktörler nedeniyle hastalık veya 7 yaş için kritik büyüklükte boşluk, enfeksiyon, zayıf anjiyogenez, tütün kullanımı, ya da inhibe osteoregenerative kapasitesi sonuçlanan aşırı travma vardır. Olmayan sendikalar başarıyla tedavi bile, bu yaralanma türüne ve 8 çalışan yaklaşımlara bağlı olarak, prosedür başına 60.000 $ aşan mal olabilir.
Orta durumlarda, otolog kemik grefti kullanılır. Bu strateji, yaralanma yerinde bir donor sitesi ve implantasyondan kemik iyileşme içerir. Bu yaklaşım, son derece etkili olmakla beraber, mevcut donör kaynaklı kemik hacmi sınırlıdır ve prosedür, birçok hastada 9,10 kalıcı ağrı oluşturan bir ilave cerrahi içerir. Buna ek olarak, otolog kemik grefti etkinliği, hastanın sağlık bağlıdır. Sentetik malzemeler veya işlenmiş kadavra kemikten yapılmış kemik yerine 11-13 bol mevcuttur, ancak bunlar hadüşük konukçu hücre yapışma özelliklerine, düşük osteoconductivity ve immün red 14 potansiyeli dahil olmak üzere önemli kısıtlamaları, ve,. Güvenli, etkili ve yaygın olarak kullanılan, kemik yenilenmesi teknolojileri için acil bir ihtiyaç vardır.
Kemik rejeneratif stratejiler geliştirmek için yetenek deney hayvanlarında ciddi kemik travma taklit yeteneği kritik bir şekilde bağlıdır, ancak büyük kemik lezyonlarının nesil ve istikrar teknik zordur. Çoğu durumda, ciddi uzun kemik travması doğal iyileşmeyecek bir kusur kurarak deneysel taklit edilir. Bu türler 15 ile değişir, ancak bu, kemik enine kesit 16 daha büyük bir çapının 1.5 mislinden daha olan bir kemik parçası tamamen çıkarılması ile elde edilir. Kemik daha sonra kırık kenarlarının doğru bir şekilde yerleştirilmesini sağlamak ve hareket için izin vermek için, bir metal implant ile stabilize edilir. Nedeniyle kendi küçük boyutu ve kırılganlıkuzun kemikler, farelerde bu tür lezyonların kurulması çoğu araştırma grupları yeteneklerini ötesindedir. Bu nedenle, uzun kemik defekti modelleri, farelerde ve büyük hayvanlar sınırlıdır. Yine, fareler onlar genetiği değiştirilmiş ve insan hücreleri ve dokuları reddetmek değil bağışıklık tehlikeye suşlar olarak yetiştirilen olabilir ki önemli araştırma avantajlar göze.
İnsan hücre tabanlı uygulamalar için, bağışıklığı baskılanmış farelerin onlar fizyolojik evin kolay, iyi karakterize çünkü çalışmak için cazip, maliyet etkin ve kolay histolojik radyolojik ve analiz. Büyük önem bağışıklık yetmezlikli fareler insanlar dahil olmak üzere farklı türlerden hücreleri reddetme kalmamasıdır. Kendi küçük boyutu da hücreler veya ortopedik uygulamalarda deneysel iskeleler hacimleri çok küçük sayılar test izin verir. Birkaç kemirgen ortopedik modeller kemik istikrar 17,18 değişik derecelerde göze olduğu bildirilmiştir. Bu systeendokondral iyileşme 19 bildirilmiş olmasına rağmen, bu dış fiksatörlerle ve kilitleme plakaları gibi istikrar çok yüksek seviyelerde, neden ms ağırlıklı intramembranöz kemikleşme ile iyileşir. Buna karşılık, bu tür sabitlenmemiş veya kısmen sabit medüller işaretçilerine kullananlar gibi bazı mikro ve / veya makro-motion, izin olanlar, genellikle endokondral kemikleşme 20,21 üstünlüğü ile iyileşir. Gecikmeli sendika veya uzun kemiğin olmayan sendika kusurlar nedeniyle gerekli istikrar ekstra seviyesine farelerde elde etmek oldukça zordur. Ancak, bir takım yaklaşımlar birbirine çivi ile medüller pimleri, kilitleme plakaları ve dış fiksatörlerle 22 olmak üzere, bildirilmiştir. Bu sistemler genellikle iyi çalışır, ancak onların karmaşık tasarım onlar yüklemek için teknik olarak zor olabilir verilen. Örneğin, Garcia ve arkadaşları. 23 farelerde kullanılmak için zarif birbirine pim sistemi geliştirmiştir, ancak söz konusu prosedür, iki ayrı yerinde kesiler içerirs ve femur geniş değişiklik işaretçilerine karşılamak için. Bu prosedürler, bir mikroskop altında yapıldı.
Bu yazıda, 3 mm kemik açığının kapanmasını önlemek ve aynı zamanda kusur orijinal kenarlarını belirginleştiren tasarlanmış bir merkezi yakalı basit femur medüller pin tarif. Pim kemik kendisi sabit değil iken, yeterli müdahale medüller kavite sonuçlarının pin çapı ve raybalama hassas boyutlandırma burulma hareketi (Şekil 1) en aza indirmek için. Doğuştan yaş, cinsiyet ve gerilme-uyumlu farelerin dikkatli seçimi ile, sonuç kolayca radyolojik değerlendirilebilir oldukça tekrarlanabilir hipertrofik olmayan uniondefect 22 olduğunu. Ayrıca Söz konusu bölgeler yeniden üretilebilir, de novo kemik oluşumu ve histomorfolojik parametrelerin ölçülmesi için mikro-bilgisayarlı tomografi (uCT sonra) tanımlanabilir. pimleri hazır araçları kullanarak laboratuvarda prototyped edildi.
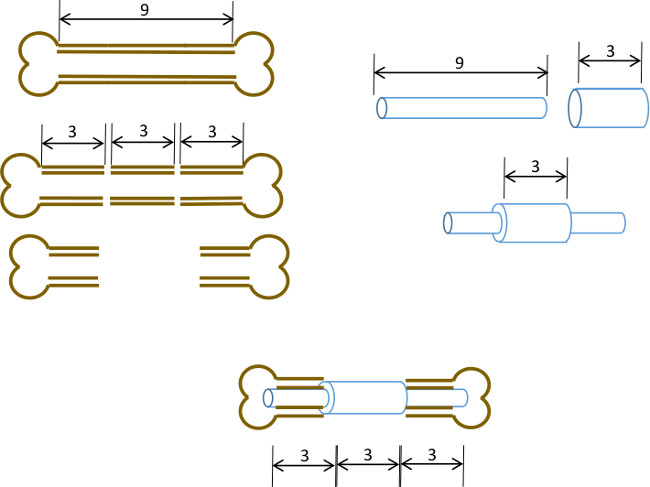
Şekil 1: Deneysel ilke defekt modeli diyagramsal özeti.. Bir 9-10 mm kemirgen femur merkezi 3 mm segmenti (solda) cerrahi olarak eksize edilir. Bir 3 mm uzunluğunda, 19 göstergesi cerrahi çelik boru tam merkezine (sağda) uzun bir 9 mm, 22 G paslanmaz çelik boru geçti ve yapıştırıcı ile sabittir. Elde edilen pim kemik 3 mm'lik bir bölümü yerine 19 G, yaka (aşağıda, merkez) ile femur kalan proksimal ve distal kısımlarının medüller kanala takılır.
Protocol
Representative Results
Discussion
Bu yazıda, standart laboratuvar ve veteriner ekipman kullanılarak kemirgen femur kritik boyutlu pin-stabilize kusur oluşturmak için basit bir yöntem tarif. Pimleri ve cerrahi prosedür kendisi montaj pratik gerektirir iken, iyi bir iyi eğitimli biyomedikal araştırma bilim adamı ya da veteriner yetenekleri dahilindedir.
pin eksternal fiksatörü veya birbirine vidaları istihdam daha karmaşık yaklaşımlar daha prosedür teknik olarak daha uygun hale ek fiksasyon olmadan medüller …
Declarações
The authors have nothing to disclose.
Acknowledgements
Biz bu tekniğin gelişimi sırasında değerli tavsiye ve yardım için, Karşılaştırmalı Tıp, Temple, Teksas Scott & Beyaz Hastanesi Bölümü personeli ve veteriner hekimler teşekkür ederiz. Bu çalışma Rejeneratif Tıp Programı Fonları Enstitüsü, Scott & Beyaz ALP hibe # 90.172, NIH 2P40RR017447-07 ve NIH R01AR066033-01 (NIAMS) tarafından kısmen finanse edildi. Biz yazının prova Dr Suzanne Zeitouni teşekkür ederim.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
Referências
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

