En simpel kritisk størrelse Femoral Defekt Model i mus
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Det anslås, at halvdelen af den amerikanske befolkning oplever en fraktur i en alder af 65 1. For de patienter med frakturer behandles kirurgisk, 500.000 procedurer indebærer brug af en knogletransplantation 2 og dette tal forventes at stige med en stadig aldrende befolkning 3 . Selv om knoglen er en af de få organer, der har kapacitet til helt heler uden ardannelse, er der tilfælde, hvor processen ikke 3,4. Afhængig af omstændighederne og kvalitet i behandlingen, 2-30% af lange knoglebrud mislykkes, hvilket resulterer i ikke-union 3,5. Mens der stadig er en vis debat om definition, pseudoarthrose, kritiske størrelse eller ikke-union knogleskader generelt refererer til en skade, der ikke heler i løbet af naturlige levetid emne 6. Til forsøgsformål, er denne varighed afkortes til den gennemsnitlige tid, der kræves til fuldstændig helbredelse af en gennemsnitlig størrelse knogle skade. Ikke-union knoglelæsioner forekomme numerous grunde, men vigtige faktorer omfatter ekstrem traume resulterer i en kritisk størrelse hul, infektion, dårlig angiogenese, tobaksrygning eller hæmmet osteoregenerative kapacitet på grund af sygdom eller alder 7. Selv om ikke-fagforeninger med held behandles, kan det koste over $ 60,000 per procedure, afhængigt af typen af skade og de metoder, der anvendes 8.
I moderate tilfælde er autolog knogletransplantation ansat. Denne strategi indebærer genopretning af knogle fra en donor websted og implantation på skadestedet. Selv om denne fremgangsmåde er ekstremt effektiv, mængden af tilgængelige donor-afledte knogle er begrænset, og procedure indebærer en yderligere operation, hvilket resulterer i vedvarende smerter i mange patienter 9,10. Desuden effektiviteten af autolog knogletransplantation er afhængig af patientens helbred. Bone erstatninger fremstillet af syntetiske materialer eller forarbejdet afdød knogle er rigeligt til rådighed 11-13, men de have væsentlige begrænsninger, herunder dårlige host-celle adhæsionsegenskaber, reduceret osteokonduktivitet, og mulighederne for immunafstødning 14. Der er derfor et presserende behov for knogleregenerering teknologier, som er sikker, effektiv og bredt tilgængelige.
Vores evne til at forbedre knogle regenerative strategier er kritisk afhængig af evnen til at efterligne alvorlig knogle traumer i forsøgsdyr, men genereringen og stabilisering af store knoglelæsioner er teknisk udfordrende. I de fleste tilfælde er alvorlig lang knogle traumer efterlignes eksperimentelt ved at etablere en defekt, som ikke naturligt helbrede. Selvom det kan variere med arter 15, opnås dette ved fuldstændig fjernelse af en knogle segment, der er større end 1,5 gange diameteren af knoglen tværsnit 16. Knoglen derefter stabiliseret med et metalimplantat til at opretholde korrekt orientering af bruddet kanter og give mulighed for mobilitet. På grund af deres lille størrelse og skrøbelighedderes lange ben, etablering af sådanne læsioner i mus er ud over mulighederne i de fleste forskningsgrupper. Som sådan er lang knogledefekt modeller begrænset til rotter og større dyr. Alligevel mus gav en betydelig forskningsindsats fordele, at de kan være genetisk modificerede og opdrættet som immunsvækkede stammer, som afviser ikke humane celler og væv.
For humane celle-baserede applikationer, immunsvækkede mus er attraktive at arbejde med, fordi de er fysiologisk velkarakteriseret, let at hus, omkostningseffektiv og let analyserede radiologisk og histologisk. Af afgørende betydning er, at immunsvækkede mus ikke afviser celler fra forskellige arter, herunder mennesker. Deres lille størrelse tillader også afprøvning af et meget lille antal celler eller mængder af eksperimentelle stilladser i ortopædiske applikationer. Flere murine ortopædiske modeller er blevet rapporteret, at tillade forskellige grader af knogle stabilitet 17,18. De, systems, der resulterer i meget høje niveauer af stabilitet, såsom eksterne fikseringsindretninger og låseplader overvejende helbrede ved intramembranous ossifikation selvom endochondral heling er rapporteret 19. I modsætning hertil dem, der tillader nogle mikro- og / eller makro-bevægelse, som dem, der anvender ikke-fikserede eller delvist faste medullære pins, generelt helbrede med en overvægt af endochondral ossifikation 20,21. Forsinket union eller non-union-defekter af lange knogler er særligt vanskeligt at opnå i mus på grund af den ekstra niveau af stabilisering nødvendig. Imidlertid er der rapporteret en række metoder, herunder medullære pins med sikringsanlæg søm, låseplader og eksterne fikseringsindretninger 22. Disse systemer fungerer generelt godt, men i betragtning af deres komplicerede design, de kan være teknisk udfordrende at installere. For eksempel Garcia et al. 23 udtænkt en elegant sikringsanlæg pin til anvendelse i mus, men proceduren indebærer indsnit på to separate websteds og omfattende ændring af lårbenet til at rumme benene. Disse procedurer blev udført under et dissektionsmikroskop.
Heri beskriver vi en simpel femoral medullær pin med en central krave designet til at forhindre lukning af en 3 mm knogle underskud og også afgrænse de oprindelige kanter defekten. Mens pin ikke var fastgjort til selve knoglen, til præcis dimensionering af stiften diameter og rivning af marvhulen resulterer i tilstrækkelig interferens minimere torsionsstivhed bevægelse (figur 1). Med omhyggelig udvælgelse af indavlede alder, køn og stamme-matchede mus, er resultatet en meget reproducerbar hypertrofisk ikke-uniondefect 22, som let kan evalueres radiologisk. Desuden områder af interesse kan reproducerbart defineres efter mikro-computertomografi (μCT) til måling af de novo knogledannelse og histomorfologisk parametre. Stifterne blev prototype i vores laboratorium ved hjælp af let tilgængelige værktøjer.
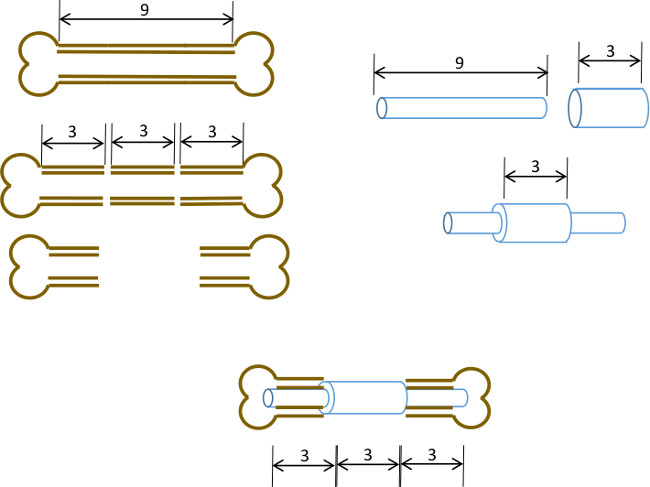
Figur 1: Eksperimentel princip Skematisk oversigt over den segmentdefekt model.. Den centrale 3 mm segment af en 9-10 mm murine lårben udskæres kirurgisk (venstre). En 3 mm lang, 19 gauge kirurgisk stål rør er ført over en 9 mm lange, 22 g rustfrit stålrør og fastgjort med klæbestof på det nøjagtige centrum (højre). Den resulterende stift monteret i medullære kanaler af de øvrige proximale og distale dele af femur med 19 g krave erstatte 3 mm segment af knogle (nedenfor i midten).
Protocol
Representative Results
Discussion
Heri beskriver vi en simpel metode til at generere en kritisk størrelse pin-stabiliserede defekt af den murine femur ved anvendelse af standard laboratorieudstyr og veterinære udstyr. Mens samlingen af benene og kirurgiske procedure selv kræver praksis, er det godt inden mulighederne i en veluddannet biomedicinsk forsker eller dyrlæge.
Stiften er placeret i marvkanalen uden yderligere fiksering, hvilket gør proceduren teknisk mere gennemførlige end mere komplicerede metoder, der …
Declarações
The authors have nothing to disclose.
Acknowledgements
Vi takke personalet og dyrlæger på Scott & White Hospital Afdeling for Medicin, Temple, Texas, for deres uvurderlige råd og bistand under udviklingen af denne teknik. Dette arbejde blev finansieret delvist af Institut for regenerativ medicin programmet finansierer, Scott & White RGP tilskud # 90172, NIH 2P40RR017447-07 og NIH R01AR066033-01 (NIAMS). Vi takker Dr. Suzanne Zeitouni til korrektur manuskriptet.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
Referências
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

