En enkel Kritisk store Femoral Defect Model i Mus
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Det er anslått at halvparten av den amerikanske befolkningen opplever et brudd i en alder av 65 1. For pasienter med frakturer behandles kirurgisk, 500.000 prosedyrer innebære bruk av et bein pode 2 og dette tallet forventes å stige med en stadig aldrende befolkning 3 . Selv om benet er en av de få organer som har kapasitet til å helbrede fullstendig uten arrdannelse, er det tilfeller hvor prosessen mislykkes 3,4. Avhengig av omstendighetene og kvaliteten av behandlingen, 2-30% av lange benbrudd svikte, noe som resulterer i ikke-forening 3,5. Mens det gjenstår en del debatt om definisjonen, pseudoarthrosis, kritiske størrelse eller uorganiserte skader bein generelt refererer til en skade som ikke gror over naturlige levetid av faget 6. For eksperimentelle formål, er dette varighet forkortet til den gjennomsnittlige tiden som kreves for fullstendig helbredelse av en gjennomsnittlig størrelse bein skade. Uorganiserte benlesjoner oppstå for numerous grunner, men viktige faktorer inkluderer ekstreme traumer som resulterer i en kritisk størrelse gap, infeksjon, dårlig angiogenese, bruk av tobakk, eller hemmet osteoregenerative kapasitet på grunn av sykdom eller alder 7. Selv om ikke-fagforeninger er vellykket behandlet, kan det koste i overkant av $ 60 000 per prosedyre, avhengig av type skade og tilnærminger ansatt åtte.
I moderate tilfeller er autolog bein pode ansatt. Denne strategien innebærer utvinning av bein fra en donor området og implantering på stedet av skader. Selv om denne fremgangsmåte er meget effektiv, er volumet av tilgjengelig donor-avledede ben begrenset, og fremgangsmåten innebærer en ekstra operasjon, noe som resulterer i vedvarende smerte hos mange pasienter 9,10. I tillegg er effekten av det autologe benimplantat avhengig av tilstanden til pasienten. Bensubstitutter laget av syntetiske materialer eller behandlet avdød bein er rikelig tilgjengelig 11-13, men de Håve betydelige begrensninger, inkludert fattige host-celle adhesjon egenskaper, redusert osteoconductivity, og potensialet for immun avvisning 14. Det er derfor et stort behov for bein regenerering teknologier som er trygg, effektiv og allment tilgjengelig.
Evnen til å forbedre ben regenerative strategier er kritisk avhengig av evnen til å etterligne ben alvorlig traume i forsøksdyr, men genereringen og stabiliseringen av store benlesjoner er teknisk utfordrende. I de fleste tilfeller er alvorlig lange ben traumer lignet eksperimentelt ved å etablere en defekt som ikke vil naturligvis gro. Selv om det kan variere med arten 15, er dette oppnådd ved fullstendig fjerning av et bein segment som er større enn 1,5 ganger diameteren av benet tverrsnitt 16. Benet blir så stabilisert med et metallimplantat for å opprettholde korrekt orientering av bruddkantene og gir mulighet for mobilitet. På grunn av sin lille størrelse og skjørhetensine lange bein, etablering av slike lesjoner hos mus er utover egenskapene til de fleste forskningsmiljøer. Som sådan, er lang bendefekten modeller begrenset til rotter og større dyr. Likevel mus ga betydelige forsknings fordeler ved at de kan bli genetisk modifisert, og oppdrettet som svekket immunforsvar stammer som ikke avviser humane celler og vev.
For humane celle-baserte applikasjoner, svekket immunforsvar mus er attraktivt å jobbe med fordi de er fysiologisk godt karakterisert, lett å huset, kostnadseffektivt, og enkelt analysert radiologisk og histologisk. Av avgjørende betydning er at svekket immunforsvar mus ikke avvise celler fra forskjellige arter, inkludert mennesker. Den hendige størrelsen gjør det også testing av meget lite antall celler eller volumer av eksperimentelle stillas i ortopediske applikasjoner. Flere murine ortopediske modeller har blitt rapportert at råd til ulike grader av bein stabilitet 17,18. De systems som resulterer i svært høye nivåer av stabilitet, for eksempel eksterne fixators og låseplater overveiende helbrede ved intramembranøse forbening selv endochondral helbredelse har blitt rapportert 19. I kontrast til de som tillater en viss mikro- og / eller makro bevegelse, slik som de som anvender ufikserte eller delvis faste medullære pinner, vanligvis helbrede med en overvekt av endochondral ossifikasjon 20,21. Forsinket union eller uorganiserte defekter av lange ben er spesielt vanskelig å oppnå i mus på grunn av den ekstra stabiliseringsnivå som kreves. Imidlertid er det rapportert en rekke tilnærminger, inkludert medullære pins med sikringsanlegg negler, låseplater og eksterne fixators 22. Disse systemene generelt fungerer godt, men gitt sin komplisert design de kan være teknisk utfordrende å installere. For eksempel Garcia et al., 23 utformet en elegant sammenlåsende stiften system for bruk i mus, men fremgangsmåten innebærer innsnitt på to separate reisers og omfattende modifikasjon av femur for å få plass til pinnene. Disse prosedyrer ble utført under et disseksjonsmikroskop.
Heri beskrives en enkel femoral margstiften med en sentral krave utformet for å hindre lukking av en 3 mm ben underskudd og også avgrense de opprinnelige kantene av defekten. Mens pinnen ikke ble festet til benet i seg selv, for å nøyaktig dimensjonering av diameteren stiften og opprømming av marghulen resulterer i tilstrekkelig interferens minimal torsjonsbevegelse (figur 1). Med nøye utvelgelse av innavlet alder, kjønn og stamme matchet mus, er resultatet en svært reproduserbare hypertrofisk ikke-uniondefect 22 som lett kan evalueres radiologisk. Videre regioner av interesse kan reproduserbart definert etter mikro-computertomografi (μCT) for måling av de novo bendannelse og histomorphological parametere. Pinnene ble prototyper i vårt laboratorium ved hjelp av lett tilgjengelige verktøy.
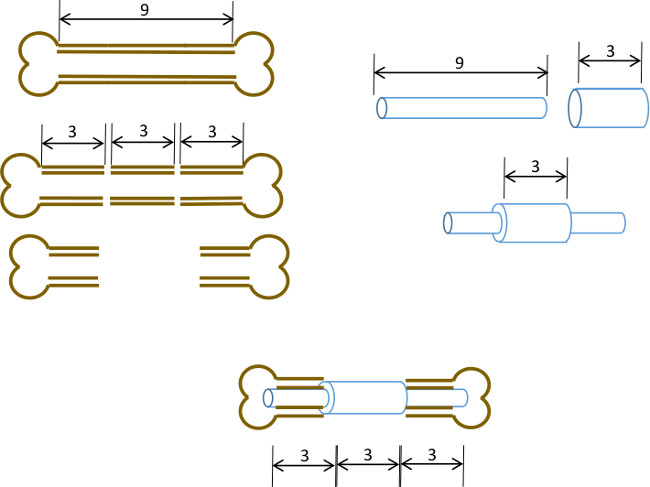
Figur 1: Eksperimentell prinsipp diagrammatisk oppsummering av segmental defekt modell.. Den sentrale 3 mm segment av en 9-10 mm murine femur blir skåret kirurgisk (til venstre). En 3 mm lang, 19 måler kirurgisk stålrøret er ført over en 9 mm lang, 22 G rustfritt stålrør og festes med klebemiddel på den nøyaktige senter (høyre). Den resulterende stiften er montert inn i marg kanalene i de resterende proksimale og distale partier av lårbenet med 19 g kragen å erstatte 3 mm segment av ben (nedenfor midten).
Protocol
Representative Results
Discussion
Heri, beskriver vi en enkel metode for å generere en kritisk størrelse pin-stabilisert defekt i murine lårbenet ved anvendelse av standard laboratorieutstyr og veterinær. Mens forsamlingen av pinnene og den kirurgiske prosedyren i seg selv krever øvelse, er det godt innenfor mulighetene til en velt biomedisinsk forsker eller veterinær.
Pinnen er plassert i margkanalen uten ytterligere fiksering, noe som gjør fremgangsmåten mer teknisk gjennomførbar enn de mer kompliserte fremgangsm?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Vi takker de ansatte og veterinærer ved Scott & White Hospital Institutt for komparativ medisin, Temple, Texas, for deres uvurderlige råd og hjelp under utviklingen av denne teknikken. Dette arbeidet ble finansiert delvis av The Institute for Regenerative Medicine Program Funds, Scott & White RGP stipend # 90172, NIH 2P40RR017447-07 og NIH R01AR066033-01 (NIAMS). Vi takker Dr Suzanne Zeitouni for korrektur manuskriptet.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
Referências
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

