Простой Critical размера бедренной кости Дефект Модель на мышах
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Считается, что половина населения США испытывают на разрыв в возрасте 65 1. Для тех пациентов с переломами хирургическое лечение, 500000 процедуры предусматривают использование костного трансплантата 2, и это число будет расти с более стареющего населения 3 , Хотя кости является одним из немногих органов, который имеет потенциал, чтобы полностью исцелить без рубцов, бывают случаи, когда процесс не 3,4. В зависимости от обстоятельств и качество лечения, 2-30% от переломов длинных костей неудачу, в результате чего не состоящих в профсоюзе 3,5. Хотя остаются некоторые дебаты по определению, ложных, критических размеров или не состоящих в профсоюзе повреждений костей, как правило, относится к травме, которая не заживает в течение естественного жизни субъекта 6. Для экспериментальных целей, эта продолжительность сокращается в среднем время, необходимое для полного заживления среднего размера травмы костей. Номера для профсоюзов повреждения кости происходят на питгими причинами, но основные факторы включают в себя тяжелейшие психологические травмы в результате критически размера зазора, инфекции, плохое ангиогенеза, употребление табака, или заторможенной мощностью osteoregenerative из-за болезни или возраста 7. Даже если она не профсоюзы успешно лечить, она может стоить более $ 60000 в порядке, в зависимости от типа травмы и подходов, используемых 8.
В умеренных случаях используется аутологичных костная пластика. Эта стратегия включает в себя восстановление кости с сайта донора и имплантации на месте травмы. Хотя такой подход является весьма эффективным, объем доступной доноров, полученных кости ограничен, и процедура включает в себя дополнительную операцию, что приводит к постоянной боли у многих пациентов 9,10. Кроме того, эффективность в аутологичного костного трансплантата зависит от состояния здоровья пациента. Костные заменители, изготовленные из синтетических материалов или обработанные трупной кости в изобилии доступны 11-13, но они гаве существенные ограничения, в том числе бедных адгезионных свойств клетки-хозяина, снижение Остеокондуктивность и потенциал для иммунного отторжения 14. Существует поэтому острая необходимость в регенерации кости технологий, которые являются безопасными, эффективными и широко доступны.
Наша способность улучшить регенеративные стратегии кости в значительной степени зависит от способности имитировать серьезную кости травмы в подопытных животных, но поколение и стабилизация больших костных поражений технически сложной задачей. В большинстве случаев, серьезные травмы длинную кость имитируется экспериментально путем создания дефект, который не будет, естественно, лечить. Хотя это может изменяться в зависимости от вида 15, это достигается за счет полного удаления сегмента кости, который больше, чем в 1,5 раза диаметр кости поперечным сечением 16. Затем кости, стабилизированного металлического имплантата, чтобы сохранить правильную ориентацию краев трещин и позволяют мобильности. Из-за их небольшого размера и хрупкостиих длинные кости, создание таких поражений у мышей находятся за пределами возможностей большинства научно-исследовательских групп. Таким образом, модели длинную кость дефект ограничены крыс и более крупных животных. Тем не менее, у мышей себе значительные исследовательские преимущества в том, что они могут быть генетически модифицированные и разводили в ослабленным иммунитетом штаммов, которые не отвергают человека клетки и ткани.
Для приложений, основанных на человеческих клетках мышей иммунитетом являются привлекательными для работы, потому что они являются физиологически хорошо характеризуется, легко дома, экономически эффективным и легко проанализировать рентгенологически и гистологически. Первостепенное значение в том, что у мышей иммунитетом не отвергают клетки от различных видов, включая человека. Их небольшой размер позволяет также тестировать очень небольшого числа клеток или объемов экспериментальных лесов в ортопедической практике. Несколько мышиных ортопедические модели сообщалось, что позволить себе различные степени стабильности костной 17,18. Те, страховочныеMS, которые приводят к очень высоким уровнем устойчивости, таких как внешние фиксаторы и стопорных пластин преимущественно лечить путем Intramembranous оссификации хотя эндохондральной заживления сообщалось 19. В отличие от этого, те, которые допускают определенную микро- и / или макро-движение, например те, которые используют нефиксированных или частично фиксированной мозговидной контактов, как правило, заживают с преобладанием эндохондральной окостенения 20,21. Задержка союз или не союз дефектов длинных костей, особенно трудно достичь в мышах в связи с повышенным уровнем стабилизации требуется. Тем не менее, были зарегистрированы несколько подходов, в том числе мозгового штифтов с блокировкой ногтей, фиксирующих пластин и внешних фиксаторов 22. Эти системы обычно работают хорошо, но, учитывая их сложную конструкцию, они могут быть технически сложными в установке. Например, Гарсиа и др. 23 разработали элегантную блокировки системы контактный для использования в мышах, но процедура включает разрезы на двух отдельном местес и обширной модификацией бедренной кости, чтобы приспособить штифты. Эти процедуры были выполнены при вскрытии микроскопом.
Здесь мы опишем простой бедренной мозгового штифт с центральной воротником, предназначенную для предотвращения закрытия 3 мм дефицита костной, а также очертить оригинальные края дефекта. В то время как вывод не был установлен на самой кости, точное определение размеров диаметра шпильки и развёртывания медуллярного результатов полость, в достаточной вмешательства к минимуму торсионного движения (рисунок 1). При тщательном выборе инбредной возраста, пола и деформации соответствием мышей, результат хорошо воспроизводим гипертрофическая без uniondefect 22, которые могут быть легко оценены рентгенологически. Кроме того регионах, представляющих интерес может быть воспроизводимо определяется после микро-компьютерной томографии (μCT) для измерения De Novo формирования костной ткани и Гистоморфологические параметров. Выводы были прототипы в нашей лаборатории с помощью легко доступных инструментов.
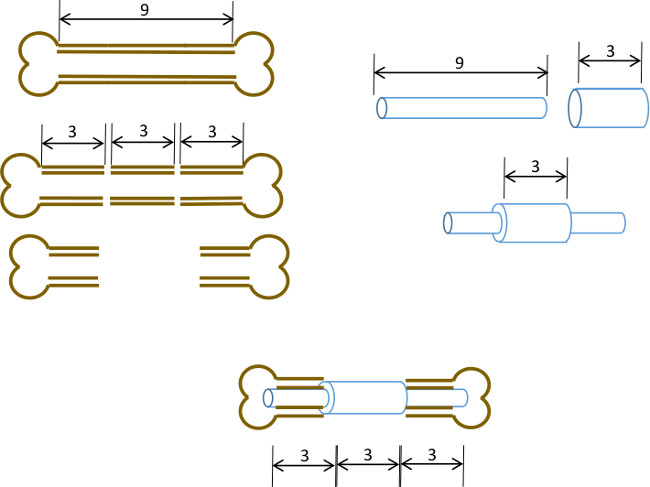
Рисунок 1: Экспериментальная принцип Схематическое резюме сегментной модели дефекта.. Центральный сегмент 3 мм из 9-10 мм мышиного бедра вырезали хирургическим (слева). Длиной 3 мм, 19 калибра хирургической стали трубки пропускают через 9 мм длиной, 22 г трубку из нержавеющей стали и фиксируется с помощью клея точно в центре (справа). Полученный штифт вставлен в мозговых каналов остальных проксимальных и дистальных отделов бедренной кости с 19 г воротник с заменой 3 мм сегмент кости (ниже, в центре).
Protocol
Representative Results
Discussion
Здесь мы опишем простой метод для создания критической величины контактный стабилизированный дефект мышиного бедра с использованием стандартных лабораторных и ветеринарное оборудование. В то время как сборка выводов и самого хирургического вмешательства требует практики, это хоро?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Мы благодарим сотрудников и ветеринаров на Скотта и Белый больницы кафедры сравнительной медицины, храм, штат Техас, за их неоценимую консультации и помощь при разработке этой методики. Эта работа была частично финансируется за счет Института регенеративной медицины фондов программы, Скотт и Белый РГП грант № 90172, NIH 2P40RR017447-07 и NIH R01AR066033-01 (NIAMS). Мы благодарим доктора Сьюзан Зейтауни для расстойки рукопись.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
Referências
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

