Изучение эндоплазматического ретикулума и митохондрии взаимодействий путем<em> В Ситу</em> Пробирной Расстояние Лигирование в Фиксированные клетки
Summary
Здесь мы опишем процедуру визуализации и количественной оценки с высокой чувствительностью эндогенные взаимодействия между эндоплазматического ретикулума и митохондрий в фиксированных клетках. Протокол оснащен оптимизированной Ситу лигирования анализа близости в ориентации инозита 1,4,5-трифосфат / белок глюкозы регулируемого рецептора 75 / зависящие от напряжения анион канала / циклофилин D комплекса на границе раздела мембраны митохондрии-ассоциированной.
Abstract
Structural interactions between the endoplasmic reticular (ER) and mitochondrial membranes, in domains known as mitochondria-associated membranes (MAM), are crucial hubs for cellular signaling and cell fate. Particularly, these inter-organelle contact sites allow the transfer of calcium from the ER to mitochondria through the voltage-dependent anion channel (VDAC)/glucose-regulated protein 75 (GRP75)/inositol 1,4,5-triphosphate receptor (IP3R) calcium channeling complex. While this subcellular compartment is under intense investigation in both physiological and pathological conditions, no simple and sensitive method exists to quantify the endogenous amount of ER-mitochondria contact in cells. Similarly, MAMs are highly dynamic structures, and there is no suitable approach to follow modifications of ER-mitochondria interactions without protein overexpression. Here, we report an optimized protocol based on the use of an in situ proximity ligation assay to visualize and quantify endogenous ER-mitochondria interactions in fixed cells by using the close proximity between proteins of the outer mitochondrial membrane (VDAC1) and of the ER membrane (IP3R1) at the MAM interface. Similar in situ proximity ligation experiments can also be performed with the GRP75/IP3R1 and cyclophilin D/IP3R1 pairs of antibodies. This assay provides several advantages over other imaging procedures, as it is highly specific, sensitive, and suitable to multiple-condition testing. Therefore, the use of this in situ proximity ligation assay should be helpful to better understand the physiological regulations of ER-mitochondria interactions, as well as their role in pathological contexts.
Introduction
Митохондрии и эндоплазматический ретикулум (ЭР) не являются независимыми органелл в клетке, но они взаимодействуют конструктивно и функционально на контактных участках, определенных в качестве митохондриальной ассоциированный эндоплазматического ретикулума мембраны (МАМ). На самом деле, MAMS соответствуют областям, где мембраны ЭР и митохондрии тесно соединенный, позволяя взаимодействия между белками с обеих сторон. Тем не менее, мембраны этих органелл не сливаться в этих регионах, поэтому они сохраняют свои отдельные объекты. В MAMS играют решающую роль в кальция (Ca 2+) и фосфолипидов перенос из ER в митохондрии, воздействуя энергетический метаболизм и выживание клеток 1-3.
Связь между ER и митохондрий впервые была визуализирована в 1970-е годы с электронной микроскопии. С тех пор, просвечивающая электронная микроскопия 4,5, электронная томография 6,7 или иммуно-локализация ER и митохондрии конкретных флуорофорас / флуоресцентные белки , 8 были классически использованы для изучения ER-митохондрии взаимодействий. Еще один полезный инструмент для анализа МАМ основан на использовании внутриклеточного фракционирования. Это позволяет изолировать МАМ фракций путем дифференциального ультрацентрифугирования , соединенного с градиентом Percoll 9. Тем не менее, конечный продукт содержит обогащенные MAM фракции, а не чистых фракций. В целом, эти стратегии не являются особенно чувствительными и / или количественный характер, и они не легко поддаются большой скрининга. В качестве альтернативы, генетические подходы , использующие наркотики индуцируемого флуоресцентных между органелл линкеры появились, но они не позволяют анализ органелл взаимодействий на эндогенные уровни экспрессии белков 10.
На основании открытия Szabadkai о комплексе IP3R / GRP75 / VDAC в МАМ 11, мы разработали количественный метод для анализа ER-митохондрии взаимодействий. Мы использовали на месте близости ligati вна анализе для выявления и количественной оценки взаимодействий между VDAC1 и IP3R1, два органелл поверхностные белки , участвующие в -channeling комплекса Са 2+ на границе раздела МАМ в фиксированных ячейках 12. Коротко говоря, мы зондировали VDAC1 на внешней мембране митохондрий (мышиное анти-VDAC1 первичного антитела) и IP3R1 на ER мембране (кроличье анти-IP3R1 первичным антителом) (рис 1, а) панели. Затем, в соответствии с анализом, мы добавили как анти-мышь и анти-кроличьего IgG (мыши и кролика Пробирной Расстояние Лигирование зонды), которые сопрягаются с комплементарными олигонуклеотидными расширений. Если две целевые белки находятся на расстоянии менее 40 нм, олигонуклеотиды могут гибридизоваться с последовательно добавляют олиго разъем для того чтобы позволить формирование шаблона круговой ДНК (рисунок 1, б) панель. Эта круговая молекула ДНК лигируют и усиливается, создавая одноцепочечной ДНК продукт , ковалентно присоединенную к одному из бесконтактными датчиками (фиг.1, панель C) </stroнг>. Так как расстояние между ER и митохондрии на границе раздела МАМ в диапазоне от 10 нм до 25 нм , 6, близость Лигирование и усиление может быть сделано, что приводит к последующему обнаружению вследствие гибридизации техасский красный-меченных зондов (рисунок 1, Панель D ). Каждая люминесцентная точка представляет взаимодействие между VDAC1 / IP3R1, что позволяет количественно оценить на месте ER-митохондрии взаимодействий в отдельных клетках.
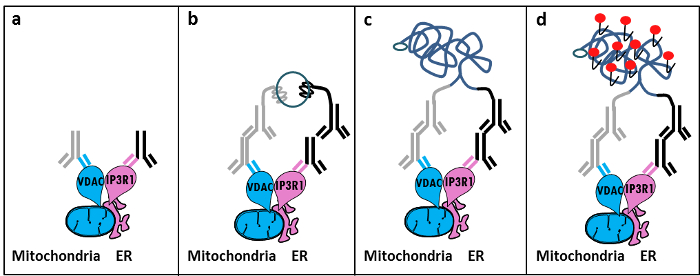
Рисунок 1: Схематическое изображение обнаружения эндоплазматического ретикулума-митохондриях взаимодействий по In Situ Пробирной Расстояние Лигирование. а) первичной мыши антитело , направленное против VDAC1 и кролика первичным антителом , направленным против IP3R1 могут связываться с их эпитопов в непосредственной близости на границе раздела МАМ, б) добавление пары зондов Расстояние Лигированиенаправленной против мыши и кролика IgG. Эти зонды прикрепили нити ДНК, которые могут образовывать шаблоны для перевязки соединителя олиго. в) Круговая нить ДНК образована после перевязки может быть усилено и d) с помощью микроскопии визуализированы в качестве флуоресцентного точки, используя техасский красный-меченных. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Аналогичные эксперименты анализа Situ близость лигирования в может быть выполнена с GRP75 / IP3R1 пары антител, а также циклофилина D (CypD) / IP3R1 антитела, принимая во внимание , что CypD было показано взаимодействие с комплексом IP3R / GRP75 / VDAC на границе раздела МАМ 12-14.
Protocol
Representative Results
Discussion
Collectively, our studies indicate that the in situ proximity ligation assay is truly a relevant strategy to follow and quantify endogenous ER-mitochondria interactions in fixed cells, without the need for using organelle-specific fluorophores or fluorescent proteins. The specific use of VDAC1/IP3R1 antibodies has been adapted to study ER-mitochondria interactions in HuH7 cells. However, alternative isoforms of VDAC and IP3R may be used, depending on the cell type. In this case, antibodies need to be validated b…
Declarações
The authors have nothing to disclose.
Acknowledgements
Мы благодарим всех людей в нашей лаборатории, которые способствовали оптимизации и проверки протокола. Эта работа была поддержана INSERM и национальным исследовательским агентством (ANR-09-JCJC-0116 И ANR-11-BSV1-033-02). ET была поддержана во время ее PhD по научным стипендии от французского министерства высшего образования и научных исследований.
Materials
| Formaldehyde | Sigma | F-8775 | |
| Glycine | Sigma | G-8898 | |
| Triton | Sigma | T8532 | |
| 35mm Glass bottom culture dishes | MatTeK corporation | P35G-0-14-C | |
| Blocking solution | Sigma | DUO-92004 or DUO-92002 | provided in the Duolink PLA probes, Sigma |
| VDAC1 antibody | Abcam | ab14734 | |
| IP3R1-H80 antibody | Santa Cruz | sc28614 | |
| CypD antibody | Abcam | ab110324 | |
| Grp75 antibody | Santa Cruz | sc13967 | |
| TBS 10X | euromedex | ET220 | Dilute to obtain 1X |
| Tween 100X | euromedex | 2001-B | dilute in TBS to obtain 0,01% |
| PLA Probes Mouse MINUS | Sigma | DUO-92004 | Duolink, Sigma |
| PLA Probes Rabbit PLUS | Sigma | DUO-92002 | Duolink, Sigma |
| Duolink detection reagents red | Sigma | DUO-92008 | Duolink, Sigma |
| Ligation solution | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Ligase | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Amplification solution | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Polymerase | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Duolink Mounting Medium | Sigma | DUO80102 | Duolink, Sigma |
| Softwares: | |||
| Blob-finder software | BlobFinder is a freely distributed software that can perform calculations on cells from fluorescence microscopy images. This software can be downloaded for free from The Centre for Image Analysis at Uppsala University who have developed the software and the work was supported by the EU FP6 Project ENLIGHT and Olink Bioscience. http://www.cb.uu.se/~amin/BlobFinder/index_files/Page430.htm | ||
| ImageJ software | Can be downloaded for free from: http://rsb.info.nih.gov/ij/download.html |
Referências
- Bravo-Sagua, R., et al. Organelle communication: signaling crossroads between homeostasis and disease. The international journal of biochemistry & cell biology. 50, 55-59 (2014).
- Giorgi, C., et al. Mitochondria-associated membranes: composition, molecular mechanisms, and physiopathological implications. Antioxidants & redox signaling. 22, 995-1019 (2015).
- Phillips, M. J., Voeltz, G. K. Structure and function of ER membrane contact sites with other organelles. Nature reviews. Molecular cell biology. 17, 69-82 (2016).
- Cosson, P., et al. The RTM resistance to potyviruses in Arabidopsis thaliana: natural variation of the RTM genes and evidence for the implication of additional genes. PLoS One. 7, 39169 (2012).
- Mannella, C. A. Structure and dynamics of the mitochondrial inner membrane cristae. Biochim Biophys Acta. 1763, 542-548 (2006).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. The Journal of cell biology. 174, 915-921 (2006).
- Mannella, C. A., Buttle, K., Rath, B. K., Marko, M. Electron microscopic tomography of rat-liver mitochondria and their interaction with the endoplasmic reticulum. Biofactors. 8, 225-228 (1998).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280, 1763-1766 (1998).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nat Protoc. 4, 1582-1590 (2009).
- Csordas, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39, 121-132 (2010).
- Szabadkai, G., et al. Chaperone-mediated coupling of endoplasmic reticulum and mitochondrial Ca2+ channels. J Cell Biol. 175, 901-911 (2006).
- Tubbs, E., et al. Mitochondria-associated endoplasmic reticulum membrane (MAM) integrity is required for insulin signaling and is implicated in hepatic insulin resistance. Diabetes. 63, 3279-3294 (2014).
- Paillard, M., et al. Depressing Mitochondria-Reticulum Interactions Protects Cardiomyocytes From Lethal Hypoxia-Reoxygenation Injury. Circulation. 128, 1555-1565 (2013).
- Rieusset, J., et al. Disruption of calcium transfer from ER to mitochondria links alterations of mitochondria-associated ER membrane integrity to hepatic insulin resistance. Diabetologia. 59, 614-623 (2016).
- Allalou, A., Wahlby, C. BlobFinder, a tool for fluorescence microscopy image cytometry. Computer methods and programs in biomedicine. 94, 58-65 (2009).
- Theurey, P., et al. Mitochondria-associated endoplasmic reticulum membranes allow adaptation of mitochondrial metabolism to glucose availability in the liver. Journal of molecular cell biology. , (2016).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Soderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature methods. 3, 995-1000 (2006).
- De Pinto, V., Messina, A., Lane, D. J., Lawen, A. Voltage-dependent anion-selective channel (VDAC) in the plasma membrane. FEBS letters. 584, 1793-1799 (2010).
- Kaul, S. C., Taira, K., Pereira-Smith, O. M., Wadhwa, R. Mortalin: present and prospective. Experimental gerontology. 37, 1157-1164 (2002).

