CRISPR-Cas का उपयोग करके Mammalian कक्ष लाइनों में जीनोम संपादन
Summary
CRISPR-Cas पौधों और जानवरों के जटिल जीनोम को इंजीनियर करने के लिए एक शक्तिशाली तकनीक है । यहां, हम विस्तार से एक प्रोटोकॉल के लिए कुशलतापूर्वक अलग कैस endonucleases का उपयोग कर मानव जीनोम संपादित करें । हम संपादन दक्षता का अनुकूलन करने के लिए महत्वपूर्ण विचार और डिजाइन मापदंडों पर प्रकाश डाला ।
Abstract
संकुल नियमित रूप से interspaced लघु palindromic दोहराता (CRISPR) प्रणाली बैक्टीरियल अनुकूली प्रतिरक्षा में स्वाभाविक रूप से कार्य करता है, लेकिन सफलतापूर्वक कई अलग रहने वाले जीवों में जीनोम इंजीनियरिंग के लिए repurposed किया गया है । सबसे अधिक, से जुड़े वाइल्डटाइप CRISPR 9 (Cas9) या Cas12a endonuclease जीनोम में विशिष्ट साइटों को सट करने के लिए प्रयोग किया जाता है, जिसके बाद डीएनए डबल-असहाय तोड़ गैर-समजातीय अंत में शामिल होने के माध्यम से मरंमत की है (NHEJ) मार्ग या homology-निर्देशित मरंमत ( HDR) मार्ग पर निर्भर करता है कि क्या एक दाता टेंपलेट अनुपस्थित या वर्तमान में क्रमशः है । तारीख करने के लिए, विभिंन जीवाणु प्रजातियों से crispr सिस्टम को स्तनधारी कोशिकाओं में जीनोम संपादन प्रदर्शन करने में सक्षम होना दिखाया गया है । हालांकि, प्रौद्योगिकी के स्पष्ट सादगी के बावजूद, कई डिजाइन मापदंडों पर विचार किया जा करने की जरूरत है, जो अक्सर कैसे सबसे अच्छा अपने जीनोम संपादन प्रयोगों को पूरा करने के बारे में उलझन में उपयोगकर्ताओं को छोड़ दें । यहां, हम प्रयोगात्मक डिजाइन से सेल क्लोन की पहचान करने के लिए एक पूर्ण कार्यप्रवाह का वर्णन है कि वांछित डीएनए संशोधनों ले, स्तनधारी सेल लाइनों में जीनोम संपादन प्रयोगों के सफल निष्पादन को सुविधाजनक बनाने के लक्ष्य के साथ । हम उपयोगकर्ताओं के लिए कुंजी विचार पर प्रकाश डाला CRISPR प्रणाली, स्पेसर लंबाई, और एक एकल-असहाय ओलिगोडिऑक्सिन्यूकोटाइड (ssODN) दाता टेंपलेट के डिजाइन के विकल्प सहित, का ध्यान रखना । हम कल्पना करते है कि इस कार्यप्रवाह जीन पीटकर अध्ययन, रोग मॉडलिंग के प्रयासों, या रिपोर्टर सेल लाइनों की पीढ़ी के लिए उपयोगी हो जाएगा ।
Introduction
किसी भी जीवित जीव के जीनोम इंजीनियर करने की क्षमता कई जैव चिकित्सा और जैव प्रौद्योगिकीय अनुप्रयोगों, जैसे रोग के सुधार के रूप में परिवर्तन, रोग अध्ययन के लिए सटीक सेलुलर मॉडल के निर्माण, या कृषि के उत्पादन वांछित लक्षण के साथ फसलों । सदी की बारी के बाद से, स्तनधारी कोशिकाओं में जीनोम इंजीनियरिंग के लिए विभिन्न प्रौद्योगिकियों का विकास किया गया है, जिनमें मेगान्यूक्लीसिस1,2,3, जिंक फिंगर न्यूक्लिसेस4,5, या प्रतिलेखन उत्प्रेरक-जैसे अमोघ नाभिकों (टैलेंस)6,7,8,9. हालांकि, इन पहले प्रौद्योगिकियों या तो कार्यक्रम के लिए मुश्किल है या इकट्ठा करना कठिन है, जिससे अनुसंधान और उद्योग में अपने व्यापक अपनाने बाधा ।
हाल के वर्षों में, संकुल नियमित रूप से interspaced लघु palindromic दोहराता (CRISPR)-CRISPR-एसोसिएटेड (कैस) प्रणाली एक शक्तिशाली नए जीनोम इंजीनियरिंग प्रौद्योगिकी10,11के रूप में उभरा है । मूल रूप से बैक्टीरिया में एक अनुकूली प्रतिरक्षा प्रणाली, यह सफलतापूर्वक पौधों और जानवरों, मनुष्यों सहित में जीनोम संशोधन के लिए तैनात किया गया है । एक प्राथमिक कारण CRISPR-कैस इतने कम समय में इतनी लोकप्रियता प्राप्त की है कि तत्व है कि Cas9 या Cas12a (भी Cpf1 के रूप में जाना जाता है) के रूप में महत्वपूर्ण कैस endonuclease, लाता है, जीनोम में सही स्थान के लिए बस चिमेरिक एकल गाइड का एक छोटा टुकड़ा है RN एक (sgRNA), जो डिजाइन और सस्ते synthesize करने के लिए सीधा है । लक्ष्य स्थल पर भर्ती होने के बाद, कैस एंजाइम आणविक कैंची और cleaves की एक जोड़ी के रूप में कार्य करता है अपने ruvc, hnh, या nuc डोमेन12,13,14के साथ बंधे डीएनए । परिणामस्वरूप डबल फंसे तोड़ (DSB) बाद में या तो गैर-समजातीय अंत में शामिल होने (NHEJ) या homology-निर्देशित मरंमत (HDR) मार्ग के माध्यम से कोशिकाओं द्वारा मरंमत की है । एक मरंमत टेम्पलेट के अभाव में, DSB त्रुटि-प्रवण NHEJ मार्ग द्वारा सुधारा गया है, जो कटौती साइट पर छद्म यादृच्छिक प्रविष्टि या न्यूक्लियोटिडों (indels) के विलोपन को जंम दे सकता है, संभवतः प्रोटीन-कोडिंग जीन में frameshift म्यूटेशन के कारण । हालांकि, एक दाता टेंपलेट है कि वांछित डीएनए परिवर्तन शामिल की उपस्थिति में, DSB उच्च निष्ठा HDR मार्ग द्वारा मरंमत की है । दाता टेम्पलेट्स के आम प्रकार एकल-कतरा हुआ oligonuक्लिओटाइड्स (ssODNs) और plasmids शामिल हैं । पूर्व आम तौर पर अगर इरादा डीएनए परिवर्तन (उदाहरण के लिए, एक एकल आधार जोड़ी के परिवर्तन) छोटे है प्रयोग किया जाता है, जबकि बाद आम तौर पर अगर एक एक अपेक्षाकृत लंबे अनुक्रम (उदाहरण के लिए, एक हरी फ्लोरोसेंट प्रोटीन के कोडन अनुक्रम डालने की इच्छा है प्रयोग किया जाता है जीएफपी) लक्ष्य लोकस में ।
कैस प्रोटीन की एंडोन्यूक्लिएज गतिविधि के लिए लक्ष्य स्थल15पर एक प्रोटोस्पेसर सटी आकृति (पाम) की उपस्थिति की आवश्यकता होती है । Cas9 का पाम protospacer के 3 ‘ अंत में है, जबकि Cas12a के पाम (भी Cpf1 कहा जाता है) 5 ‘ अंत में16के बजाय है । कैस-गाइड आरएनए परिसर में एक DSB पेश करने में असमर्थ है अगर पाम अनुपस्थित है17। अतः पाम उन जीनोमिक स्थानों पर एक बाधा रखता है जहाँ एक विशेष कैस नाभिक सट कर आ जाता है । सौभाग्य से, विभिन्न जीवाणु प्रजातियों से कैस नाभिक आमतौर पर विभिन्न पाम आवश्यकताओं का प्रदर्शन. इसलिए, हमारे इंजीनियरिंग toolbox में विभिन्न CRISPR-Cas सिस्टम को एकीकृत करके, हम एक जीनोम में लक्षित किया जा सकता है कि साइटों की सीमा का विस्तार कर सकते हैं । इसके अलावा, एक प्राकृतिक कैस एंजाइम इंजीनियर या वैकल्पिक पाम दृश्यों को पहचानने के लिए विकसित किया जा सकता है, और अधिक हेरफेर करने के लिए सुलभ जीनोमिक लक्ष्यों की गुंजाइश को चौड़ा करने18,19,20।
हालांकि कई CRISPR-कैस सिस्टम जीनोम इंजीनियरिंग प्रयोजनों के लिए उपलब्ध हैं, प्रौद्योगिकी के अधिकांश उपयोगकर्ताओं को Cas9 nuclease पर मुख्य रूप से कई कारणों के लिए स्ट्रेप्टोकोकस pyogenes (SpCas9) से भरोसा किया है । सबसे पहले, यह एक अपेक्षाकृत बस NGG पाम की आवश्यकता है, कई अंय कैस प्रोटीन के विपरीत है कि केवल अधिक जटिल PAMs की उपस्थिति में सट कर सकते हैं । दूसरा, यह मानव कोशिकाओं21,22,23,24में सफलतापूर्वक तैनात किया जाने वाला पहला कैस एंडोन्यूक्लिएज है । तीसरा, SpCas9 अब तक की तारीख को सबसे अच्छी विशेषता एंजाइम है । यदि एक शोधकर्ता एक और कैस nuclease का उपयोग करना चाहता है, वह या वह अक्सर कैसे सबसे अच्छा प्रयोग डिजाइन और कितनी अच्छी तरह अंय एंजाइमों अलग जैविक संदर्भों में SpCas9 की तुलना में प्रदर्शन करेंगे के बारे में स्पष्ट नहीं होगा ।
अलग CRISPR-Cas सिस्टम के सापेक्ष प्रदर्शन के लिए स्पष्टता प्रदान करने के लिए, हम हाल ही में पांच Cas endonucleases की एक व्यवस्थित तुलना प्रदर्शन किया है – SpCas9, Staphylococcus औरेअस से Cas9 एंजाइम (SaCas9), Cas9 एंजाइम से नेइससेरिया मेनिनगिटिडिस (NmCas9), एसिडमिनोकोकस एसपी. BV3L6 (AsCas12a) से Cas12a एंजाइम, और लच्नोस्पाइरेसी बैक्टीरियम Cas12a (ND2006)25से LbCas12a एंजाइम । एक निष्पक्ष तुलना के लिए, हम विभिंन कैस नाभिक लक्ष्य साइटों और अंय प्रायोगिक शर्तों के एक ही सेट का उपयोग कर मूल्यांकन किया । अध्ययन में प्रत्येक CRISPR-Cas प्रणाली के लिए डिजाइन पैरामीटरों को भी चित्रित किया गया है, जो प्रौद्योगिकी के प्रयोक्ताओं के लिए उपयोगी संदर्भ के रूप में कार्य करेगा । यहां, बेहतर शोधकर्ताओं CRISPR-कैस प्रणाली का उपयोग करने के लिए सक्षम करने के लिए, हम अलग Cas9 और Cas12a एंजाइमों के साथ इष्टतम जीनोम इंजीनियरिंग के लिए एक कदम दर कदम प्रोटोकॉल प्रदान ( चित्रा 1देखें) । प्रोटोकॉल न केवल प्रयोगात्मक विवरण पर भी महत्वपूर्ण डिजाइन विचार शामिल स्तनधारी कोशिकाओं में एक सफल जीनोम इंजीनियरिंग परिणाम की संभावना को अधिकतम करने के लिए ।
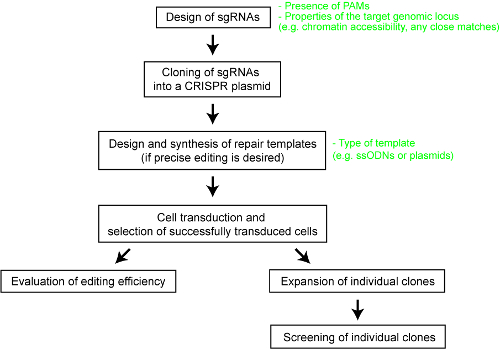
चित्रा 1 : जीनोम संपादित मानव कोशिका रेखाएँ उत्पन्न करने के लिए कार्यप्रवाह का अवलोकन. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
Protocol
Representative Results
Discussion
CRISPR-कैस प्रणाली एक शक्तिशाली, क्रांतिकारी प्रौद्योगिकी के लिए जीनोम इंजीनियर और पौधों और जानवरों के transcriptomes है । कई जीवाणु प्रजातियों CRISPR-कैस सिस्टम, जो संभवतः जीनोम और transcriptome इंजीनियरिंग प्रयोजनों?…
Declarações
The authors have nothing to disclose.
Acknowledgements
M.H.T. के लिए एक एजेंसी द्वारा समर्थित है विज्ञान प्रौद्योगिकी और अनुसंधान के संयुक्त परिषद कार्यालय अनुदान (1431AFG103), एक राष्ट्रीय चिकित्सा अनुसंधान परिषद अनुदान (OFIRG/0017/2016), राष्ट्रीय अनुसंधान फाउंडेशन अनुदान (NRF2013-THE001-046 और NRF2013-THE001-093), एक शिक्षा मंत्रालय टियर 1 अनुदान (RG50/17 (S)), Nanyang प्रौद्योगिकी विश्वविद्यालय से एक स्टार्टअप अनुदान, और Nanyang प्रौद्योगिकी विश्वविद्यालय से अंतरराष्ट्रीय आनुवंशिक रूप से इंजीनियरिंग मशीन (iGEM) प्रतियोगिता के लिए धन ।
Materials
| T4 Polynucleotide Kinase (PNK) | NEB | M0201 | |
| Shrimp Alkaline Phosphatase (rSAP) | NEB | M0371 | |
| Tris-Acetate-EDTA (TAE) Buffer, 50X | 1st Base | BUF-3000-50X4L | Dilute to 1X before use. The 1X solution contains 40 mM Tris, 20 mM acetic acid, and 1 mM EDTA. |
| Tris-EDTA (TE) Buffer, 10X | 1st Base | BUF-3020-10X4L | Dilute to 1X before use. The 1X solution contains 10 mM Tris (pH 8.0) and 1 mM EDTA. |
| BbsI | NEB | R0539 | |
| BsmBI | NEB | R0580 | |
| T4 DNA Ligase | NEB | M0202 | 400,000 units/ml |
| Quick Ligation Kit | NEB | M2200 | An alternative to T4 DNA Ligase. |
| Rapid DNA Ligation Kit | Thermo Scientific | K1423 | An alternative to T4 DNA Ligase. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Scientific | 451245 | The salt solution comes with the TOPO vector in the kit. |
| NEBuilder HiFi DNA Assembly Master Mix | NEB | E2621L | Kit for Gibson assembly. |
| One Shot Stbl3 Chemically Competent E.Coli | Thermo Scientific | C737303 | |
| LB Broth (Lennox), powder | Sigma Aldrich | L3022 | Reconstitute in ddH20, and autoclave before use |
| LB Broth with Agar (Lennox), powder | Sigma Aldrich | L2897 | Reconstitute in ddH20, and autoclave before use |
| SOC media | – | – | 2.5 mM KCl, 10 mM MgCl2, 20 mM glucose in 1 L of LB Broth |
| Ampicillin (Sodium), USP Grade | Gold Biotechnology | A-301 | |
| REDiant 2X PCR Mastermix | 1st Base | BIO-5185 | |
| Agarose | 1st Base | BIO-1000 | |
| T7 Endonuclease I | NEB | M0302 | |
| Plasmid DNA Extraction Miniprep Kit | Favorgen | FAPDE 300 | |
| Dulbecco's Modified Eagle Medium (DMEM), High Glucose | Hyclone | SH30081.01 | 4.5 g/L Glucose, no L-glutamine, HEPES and Sodium Pyruvate |
| L-Glutamine, 200mM | Gibco | 25030 | |
| Penicillin-Streptomycin, 10, 000U/mL | Gibco | 15140 | |
| 0.25% Trypsin-EDTA, 1X | Gibco | 25200 | |
| Fetal Bovine Serum | Hyclone | SV30160 | FBS is heat inactivated before use at 56 oC for 30 min |
| Phosphate Buffered Saline, 1X | Gibco | 20012 | |
| jetPRIME transfection reagent | Polyplus Transfection | 114-75 | |
| QuickExtract DNA Extraction Solution, 1.0 | Epicentre | LUCG-QE09050 | |
| ISOLATE II Genomic DNA Kit | Bioline | BIO-52067 | An alternative to QuickExtract |
| Q5 High-Fidelity DNA Polymerase | NEB | M0491 | |
| Deoxynucleotide (dNTP) Solution Mix | NEB | N0447 | |
| 6X DNA Loading Dye | Thermo Scientific | R0611 | 10 mM Tris-HCl (pH 7.6) 0.03% bromophenol blue, 0.03% xylene cyanol FF, 60% glycerol, 60 mM EDTA |
| Protease Inhibitor Cocktail, Set3 | Merck | 539134 | |
| Nitrocellulose membrane, 0.2µm | Bio-Rad | 1620112 | |
| Tris-glycine-SDS buffer, 10X | Bio-Rad | 1610772 | Dilute to 1X before use. The 1x solution contains 25 mM Tris, 192 mM glycine, and 0.1% SDS. |
| Tris-glycine buffer, 10X | 1st base | BUF-2020 | Dilute to 1X before use. The 1x solution contains 25 mM Tris and 192 mM glycine. |
| Ponceau S solution | Sigma Aldrich | P7170 | |
| TBS, 20X | 1st base | BUF-3030 | Dilute to 1X before use. The 1x solution contains 25 mM Tris-HCl (pH 7.5) and 150 mM NaCl. |
| Tween 20 | Sigma Aldrich | P9416 | |
| Skim Milk for immunoassay | Nacalai Tesque | 31149-75 | |
| WesternBright Sirius-femtogram HRP | Advansta | K12043 | |
| Antibody for β-actin (C4) | Santa Cruz Biotechnology | sc-47778 | Lot number: C0916 |
| MiSeq system | Illumina | SY-410-1003 | |
| NanoDrop spectrophotometer | Thermo Scientific | ND-2000 | |
| Qubit fluorometer | Thermo Scientific | Q33226 | |
| EVOS FL Cell Imaging System | Thermo Scientific | AMF4300 | |
| CRISPR plasmid: pSpCas9(BB)-2A-GFP (PX458) | Addgene | 48138 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: pX601-AAV-CMV::NLS-SaCas9-NLS-3xHA-bGHpA | Addgene | 61591 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: xCas9 3.7 | Addgene | 108379 | Dual vector system: The gRNA is expressed from a different plasmid. |
| CRISPR plasmid: pX330-U6-Chimeric_BB-CBh-hSpCas9 | Addgene | 42230 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: hCas9 | Addgene | 41815 | Dual vector system: The gRNA is expressed from a different plasmid. |
| CRISPR plasmid: eSpCas9(1.1) | Addgene | 71814 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: VP12 (SpCas9-HF1) | Addgene | 72247 | Dual vector system: The gRNA is expressed from a different plasmid. |
Referências
- Epinat, J. C., et al. A novel engineered meganuclease induces homologous recombination in yeast and mammalian cells. Nucleic Acids Research. 31 (11), 2952-2962 (2003).
- Arnould, S., et al. Engineered I-CreI derivatives cleaving sequences from the human XPC gene can induce highly efficient gene correction in mammalian cells. Journal of Molecular Biology. 371 (1), 49-65 (2007).
- Chapdelaine, P., Pichavant, C., Rousseau, J., Paques, F., Tremblay, J. P. Meganucleases can restore the reading frame of a mutated dystrophin. Gene Therapy. 17 (7), 846-858 (2010).
- Carroll, D. Genome engineering with zinc-finger nucleases. Genética. 188 (4), 773-782 (2011).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nature Reviews Genetics. 11 (9), 636-646 (2010).
- Miller, J. C., et al. A TALE nuclease architecture for efficient genome editing. Nature Biotechnology. 29 (2), 143-148 (2011).
- Zhang, F., et al. Efficient construction of sequence-specific TAL effectors for modulating mammalian transcription. Nature Biotechnology. 29 (2), 149-153 (2011).
- Boch, J., et al. Breaking the code of DNA binding specificity of TAL-type III effectors. Science. 326 (5959), 1509-1512 (2009).
- Moscou, M. J., Bogdanove, A. J. A simple cipher governs DNA recognition by TAL effectors. Science. 326 (5959), 1501 (2009).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nature Biotechnology. 32 (4), 347-355 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Nishimasu, H., et al. Crystal structure of Cas9 in complex with guide RNA and target DNA. Cell. 156 (5), 935-949 (2014).
- Yamano, T., et al. Crystal Structure of Cpf1 in Complex with Guide RNA and Target DNA. Cell. 165 (4), 949-962 (2016).
- Swarts, D. C., Mosterd, C., van Passel, M. W., Brouns, S. J. CRISPR interference directs strand specific spacer acquisition. PLoS One. 7 (4), e35888 (2012).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).
- Sternberg, S. H., Redding, S., Jinek, M., Greene, E. C., Doudna, J. A. DNA interrogation by the CRISPR RNA-guided endonuclease Cas9. Nature. 507 (7490), 62-67 (2014).
- Hu, J. H., et al. Evolved Cas9 variants with broad PAM compatibility and high DNA specificity. Nature. 556 (7699), 57-63 (2018).
- Kleinstiver, B. P., et al. Broadening the targeting range of Staphylococcus aureus CRISPR-Cas9 by modifying PAM recognition. Nature Biotechnology. 33 (12), 1293-1298 (2015).
- Kleinstiver, B. P., et al. Engineered CRISPR-Cas9 nucleases with altered PAM specificities. Nature. 523 (7561), 481-485 (2015).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Jinek, M., et al. RNA-programmed genome editing in human cells. Elife. 2, e00471 (2013).
- Cho, S. W., Kim, S., Kim, J. M., Kim, J. S. Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nature Biotechnology. 31 (3), 230-232 (2013).
- Wang, Y., et al. Systematic evaluation of CRISPR-Cas systems reveals design principles for genome editing in human cells. Genome Biology. 19 (1), 62 (2018).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Hou, Z., et al. Efficient genome engineering in human pluripotent stem cells using Cas9 from Neisseria meningitidis. Proceedings of the National Academy of Sciences U S A. 110 (39), 15644-15649 (2013).
- Kim, E., et al. In vivo genome editing with a small Cas9 orthologue derived from Campylobacter jejuni. Nature Communications. 8, 14500 (2017).
- Edraki, A., et al. A Compact, High-Accuracy Cas9 with a Dinucleotide PAM for In Vivo Genome Editing. Molecular Cell. , (2018).
- Chatterjee, P., Jakimo, N., Jacobson, J. M. Minimal PAM specificity of a highly similar SpCas9 ortholog. Science Advances. 4 (10), (2018).
- Muller, M., et al. Streptococcus thermophilus CRISPR-Cas9 Systems Enable Specific Editing of the Human Genome. Mol Therapy. 24 (3), 636-644 (2016).
- Esvelt, K. M., et al. Orthogonal Cas9 proteins for RNA-guided gene regulation and editing. Nature Methods. 10 (11), 1116-1121 (2013).
- Boratyn, G. M., et al. BLAST: a more efficient report with usability improvements. Nucleic Acids Research. 41 (Web Server issue), W29-W33 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnology. 31 (9), 827-832 (2013).
- Montague, T. G., Cruz, J. M., Gagnon, J. A., Church, G. M., Valen, E. CHOPCHOP: a CRISPR/Cas9 and TALEN web tool for genome editing. Nucleic Acids Research. 42 (Web Server issue), W401-W407 (2014).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 122-123 (2014).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biology. 17 (1), 148 (2016).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30 (10), 1473-1475 (2014).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnology. 34 (3), 339-344 (2016).
- Richardson, C. D., Ray, G. J., Bray, N. L., Corn, J. E. Non-homologous DNA increases gene disruption efficiency by altering DNA repair outcomes. Nature Communications. 7, 12463 (2016).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Zhang, J. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biology. 18 (1), 35 (2017).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shmakov, S., et al. Diversity and evolution of class 2 CRISPR-Cas systems. Nature Reviews Microbiology. 15 (3), 169-182 (2017).
- Moreno-Mateos, M. A., et al. CRISPR-Cpf1 mediates efficient homology-directed repair and temperature-controlled genome editing. Nature Communications. 8 (1), 2024 (2017).
- Lin, S., Staahl, B. T., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. Elife. 3, e04766 (2014).
- Yang, L., et al. Optimization of scarless human stem cell genome editing. Nucleic Acids Research. 41 (19), 9049-9061 (2013).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).

