تحرير الجينوم في "خطوط خلايا الثدييات" استخدام Cas كريسبر
Summary
كريسبر Cas تقنية قوية هندسة الجينوم معقدة من النباتات والحيوانات. هنا، نحن بالتفصيل وضع بروتوكول لكفاءة تحرير الجينوم البشري باستخدام مختلف Cas اندونوكليسيس. نسلط الضوء على الاعتبارات الهامة ومعايير التصميم لتحسين كفاءة التحرير.
Abstract
النظام يكرر المتناوب القصير إينتيرسباسيد بانتظام (كريسبر) متفاوت المسافات يعمل بطبيعة الحال في مناعة التكيفية البكتيرية، ولكن قد تم بنجاح إعادة توجيه الغرض منه لهندسة الجينوم في العديد من الكائنات الحية المختلفة. الأكثر شيوعاً، المرتبطة wildtype كريسبر 9 (Cas9) أو اندونوكليسي Cas12a ويستخدم تهزم مواقع محددة في الجينوم، بعدها يتم إصلاح كسر مزدوج تقطعت الحمض النووي عن طريق النهاية غير المتجانسة الانضمام إلى مسار (نج) أو (إصلاح الموجه من التماثل مسار HDR) تبعاً لما إذا كان قالب المانحين غائبة أو الموجودة على التوالي. وحتى الآن، أظهرت نظم كريسبر من الأنواع البكتيرية المختلفة لتكون قادرة على أداء التحرير الجينوم في خلايا الثدييات. ومع ذلك، على الرغم من بساطة الظاهر للتكنولوجيا، عدة بارامترات التصميم يلزم النظر، التي غالباً ما تترك المستخدمين في حيرة حول كيفية أفضل الاضطلاع بالجينوم تحرير التجارب. وهنا يصف لنا سير عمل كاملة من التصميم التجريبي لتحديد الهوية لاستنساخ الخلايا التي تحمل المرجوة من تعديلات الحمض النووي، بهدف تيسير التنفيذ الناجح للجينوم تحرير تجارب في خطوط خلايا الثدييات. نؤكد على الاعتبارات الرئيسية للمستخدمين أن تحيط علما، بما في ذلك اختيار نظام كريسبر وطول فاصل وتصميم قالب المانحين الذين تقطعت بهم السبل-واحد أوليجوديوكسينوكليوتيدي (سودن). ونحن نتصور أن سير العمل هذا سيكون مفيداً لدراسات الجينات خروج المغلوب، المرض النمذجة الجهود، أو توليد مراسل خلية خطوط.
Introduction
القدرة على هندسة الجينوم من أي كائن حي لديه العديد من التطبيقات الطبية الحيوية والتكنولوجيا الحيوية، مثل تصحيح الأمراض المسببة للطفرات، وبناء النماذج الخلوية الدقيقة لدراسات الأمراض، أو توليد الزراعية المحاصيل مع الصفات المرغوب فيه. منذ مطلع هذا القرن، تم استحداث تكنولوجيات مختلفة لهندسة الجينوم في خلايا الثدييات، بما في ذلك ميجانوكليسيس1،2،3، زنك إصبع نوكليسيس4،5، أو النسخ المستجيب المنشط–مثل نوكليسيس (تالينس)6،7،،من89. هذه التكنولوجيات السابقة غير صعبة للبرنامج أو شاقة التجمع، مما يعوق اعتمادها على نطاق واسع في البحوث والصناعة.
في السنوات الأخيرة، بشكل منتظم مجمع إينتيرسباسيد في يكرر المتناوب قصيرة (كريسبر)-برز نظام المرتبطة كريسبر (Cas) جينوم جديدة قوية هندسة تكنولوجيا10،11. أصلاً نظام المناعة تكيفية في البكتيريا، قد تم بنجاح نشر لتعديل الجينوم في النباتات والحيوانات، بما فيها البشر. سبب الرئيسي لماذا كريسبر Cas قد اكتسب شعبية الكثير في وقت قصير كهذا هو أن العنصر الذي يجلب endonuclease الأكاديمية الرئيسية، مثل Cas9 أو Cas12a (المعروفة أيضا باسم Cpf1)، إلى الموقع الصحيح في الجينوم هو مجرد قطعة قصيرة من دليل واحد تشيميريك RN (سجرنا)، وهي واضحة للتصميم ورخيصة توليف. بعد تجنيدهم إلى الموقع المستهدف، تعمل مقص الجزيئية الإنزيم Cas وكليافيس الحمض النووي المرتبطة مع به روفك، HNH، أو نشاط المجالات12،،من1314. بعد ذلك يتم إصلاح كسر الذين تقطعت بهم السبل مزدوجة الناتجة (جهاز تسوية المنازعات) بالخلايا عن طريق نهاية غير المتجانسة الالتحاق بالعمل (نج) أو مسار الإصلاح الموجه من التماثل (HDR). في غياب إصلاح قالب، يتم إصلاح جهاز تسوية المنازعات بالمسار نهيج عرضه للخطأ، ويمكن أن يؤدي إلى شبه عشوائي الإدراج أو الحذف من النيوكليوتيدات (إينديلس) في موقع قص، يحتمل أن تسبب فراميشيفت الطفرات في الجينات ترميز البروتين. ومع ذلك، حضور الجهات مانحة قالب يحتوي على الحمض النووي التغييرات المطلوبة، يتم إصلاح جهاز تسوية المنازعات بالمسار HDR عالية الدقة. وتشمل الأنواع الشائعة من قوالب المانحة النوكليوتيد المفرد-الذين تقطعت بهم السبل (سودنس) ووالبلازميدات. عادة ما تستخدم في السابق إذا كانت التغييرات الحمض النووي المقصود صغيرة (على سبيل المثال، تغيير زوج قاعدة واحدة)، في حين أن هذا الأخير يستخدم عادة إذا كان أحد يرغب في إدراج تسلسل طويلة نسبيا (على سبيل المثال، تسلسل ترميز بروتين فلوري أخضر أو التجارة والنقل) إلى المكان المستهدف.
النشاط اندونوكليسي من البروتين Cas يتطلب وجود بروتوسباسير عزر المتاخمة (بام) في الموقع المستهدف15. بام Cas9 في نهاية 3 ‘بروتوسباسير، بينما بام Cas12a (وتسمى أيضا Cpf1) في النهاية 5’ بدلاً من16. Cas-دليل الحمض النووي الريبي المعقدة غير قادر على عرض جهاز تسوية المنازعات إذا تغيب17بام. ومن ثم، بام يضع قيداً على مواقع الجينوم قادرة على تنشق فيه نوكلاس Cas خاصة. لحسن الحظ، يحمل nucleases الأكاديمية الصينية للعلوم من مختلف الأنواع البكتيرية عادة متطلبات مختلفة بام. ومن ثم، بإدماج مختلف Cas كريسبر نظم لدينا الأدوات الهندسية، نحن توسيع نطاق المواقع التي قد تكون مستهدفة في جينوم. وعلاوة على ذلك، يمكن إجراء هندسة عكسية إنزيم الأكاديمية الصينية للعلوم طبيعية أو تطورت إلى الاعتراف بتسلسل بام بديلة، مزيد من توسيع نطاق أهداف الجينوم موجوداً للتلاعب18،،من1920.
على الرغم من أن تتوفر أنظمة كريسبر Cas متعددة الأغراض الهندسية الجينوم، اعتمدت معظم المستخدمين لهذه التكنولوجيا أساسا على نوكلاس Cas9 من العقدية المقيّحة (SpCas9) لأسباب متعددة. أولاً، فإنه يتطلب أم نج نسبيا ببساطة، خلافا للعديد من البروتينات Cas الأخرى التي يمكن أن تهزم سوى حضور PAMs أكثر تعقيداً. وثانيا، أنها endonuclease الأكاديمية الأولى التي سيتم نشرها بنجاح في الخلايا البشرية21،22،،من2324. وثالثاً، SpCas9 هو إلى حد بعيد أفضل الإنزيم تتسم حتى الآن. إذا لم يرغب باحث في استخدام آخر Cas نوكلاس، أنه أو أنها غالباً ما ستكون واضحة بشأن أفضل السبل لتصميم التجربة وجيدا كيف سوف تؤدي الإنزيمات الأخرى في مختلف السياقات البيولوجي مقارنة SpCas9.
توفير الوضوح لأداء مختلف Cas كريسبر النظم النسبية، قد أجرينا مؤخرا مقارنة منهجية لخمسة Cas اندونوكليسيس-SpCas9، الإنزيم Cas9 من المكوّرات العنقودية الذهبية (SaCas9)، الإنزيم Cas9 من وجود النيسرية السحائية (NmCas9)، الإنزيم Cas12a من أسيدامينوكوككوس sp. BV3L6 (AsCas12a)، والانزيم Cas12a من بكتيريا لاتشنوسبيراسيي ND2006 (LbCas12a)25. لمقارنة منصفة، يمكننا تقييم nucleases Cas مختلفة باستخدام نفس مجموعة من المواقع المستهدفة وغيرها من الشروط التجريبية. الدراسة أيضا تحديد معايير التصميم لكل نظام كريسبر-الأكاديمية الصينية للعلوم، الذي سيكون بمثابة مرجع مفيد للمستخدمين للتكنولوجيا. هنا، على نحو أفضل تمكن الباحثين من الاستفادة من كريسبر-الأكاديمية الصينية للعلوم نظام، نحن نقدم بروتوكول خطوة بخطوة لهندسة الجينوم الأمثل مع مختلف الإنزيمات Cas9 و Cas12a (انظر الشكل 1). ليس فقط يتضمن البروتوكول التجريبي من التفاصيل لكن الاعتبارات الخاصة بالتصميم أيضا أقصى حد احتمال نتيجة هندسة الجينوم ناجحة في خلايا الثدييات.
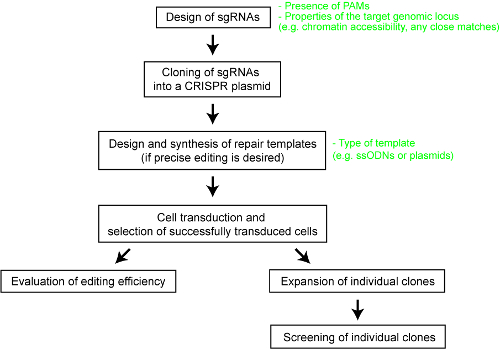
الشكل 1 : لمحة عامة عن سير العمل لتوليد الجينوم تحرير خطوط الخلايا البشرية- الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
Representative Results
Discussion
نظام كريسبر Cas تقنية قوية وثورية هندسة الجينوم وترانسكريبتوميس من النباتات والحيوانات. قد تم العثور على العديد من الأنواع البكتيرية تحتوي على نظم كريسبر-الأكاديمية الصينية للعلوم، التي يحتمل أن تكون قد تكون مناسبة للجينوم والترنسكربيتوم الهندسية أغراض44. على الرغم من أن اند?…
Declarações
The authors have nothing to disclose.
Acknowledgements
M.H.T. معتمد من قبل وكالة للعلوم والتكنولوجيا والبحوث في “مكتب مشترك لمجلس” المنح (1431AFG103)، منح “مجلس وطني للبحوث الطبية” (أوفيرج/0017/2016)، تمنح “المؤسسة الوطنية للأبحاث” (NRF2013-THE001-046) و (NRF2013-THE001-093 منح وزارة “التعليم المستوى” 1 (RG50/17 (ق))، بدء تشغيل منحة من جامعة نانيانغ التكنولوجية، والأموال للمنافسة “الدولية وراثيا الهندسة آلة” (الحكومي) من جامعة نانيانغ التكنولوجية.
Materials
| T4 Polynucleotide Kinase (PNK) | NEB | M0201 | |
| Shrimp Alkaline Phosphatase (rSAP) | NEB | M0371 | |
| Tris-Acetate-EDTA (TAE) Buffer, 50X | 1st Base | BUF-3000-50X4L | Dilute to 1X before use. The 1X solution contains 40 mM Tris, 20 mM acetic acid, and 1 mM EDTA. |
| Tris-EDTA (TE) Buffer, 10X | 1st Base | BUF-3020-10X4L | Dilute to 1X before use. The 1X solution contains 10 mM Tris (pH 8.0) and 1 mM EDTA. |
| BbsI | NEB | R0539 | |
| BsmBI | NEB | R0580 | |
| T4 DNA Ligase | NEB | M0202 | 400,000 units/ml |
| Quick Ligation Kit | NEB | M2200 | An alternative to T4 DNA Ligase. |
| Rapid DNA Ligation Kit | Thermo Scientific | K1423 | An alternative to T4 DNA Ligase. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Scientific | 451245 | The salt solution comes with the TOPO vector in the kit. |
| NEBuilder HiFi DNA Assembly Master Mix | NEB | E2621L | Kit for Gibson assembly. |
| One Shot Stbl3 Chemically Competent E.Coli | Thermo Scientific | C737303 | |
| LB Broth (Lennox), powder | Sigma Aldrich | L3022 | Reconstitute in ddH20, and autoclave before use |
| LB Broth with Agar (Lennox), powder | Sigma Aldrich | L2897 | Reconstitute in ddH20, and autoclave before use |
| SOC media | – | – | 2.5 mM KCl, 10 mM MgCl2, 20 mM glucose in 1 L of LB Broth |
| Ampicillin (Sodium), USP Grade | Gold Biotechnology | A-301 | |
| REDiant 2X PCR Mastermix | 1st Base | BIO-5185 | |
| Agarose | 1st Base | BIO-1000 | |
| T7 Endonuclease I | NEB | M0302 | |
| Plasmid DNA Extraction Miniprep Kit | Favorgen | FAPDE 300 | |
| Dulbecco's Modified Eagle Medium (DMEM), High Glucose | Hyclone | SH30081.01 | 4.5 g/L Glucose, no L-glutamine, HEPES and Sodium Pyruvate |
| L-Glutamine, 200mM | Gibco | 25030 | |
| Penicillin-Streptomycin, 10, 000U/mL | Gibco | 15140 | |
| 0.25% Trypsin-EDTA, 1X | Gibco | 25200 | |
| Fetal Bovine Serum | Hyclone | SV30160 | FBS is heat inactivated before use at 56 oC for 30 min |
| Phosphate Buffered Saline, 1X | Gibco | 20012 | |
| jetPRIME transfection reagent | Polyplus Transfection | 114-75 | |
| QuickExtract DNA Extraction Solution, 1.0 | Epicentre | LUCG-QE09050 | |
| ISOLATE II Genomic DNA Kit | Bioline | BIO-52067 | An alternative to QuickExtract |
| Q5 High-Fidelity DNA Polymerase | NEB | M0491 | |
| Deoxynucleotide (dNTP) Solution Mix | NEB | N0447 | |
| 6X DNA Loading Dye | Thermo Scientific | R0611 | 10 mM Tris-HCl (pH 7.6) 0.03% bromophenol blue, 0.03% xylene cyanol FF, 60% glycerol, 60 mM EDTA |
| Protease Inhibitor Cocktail, Set3 | Merck | 539134 | |
| Nitrocellulose membrane, 0.2µm | Bio-Rad | 1620112 | |
| Tris-glycine-SDS buffer, 10X | Bio-Rad | 1610772 | Dilute to 1X before use. The 1x solution contains 25 mM Tris, 192 mM glycine, and 0.1% SDS. |
| Tris-glycine buffer, 10X | 1st base | BUF-2020 | Dilute to 1X before use. The 1x solution contains 25 mM Tris and 192 mM glycine. |
| Ponceau S solution | Sigma Aldrich | P7170 | |
| TBS, 20X | 1st base | BUF-3030 | Dilute to 1X before use. The 1x solution contains 25 mM Tris-HCl (pH 7.5) and 150 mM NaCl. |
| Tween 20 | Sigma Aldrich | P9416 | |
| Skim Milk for immunoassay | Nacalai Tesque | 31149-75 | |
| WesternBright Sirius-femtogram HRP | Advansta | K12043 | |
| Antibody for β-actin (C4) | Santa Cruz Biotechnology | sc-47778 | Lot number: C0916 |
| MiSeq system | Illumina | SY-410-1003 | |
| NanoDrop spectrophotometer | Thermo Scientific | ND-2000 | |
| Qubit fluorometer | Thermo Scientific | Q33226 | |
| EVOS FL Cell Imaging System | Thermo Scientific | AMF4300 | |
| CRISPR plasmid: pSpCas9(BB)-2A-GFP (PX458) | Addgene | 48138 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: pX601-AAV-CMV::NLS-SaCas9-NLS-3xHA-bGHpA | Addgene | 61591 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: xCas9 3.7 | Addgene | 108379 | Dual vector system: The gRNA is expressed from a different plasmid. |
| CRISPR plasmid: pX330-U6-Chimeric_BB-CBh-hSpCas9 | Addgene | 42230 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: hCas9 | Addgene | 41815 | Dual vector system: The gRNA is expressed from a different plasmid. |
| CRISPR plasmid: eSpCas9(1.1) | Addgene | 71814 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: VP12 (SpCas9-HF1) | Addgene | 72247 | Dual vector system: The gRNA is expressed from a different plasmid. |
Referências
- Epinat, J. C., et al. A novel engineered meganuclease induces homologous recombination in yeast and mammalian cells. Nucleic Acids Research. 31 (11), 2952-2962 (2003).
- Arnould, S., et al. Engineered I-CreI derivatives cleaving sequences from the human XPC gene can induce highly efficient gene correction in mammalian cells. Journal of Molecular Biology. 371 (1), 49-65 (2007).
- Chapdelaine, P., Pichavant, C., Rousseau, J., Paques, F., Tremblay, J. P. Meganucleases can restore the reading frame of a mutated dystrophin. Gene Therapy. 17 (7), 846-858 (2010).
- Carroll, D. Genome engineering with zinc-finger nucleases. Genética. 188 (4), 773-782 (2011).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nature Reviews Genetics. 11 (9), 636-646 (2010).
- Miller, J. C., et al. A TALE nuclease architecture for efficient genome editing. Nature Biotechnology. 29 (2), 143-148 (2011).
- Zhang, F., et al. Efficient construction of sequence-specific TAL effectors for modulating mammalian transcription. Nature Biotechnology. 29 (2), 149-153 (2011).
- Boch, J., et al. Breaking the code of DNA binding specificity of TAL-type III effectors. Science. 326 (5959), 1509-1512 (2009).
- Moscou, M. J., Bogdanove, A. J. A simple cipher governs DNA recognition by TAL effectors. Science. 326 (5959), 1501 (2009).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nature Biotechnology. 32 (4), 347-355 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Nishimasu, H., et al. Crystal structure of Cas9 in complex with guide RNA and target DNA. Cell. 156 (5), 935-949 (2014).
- Yamano, T., et al. Crystal Structure of Cpf1 in Complex with Guide RNA and Target DNA. Cell. 165 (4), 949-962 (2016).
- Swarts, D. C., Mosterd, C., van Passel, M. W., Brouns, S. J. CRISPR interference directs strand specific spacer acquisition. PLoS One. 7 (4), e35888 (2012).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).
- Sternberg, S. H., Redding, S., Jinek, M., Greene, E. C., Doudna, J. A. DNA interrogation by the CRISPR RNA-guided endonuclease Cas9. Nature. 507 (7490), 62-67 (2014).
- Hu, J. H., et al. Evolved Cas9 variants with broad PAM compatibility and high DNA specificity. Nature. 556 (7699), 57-63 (2018).
- Kleinstiver, B. P., et al. Broadening the targeting range of Staphylococcus aureus CRISPR-Cas9 by modifying PAM recognition. Nature Biotechnology. 33 (12), 1293-1298 (2015).
- Kleinstiver, B. P., et al. Engineered CRISPR-Cas9 nucleases with altered PAM specificities. Nature. 523 (7561), 481-485 (2015).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Jinek, M., et al. RNA-programmed genome editing in human cells. Elife. 2, e00471 (2013).
- Cho, S. W., Kim, S., Kim, J. M., Kim, J. S. Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nature Biotechnology. 31 (3), 230-232 (2013).
- Wang, Y., et al. Systematic evaluation of CRISPR-Cas systems reveals design principles for genome editing in human cells. Genome Biology. 19 (1), 62 (2018).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Hou, Z., et al. Efficient genome engineering in human pluripotent stem cells using Cas9 from Neisseria meningitidis. Proceedings of the National Academy of Sciences U S A. 110 (39), 15644-15649 (2013).
- Kim, E., et al. In vivo genome editing with a small Cas9 orthologue derived from Campylobacter jejuni. Nature Communications. 8, 14500 (2017).
- Edraki, A., et al. A Compact, High-Accuracy Cas9 with a Dinucleotide PAM for In Vivo Genome Editing. Molecular Cell. , (2018).
- Chatterjee, P., Jakimo, N., Jacobson, J. M. Minimal PAM specificity of a highly similar SpCas9 ortholog. Science Advances. 4 (10), (2018).
- Muller, M., et al. Streptococcus thermophilus CRISPR-Cas9 Systems Enable Specific Editing of the Human Genome. Mol Therapy. 24 (3), 636-644 (2016).
- Esvelt, K. M., et al. Orthogonal Cas9 proteins for RNA-guided gene regulation and editing. Nature Methods. 10 (11), 1116-1121 (2013).
- Boratyn, G. M., et al. BLAST: a more efficient report with usability improvements. Nucleic Acids Research. 41 (Web Server issue), W29-W33 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnology. 31 (9), 827-832 (2013).
- Montague, T. G., Cruz, J. M., Gagnon, J. A., Church, G. M., Valen, E. CHOPCHOP: a CRISPR/Cas9 and TALEN web tool for genome editing. Nucleic Acids Research. 42 (Web Server issue), W401-W407 (2014).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 122-123 (2014).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biology. 17 (1), 148 (2016).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30 (10), 1473-1475 (2014).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnology. 34 (3), 339-344 (2016).
- Richardson, C. D., Ray, G. J., Bray, N. L., Corn, J. E. Non-homologous DNA increases gene disruption efficiency by altering DNA repair outcomes. Nature Communications. 7, 12463 (2016).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Zhang, J. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biology. 18 (1), 35 (2017).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shmakov, S., et al. Diversity and evolution of class 2 CRISPR-Cas systems. Nature Reviews Microbiology. 15 (3), 169-182 (2017).
- Moreno-Mateos, M. A., et al. CRISPR-Cpf1 mediates efficient homology-directed repair and temperature-controlled genome editing. Nature Communications. 8 (1), 2024 (2017).
- Lin, S., Staahl, B. T., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. Elife. 3, e04766 (2014).
- Yang, L., et al. Optimization of scarless human stem cell genome editing. Nucleic Acids Research. 41 (19), 9049-9061 (2013).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).

