Modification du génome dans des lignées de cellules mammifères à l’aide de CRISPR-Cas
Summary
SAE-CRISPR est une technologie puissante à l’ingénieur les génomes complexes de plantes et d’animaux. Ici, nous détaillons un protocole pour modifier efficacement le génome humain endonucléases de Cas différents. Nous mettons en évidence les considérations importantes et des paramètres de conception pour optimiser l’efficacité édition.
Abstract
Le système régulièrement dois‑je courts palindromes répétitions (CRISPR) en cluster fonctionne naturellement dans l’immunité adaptative bactérienne, mais a été réorienté avec succès pour le génie du génome chez de nombreux organismes de vie différents. Le plus souvent, le type sauvage CRISPR associés 9 (Cas9) ou endonucléase de Cas12a est utilisé en conjonction avec des sites spécifiques dans le génome, après quoi la rupture d’ADN double brin est réparée par l’intermédiaire de la fin non homologue, rejoindre la voie (NHEJ) ou le (réparation axés sur l’homologie Voie HDR) selon si un modèle de donneur est absent ou présentent respectivement. A ce jour, systèmes CRISPR provenant de différentes espèces bactériennes ont démontré être capable d’effectuer le montage de génome dans les cellules de mammifères. Toutefois, malgré l’apparente simplicité de la technologie, plusieurs paramètres de conception doivent être prises en considération qui laissent souvent perplexes sur la façon de mieux pour réaliser leur génome édition expériences les utilisateurs. Nous décrivons ici un workflow complet de conception expérimentale à l’identification des clones de cellules qui transportent les adaptations ADN désirées, dans le but de faciliter l’exécution réussie du génome édition des expériences dans des lignées cellulaires de mammifères. Nous mettons en évidence les considérations clés pour les utilisateurs de prendre note du, y compris le choix du système CRISPR, la longueur de l’entretoise et la conception d’un modèle de donateurs monocaténaire ODN (ssODN). Nous prévoyons que ce flux de travail vous sera utile pour les études de gènes knockout, modélisation des efforts, la maladie ou la génération de reporter des lignées cellulaires.
Introduction
La capacité à l’ingénieur le génome de tout organisme vivant a beaucoup d’applications biomédicales et biotechnologiques, telles que la correction des pathogènes mutations, construction de modèles cellulaires précis pour les études de la maladie, ou génération d’agricoles cultures avec traits désirables. Depuis le tournant du siècle, plusieurs technologies ont été développées pour le génie du génome dans les cellules de mammifères, y compris les méganucléases1,2,3, zinc finger nucleases4,5, ou transcription activator comme effecteur nucléases (TAPS)6,7,8,9. Cependant, ces technologies antérieures sont difficiles à programmer ou fastidieux à monter, ce qui entrave leur adoption généralisée dans la recherche et l’industrie.
Ces dernières années, le cluster régulièrement ponctuées de courtes répétitions palindromiques (CRISPR) – système associées à CRISPR (Cas) a émergé comme un puissant génome nouvel ingénierie technologie10,11. Initialement un système immunitaire adaptatif chez les bactéries, il a été correctement déployé pour la modification du génome chez les plantes et les animaux, y compris les humains. Des principales raisons pourquoi CRISPR-Cas a gagné en popularité autant en si peu de temps qui est l’élément qui apporte l’endonucléase de Cas clé, tels que Cas9 ou Cas12a (également connu comme Cpf1), à l’emplacement correct dans le génome est simplement un petit morceau de guide unique chimérique RN A (sgRNA), qui est simple de conception et pas cher à synthétiser. Après recrutement vers le site cible, l’enzyme Cas fonctionne comme une paire de ciseaux moléculaires et fend l’ADN lié avec son RuvC, HNH ou Nuc domaines12,13,14. La rupture de brin double (DSB) qui en résulte est réparée par la suite par les cellules via la fin non homologue rejoindre (NHEJ) ou voie de réparation axés sur l’homologie (HDR). En l’absence d’un modèle de la réparation, l’ORD est réparé par la voie NHEJ erreurs, qui peut donner lieu à pseudo-aléatoire d’insertion ou de suppression de nucléotides (indels) sur le site de la coupe, causant potentiellement déphasage des mutations dans les gènes codant pour des protéines. Toutefois, en présence d’un modèle de donateurs qui contient les modifications souhaitées de l’ADN, l’ORD est réparé par la voie du HDR haute fidélité. Types communs de modèles de donateurs comprennent des oligonucléotides monocaténaires (ssODNs) et plasmides. Le premier est généralement utilisé si les changements prévus de l’ADN sont de petite taille (par exemple, modification d’un seul nucléotide), alors que ce dernier est généralement utilisé si l’on veut introduire une séquence relativement longue (par exemple, la séquence codante d’une protéine fluorescente verte ou GFP) dans le locus de la cible.
L’activité endonucléasique de la protéine Cas nécessite la présence d’un motif adjacent de protospacer (PAM) à la cible site15. Le PAM de Cas9 est à l’extrémité 3′ de la protospacer, tandis que le PAM de Cas12a (également appelé Cpf1) est à l’extrémité 5′ à la place16. Le Cas-guide RNA complexe ne peut pas introduire un ORD si la PAM est absente17. Par conséquent, la PAM place une contrainte sur les génomiques emplacements où une nucléase de Cas particulier est capable de cliver. Heureusement, nucléases Cas de différentes espèces de bactéries présentent généralement des exigences différentes de PAM. Par conséquent, en intégrant différents systèmes CRISPR-Cas dans notre boîte à outils technique, nous pouvons élargir l’éventail des sites qui peuvent être ciblés dans un génome. En outre, une enzyme naturelle de Cas peut être conçue ou évoluée pour reconnaître les alternatives des séquences de PAM, encore élargir la portée de génomiques cibles accessibles aux manipulations18,19,20.
Bien que plusieurs systèmes CRISPR-Cas soient disponibles pour fins d’ingénierie du génome, la plupart des utilisateurs de la technologie sont appuient principalement sur la nucléase Cas9 de Streptococcus pyogenes (SpCas9) pour de multiples raisons. Tout d’abord, il faut un PAM relativement simplement NGG, contrairement à plusieurs autres protéines de Cas qui peuvent s’attacher uniquement en présence de SDS plus complexes. Deuxièmement, il est le premier endonucléase de Cas qui seront déployés avec succès dans les cellules humaines21,22,23,24. En troisième lieu, le SpCas9 est de loin la meilleure enzyme caractérisé à ce jour. Si un chercheur souhaite utiliser la nucléase un autre Cas, il ou elle serait souvent peu claire sur la meilleure façon de concevoir l’expérience et comment bien les autres enzymes seront produira dans différents contextes biologiques par rapport à SpCas9.
Pour fournir la clarté à la performance relative des différents systèmes CRISPR-Cas, nous avons récemment effectué une comparaison systématique des cinq endonucléases de Cas – SpCas9, l’enzyme Cas9 Staphylococcus aureus (SaCas9), l’enzyme Cas9 de Neisseria meningitidis (NmCas9), l’enzyme Cas12a de Acidaminococcus SP. BV3L6 (AsCas12a) et l’enzyme Cas12a de bactérie Lachnospiraceae ND2006 (LbCas12a)25. Pour une comparaison équitable, nous avons évalué les nucléases de Cas différents, en utilisant le même ensemble de sites cibles et autres conditions expérimentales. Les paramètres de conception d’étude aussi délimité pour chaque système de SAE-CRISPR, qui servirait de référence utile pour les utilisateurs de la technologie. Ici, pour mieux permettre aux chercheurs de faire usage de la SAE-CRISPR système, nous fournissons un protocole étape par étape pour le génie de génome optimale avec des enzymes de Cas9 et Cas12a différentes (voir Figure 1). Le protocole inclut non seulement les détails expérimentaux, mais les considérations de conception aussi important pour maximiser la probabilité d’un résultat technique génome réussie dans les cellules de mammifères.
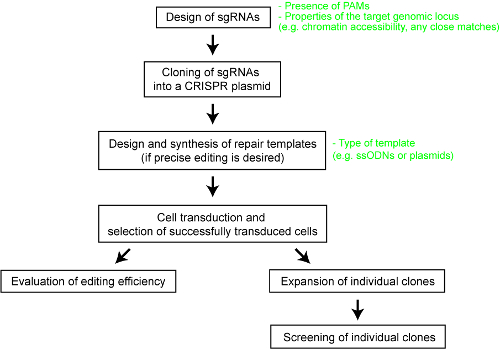
Figure 1 : Une vue d’ensemble du flux de travail pour générer du génome édité des lignées cellulaires humaines. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Le système CRISPR-Cas est une puissante technologie révolutionnaire à l’ingénieur les génomes et les transcriptions des plantes et des animaux. De nombreuses espèces bactériennes ont été trouvés pour contenir les systèmes CRISPR-Cas, qui peuvent éventuellement être adaptées pour le génome et transcriptome fins44d’ingénierie. Bien que l’endonucléase Cas9 de Streptococcus pyogenes (SpCas9) a été la première enzyme qui seront déployés avec succès dans les cellule…
Declarações
The authors have nothing to disclose.
Acknowledgements
M.H.T. est pris en charge par un organisme de délivrance de bureau conseil commun Science Technology and Research (1431AFG103), un Conseil National de la recherche médicale accorde (OFIRG/0017/2016), accorde à la National Research Foundation (NRF2013-THE001-046 et NRF2013-THE001-093), un Subvention du ministère de l’éducation niveau 1 (RG50/17 (S)), une startup subvention de Nanyang Technological University et les fonds pour le concours International génétiquement ingénierie Machine (iGEM) de Nanyang Technological University.
Materials
| T4 Polynucleotide Kinase (PNK) | NEB | M0201 | |
| Shrimp Alkaline Phosphatase (rSAP) | NEB | M0371 | |
| Tris-Acetate-EDTA (TAE) Buffer, 50X | 1st Base | BUF-3000-50X4L | Dilute to 1X before use. The 1X solution contains 40 mM Tris, 20 mM acetic acid, and 1 mM EDTA. |
| Tris-EDTA (TE) Buffer, 10X | 1st Base | BUF-3020-10X4L | Dilute to 1X before use. The 1X solution contains 10 mM Tris (pH 8.0) and 1 mM EDTA. |
| BbsI | NEB | R0539 | |
| BsmBI | NEB | R0580 | |
| T4 DNA Ligase | NEB | M0202 | 400,000 units/ml |
| Quick Ligation Kit | NEB | M2200 | An alternative to T4 DNA Ligase. |
| Rapid DNA Ligation Kit | Thermo Scientific | K1423 | An alternative to T4 DNA Ligase. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Scientific | 451245 | The salt solution comes with the TOPO vector in the kit. |
| NEBuilder HiFi DNA Assembly Master Mix | NEB | E2621L | Kit for Gibson assembly. |
| One Shot Stbl3 Chemically Competent E.Coli | Thermo Scientific | C737303 | |
| LB Broth (Lennox), powder | Sigma Aldrich | L3022 | Reconstitute in ddH20, and autoclave before use |
| LB Broth with Agar (Lennox), powder | Sigma Aldrich | L2897 | Reconstitute in ddH20, and autoclave before use |
| SOC media | – | – | 2.5 mM KCl, 10 mM MgCl2, 20 mM glucose in 1 L of LB Broth |
| Ampicillin (Sodium), USP Grade | Gold Biotechnology | A-301 | |
| REDiant 2X PCR Mastermix | 1st Base | BIO-5185 | |
| Agarose | 1st Base | BIO-1000 | |
| T7 Endonuclease I | NEB | M0302 | |
| Plasmid DNA Extraction Miniprep Kit | Favorgen | FAPDE 300 | |
| Dulbecco's Modified Eagle Medium (DMEM), High Glucose | Hyclone | SH30081.01 | 4.5 g/L Glucose, no L-glutamine, HEPES and Sodium Pyruvate |
| L-Glutamine, 200mM | Gibco | 25030 | |
| Penicillin-Streptomycin, 10, 000U/mL | Gibco | 15140 | |
| 0.25% Trypsin-EDTA, 1X | Gibco | 25200 | |
| Fetal Bovine Serum | Hyclone | SV30160 | FBS is heat inactivated before use at 56 oC for 30 min |
| Phosphate Buffered Saline, 1X | Gibco | 20012 | |
| jetPRIME transfection reagent | Polyplus Transfection | 114-75 | |
| QuickExtract DNA Extraction Solution, 1.0 | Epicentre | LUCG-QE09050 | |
| ISOLATE II Genomic DNA Kit | Bioline | BIO-52067 | An alternative to QuickExtract |
| Q5 High-Fidelity DNA Polymerase | NEB | M0491 | |
| Deoxynucleotide (dNTP) Solution Mix | NEB | N0447 | |
| 6X DNA Loading Dye | Thermo Scientific | R0611 | 10 mM Tris-HCl (pH 7.6) 0.03% bromophenol blue, 0.03% xylene cyanol FF, 60% glycerol, 60 mM EDTA |
| Protease Inhibitor Cocktail, Set3 | Merck | 539134 | |
| Nitrocellulose membrane, 0.2µm | Bio-Rad | 1620112 | |
| Tris-glycine-SDS buffer, 10X | Bio-Rad | 1610772 | Dilute to 1X before use. The 1x solution contains 25 mM Tris, 192 mM glycine, and 0.1% SDS. |
| Tris-glycine buffer, 10X | 1st base | BUF-2020 | Dilute to 1X before use. The 1x solution contains 25 mM Tris and 192 mM glycine. |
| Ponceau S solution | Sigma Aldrich | P7170 | |
| TBS, 20X | 1st base | BUF-3030 | Dilute to 1X before use. The 1x solution contains 25 mM Tris-HCl (pH 7.5) and 150 mM NaCl. |
| Tween 20 | Sigma Aldrich | P9416 | |
| Skim Milk for immunoassay | Nacalai Tesque | 31149-75 | |
| WesternBright Sirius-femtogram HRP | Advansta | K12043 | |
| Antibody for β-actin (C4) | Santa Cruz Biotechnology | sc-47778 | Lot number: C0916 |
| MiSeq system | Illumina | SY-410-1003 | |
| NanoDrop spectrophotometer | Thermo Scientific | ND-2000 | |
| Qubit fluorometer | Thermo Scientific | Q33226 | |
| EVOS FL Cell Imaging System | Thermo Scientific | AMF4300 | |
| CRISPR plasmid: pSpCas9(BB)-2A-GFP (PX458) | Addgene | 48138 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: pX601-AAV-CMV::NLS-SaCas9-NLS-3xHA-bGHpA | Addgene | 61591 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: xCas9 3.7 | Addgene | 108379 | Dual vector system: The gRNA is expressed from a different plasmid. |
| CRISPR plasmid: pX330-U6-Chimeric_BB-CBh-hSpCas9 | Addgene | 42230 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: hCas9 | Addgene | 41815 | Dual vector system: The gRNA is expressed from a different plasmid. |
| CRISPR plasmid: eSpCas9(1.1) | Addgene | 71814 | Single vector system: The gRNA is expressed from the same plasmid. |
| CRISPR plasmid: VP12 (SpCas9-HF1) | Addgene | 72247 | Dual vector system: The gRNA is expressed from a different plasmid. |
Referências
- Epinat, J. C., et al. A novel engineered meganuclease induces homologous recombination in yeast and mammalian cells. Nucleic Acids Research. 31 (11), 2952-2962 (2003).
- Arnould, S., et al. Engineered I-CreI derivatives cleaving sequences from the human XPC gene can induce highly efficient gene correction in mammalian cells. Journal of Molecular Biology. 371 (1), 49-65 (2007).
- Chapdelaine, P., Pichavant, C., Rousseau, J., Paques, F., Tremblay, J. P. Meganucleases can restore the reading frame of a mutated dystrophin. Gene Therapy. 17 (7), 846-858 (2010).
- Carroll, D. Genome engineering with zinc-finger nucleases. Genética. 188 (4), 773-782 (2011).
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nature Reviews Genetics. 11 (9), 636-646 (2010).
- Miller, J. C., et al. A TALE nuclease architecture for efficient genome editing. Nature Biotechnology. 29 (2), 143-148 (2011).
- Zhang, F., et al. Efficient construction of sequence-specific TAL effectors for modulating mammalian transcription. Nature Biotechnology. 29 (2), 149-153 (2011).
- Boch, J., et al. Breaking the code of DNA binding specificity of TAL-type III effectors. Science. 326 (5959), 1509-1512 (2009).
- Moscou, M. J., Bogdanove, A. J. A simple cipher governs DNA recognition by TAL effectors. Science. 326 (5959), 1501 (2009).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nature Biotechnology. 32 (4), 347-355 (2014).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Nishimasu, H., et al. Crystal structure of Cas9 in complex with guide RNA and target DNA. Cell. 156 (5), 935-949 (2014).
- Yamano, T., et al. Crystal Structure of Cpf1 in Complex with Guide RNA and Target DNA. Cell. 165 (4), 949-962 (2016).
- Swarts, D. C., Mosterd, C., van Passel, M. W., Brouns, S. J. CRISPR interference directs strand specific spacer acquisition. PLoS One. 7 (4), e35888 (2012).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).
- Sternberg, S. H., Redding, S., Jinek, M., Greene, E. C., Doudna, J. A. DNA interrogation by the CRISPR RNA-guided endonuclease Cas9. Nature. 507 (7490), 62-67 (2014).
- Hu, J. H., et al. Evolved Cas9 variants with broad PAM compatibility and high DNA specificity. Nature. 556 (7699), 57-63 (2018).
- Kleinstiver, B. P., et al. Broadening the targeting range of Staphylococcus aureus CRISPR-Cas9 by modifying PAM recognition. Nature Biotechnology. 33 (12), 1293-1298 (2015).
- Kleinstiver, B. P., et al. Engineered CRISPR-Cas9 nucleases with altered PAM specificities. Nature. 523 (7561), 481-485 (2015).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Jinek, M., et al. RNA-programmed genome editing in human cells. Elife. 2, e00471 (2013).
- Cho, S. W., Kim, S., Kim, J. M., Kim, J. S. Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nature Biotechnology. 31 (3), 230-232 (2013).
- Wang, Y., et al. Systematic evaluation of CRISPR-Cas systems reveals design principles for genome editing in human cells. Genome Biology. 19 (1), 62 (2018).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Hou, Z., et al. Efficient genome engineering in human pluripotent stem cells using Cas9 from Neisseria meningitidis. Proceedings of the National Academy of Sciences U S A. 110 (39), 15644-15649 (2013).
- Kim, E., et al. In vivo genome editing with a small Cas9 orthologue derived from Campylobacter jejuni. Nature Communications. 8, 14500 (2017).
- Edraki, A., et al. A Compact, High-Accuracy Cas9 with a Dinucleotide PAM for In Vivo Genome Editing. Molecular Cell. , (2018).
- Chatterjee, P., Jakimo, N., Jacobson, J. M. Minimal PAM specificity of a highly similar SpCas9 ortholog. Science Advances. 4 (10), (2018).
- Muller, M., et al. Streptococcus thermophilus CRISPR-Cas9 Systems Enable Specific Editing of the Human Genome. Mol Therapy. 24 (3), 636-644 (2016).
- Esvelt, K. M., et al. Orthogonal Cas9 proteins for RNA-guided gene regulation and editing. Nature Methods. 10 (11), 1116-1121 (2013).
- Boratyn, G. M., et al. BLAST: a more efficient report with usability improvements. Nucleic Acids Research. 41 (Web Server issue), W29-W33 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnology. 31 (9), 827-832 (2013).
- Montague, T. G., Cruz, J. M., Gagnon, J. A., Church, G. M., Valen, E. CHOPCHOP: a CRISPR/Cas9 and TALEN web tool for genome editing. Nucleic Acids Research. 42 (Web Server issue), W401-W407 (2014).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 122-123 (2014).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biology. 17 (1), 148 (2016).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30 (10), 1473-1475 (2014).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnology. 34 (3), 339-344 (2016).
- Richardson, C. D., Ray, G. J., Bray, N. L., Corn, J. E. Non-homologous DNA increases gene disruption efficiency by altering DNA repair outcomes. Nature Communications. 7, 12463 (2016).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Zhang, J. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biology. 18 (1), 35 (2017).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Shmakov, S., et al. Diversity and evolution of class 2 CRISPR-Cas systems. Nature Reviews Microbiology. 15 (3), 169-182 (2017).
- Moreno-Mateos, M. A., et al. CRISPR-Cpf1 mediates efficient homology-directed repair and temperature-controlled genome editing. Nature Communications. 8 (1), 2024 (2017).
- Lin, S., Staahl, B. T., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. Elife. 3, e04766 (2014).
- Yang, L., et al. Optimization of scarless human stem cell genome editing. Nucleic Acids Research. 41 (19), 9049-9061 (2013).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).

