Beweeglijkheid van enkele moleculen en clusters van bidirectionele kinesine-5 Cin8 gezuiverd uit S. cerevisiae-cellen
Summary
De bidirectionele mitotische kinesine-5 Cin8 hoopt zich op in clusters die splitsen en samensmelten tijdens hun beweeglijkheid. Accumulatie in clusters verandert ook de snelheid en directionaliteit van Cin8. Hier wordt een protocol voor motiliteitstests met gezuiverde Cin8-GFP en analyse van beweeglijke eigenschappen van afzonderlijke moleculen en clusters van Cin8 beschreven.
Abstract
De mitotische bipolaire kinesine-5 motoren vervullen essentiële functies in de spindeldynamica. Deze motoren vertonen een homo-tetramere structuur met twee paar katalytische motordomeinen, gelegen aan tegenovergestelde uiteinden van het actieve complex. Deze unieke architectuur stelt kinesine-5-motoren in staat om antiparallel spindelmicrotubuli (MT’s) te kruisen en uit elkaar te schuiven, waardoor de naar buiten gerichte kracht wordt geleverd die de spindelpolen uit elkaar scheidt. Voorheen werd aangenomen dat kinesine-5-motoren uitsluitend plus-end gericht waren. Recente studies toonden echter aan dat verschillende schimmelkinesisine-5-motoren minus-end gericht zijn op het niveau van één molecuul en onder verschillende experimentele omstandigheden van directionaliteit kunnen veranderen. De Saccharomyces cerevisiae kinesine-5 Cin8 is een voorbeeld van een dergelijk bidirectioneel motoreiwit: in omstandigheden met hoge ionische sterkte bewegen enkele moleculen van Cin8 in de minus-eindrichting van de MT’s. Er werd ook aangetoond dat Cin8 beweeglijke clusters vormt, voornamelijk aan het min-einde van de MT’s, en een dergelijke clustering stelt Cin8 in staat om van directionaliteit te veranderen en langzame, plus-end gerichte motiliteit te ondergaan. Dit artikel biedt een gedetailleerd protocol voor alle stappen van het werken met GFP-gelabelde kinesine-5 Cin8, van eiwitoverexpressie in S. cerevisiae-cellen en de zuivering ervan tot in vitro motiliteitstest met één molecuul. Een nieuw ontwikkelde methode die hier wordt beschreven, helpt onderscheid te maken tussen afzonderlijke moleculen en clusters van Cin8, op basis van hun fluorescentie-intensiteit. Deze methode maakt een afzonderlijke analyse van de beweeglijkheid van afzonderlijke moleculen en clusters van Cin8 mogelijk, waardoor de afhankelijkheid van Cin8-motiliteit van de clustergrootte wordt gekarakteriseerd.
Introduction
Een groot aantal motiliteitsgebeurtenissen in eukaryote cellen worden gemedieerd door de functie van moleculaire motoreiwitten. Deze motoren bewegen langs de cytoskeletale filamenten, actinefilamenten en microtubuli (MT’s) en zetten de chemische energie van ATP-hydrolyse om in kinetische en mechanische krachten die nodig zijn om de biologische beweeglijkheid in cellen te stimuleren. De op MT gebaseerde S. cerevisiae Cin8 is een bipolair, homotetrameer kinesine-5 motoreiwit dat spindel-MT’s uit elkaar schuift1. Cin8 vervult essentiële functies tijdens mitose, in spindelassemblage 2,3,4 en spilverlenging tijdens anafase 5,6,7. Eerder was aangetoond dat Cin8 een bidirectionele motor is, die directionaliteit schakelt onder verschillende experimentele omstandigheden. Onder omstandigheden met een hoge ionische sterkte bewegen enkele Cin8-motoren bijvoorbeeld naar het min-uiteinde van de MT’s, terwijl cin8-motoren in clusters, in meermotorige MT-glijtests en tussen antiparallel MT’s voornamelijk naar de plus-uiteinden van de MT’sbewegen 8,9,10,11,12 . Deze bevindingen waren om verschillende redenen zeer onverwacht. Ten eerste draagt Cin8 zijn katalytische motorische domein op het amino-eindpunt en dergelijke motoren werden eerder verondersteld uitsluitend plus-end gericht te zijn, terwijl Cin8 werd aangetoond dat minus-end gericht was op het niveau van één molecuul. Ten tweede werd aangenomen dat kinesinemotoren unidirectioneel waren, hetzij minus-end of plus-end gericht, terwijl Cin8 bidirectioneel bleek te zijn, afhankelijk van de experimentele omstandigheden. Ten slotte kon, vanwege de MT-oriëntatie op de mitotische spil, de klassieke rol van kinesine-5-motoren in de scheiding van spindelpolen tijdens spindelassemblage en anafase B alleen worden verklaard door hun plus-end gerichte motiliteit op de MT’s die ze1,13 crosslinken. Na de eerste rapporten over de bidirectionaliteit van Cin8, werd aangetoond dat een paar andere kinesinemotoren bidirectioneel 14,15,16 zijn, wat aangeeft dat de bidirectionele beweeglijkheid van kinesinemotoren vaker voorkomt dan eerder werd aangenomen.
Eerder is gemeld dat Cin8 in cellen ook op een bidirectionele manier beweegt8, wat het idee ondersteunt dat de bidirectionele beweeglijkheid van sommige kinesine-5-motoren belangrijk is voor hun intracellulaire functies. Bovendien, aangezien de drie kinesine-5-motoren waarvan werd gemeld dat ze bidirectioneel waren, afkomstig zijn van schimmelcellen, is onlangs een mogelijke rol voor de bidirectionaliteit van kinesine-5-motoren voorgesteld in dergelijke cellen10. Volgens dit model, bij gesloten mitose van schimmelcellen, waarbij de nucleaire enveloppe niet afbreekt tijdens mitose, leveren kinesine-5-motoren de initiële kracht die de spindelpolen uit elkaar scheidt voorafgaand aan de spindelassemblage. Om deze taak uit te voeren, voorafgaand aan de scheiding van de spindelpool, lokaliseren kinesine-5-motoren zich in de buurt van de spilpolen, door hun minus-end gerichte motiliteit op enkele nucleaire MT’s. Eenmaal op deze positie clusteren kinesine-5-motoren, schakelen ze van directionaliteit, vangen en cross-link MT’s van naburige spindelpolen. Vervolgens zorgen kinesine-5-motoren voor de initiële scheiding van de polen door plus-end gerichte motiliteit op de MT’s die ze crosslinken. Volgens dit model zijn zowel minus-end gerichte motiliteit op enkele MT’s als plus-end gerichte motiliteit op cross-linked MT’s tijdens antiparallel glijden vereist voor schimmel kinesine-5 motoren om hun rol te vervullen in spindelassemblage 1,13.
Het algemene doel van de beschreven methode is het verkrijgen van zeer zuivere schimmel GFP-gelabelde kinesine-5 Cin8 en het uitvoeren van motiliteitstests met één molecuul (figuur 1) terwijl de beweeglijkheid van afzonderlijke moleculen en clusters van Cin8 afzonderlijk wordt geanalyseerd. De scheiding tussen afzonderlijke moleculen en clusters is belangrijk omdat een van de factoren waarvan is aangetoond dat ze de directionaliteit van Cin8 beïnvloeden, de accumulatie in clusters op de MT’s 10,12 is. Alternatieve beweeglijkheidstests, zoals de MT-oppervlakteglijdende en MT-glijdende assays, geven geen informatie over de activiteit van enkelvoudige motoreiwitten17,18. De robuuste motiliteits- en analysemethoden met één molecuul die hier worden beschreven, zijn met succes toegepast om verschillende aspecten van kinesine-5-motoren, Cin8 en Kip1 10,11,12,14,19,20 te karakteriseren.
Hier wordt een gedetailleerd protocol gepresenteerd voor Cin8-overexpressie en -zuivering, polymerisatie van MT’s en de motiliteitstest met één molecuul. Verder worden ook de analyses beschreven om onderscheid te maken tussen afzonderlijke moleculen en clusters van Cin8, en om enkelvoudige motor- en clustersnelheden te bepalen door middel van gemiddelde verplaatsing (MD) en gemiddelde kwadratische verplaatsing (MSD). Dit protocol is bedoeld om onderzoekers te helpen alle stappen van de procedures te visualiseren en te helpen bij het oplossen van problemen met dit soort testen.
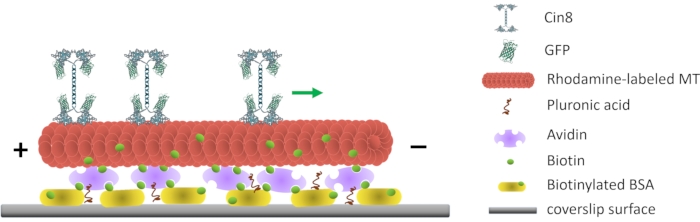
Figuur 1: Schematische weergave van de motiliteitstest met één molecuul. Gebiotinyleerde fluorescerende MT’s zijn bevestigd aan het glazen oppervlak, gecoat met Avidin dat interageert met het aan het oppervlak gehechte biotinylated-BSA. De groene pijl vertegenwoordigt de bewegingsrichting van enkele Cin8-moleculen onder omstandigheden met een hoge ionische sterkte. +/- de polariteit van het MT vertegenwoordigen. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
In dit werk wordt een protocol voor single-molecule motiliteitstest met de bidirectionele kinesine-5 Cin8 en de motiliteitsanalyse gepresenteerd. De full-length Cin818 inclusief het native nuclear localization signal (NLS) op de C-terminal is gezuiverd van de native host S. cerevisiae. Omdat de Cin8 een nucleair motoreiwit is, blijkt het malen van de S. cerevisiae-cellen onder vloeibare stikstof de meest efficiënte methode voor cellysis te zijn. Na lysis, door metaalaffiniteit e…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek werd gedeeltelijk ondersteund door de Israel Science Foundation-beurs (ISF-386/18) en de Israel Binational Science Foundation-beurs (BSF-2019008), toegekend aan L.G.
Materials
| Adenine | FORMEDIUM | DOC0230 | |
| ATP | Sigma | A7699 | |
| Biotinylated-BSA | Sigma | A8549 | |
| Casein | Sigma | C7078 | |
| Catalase (C40) | Sigma | C40 | |
| Creatine-Kinase | Sigma | C3755 | |
| Dithiothreitol (DTT) | Sigma | D0632 | |
| EDTA | Sigma | E5134 | |
| EGTA | Sigma | E4378 | |
| Fluorescence filter set for GFP | Chroma | 49002: ET-EGFP (FITC/Cy2) | |
| Fluorescence filter set for Rhodamine | Chroma | 49004: ET-CY3/TRITC | |
| Fluorescence inverted microscope | Zeiss | Axiovert 200M | |
| Galactose | Tivan Biotech | GAL02 | |
| Glucose | Sigma | G8270 | |
| Glucose Oxidase | Sigma | G7141 | |
| Glycerol | Sigma | G5516 | |
| GlycylGlycine | Merck | G0674 | |
| GMPCPP | Jana Bioscience | Nu-405L | |
| GTB | Cytoskeleton | BST01-010 | |
| GTP | Sigma | G8877 | |
| Histidine | Duchefa Biochemie | H0710.0100 | |
| ImageJ-FIJI software | https://imagej.net/plugins/trackmate/ | version 2.1.0/1.53c; Java 1.8.0_172 [64-bit] for Windows 10 | |
| Imidazole | Sigma | I0125 | |
| InstantBlue Coomassie Protein Stain | Abcam | ab119211 | |
| Lens | Zeiss | 100x/1.4 oil DIC objective | |
| Lysine | FORMEDIUM | DOC0161 | |
| Magnesium Chloride | Sigma | M8266 | |
| Methionine | Duchefa Biochemie | M0715.0100 | |
| Neo | Andor Technologies | sCMOS camera | |
| NeutraAvidin | Life | A2666 | |
| Ni-NTA Agarose | Invitrogen | R901-15 | |
| Phospho-Creatine | Sigma | P1937 | |
| Pipes | Sigma | P1851 | |
| Pluronic acid F-127 (poloxamer) | Sigma | P2443 | |
| Potassium Chloride | Sigma | P9541 | |
| Raffinose | Tivan Biotech | RAF01 | |
| Size Exclusion chromatography instument | GE Healthcare | AKTA Pure | |
| Spectrophotometer | ThermoFisher Scientific | NanoDrop | |
| Superose-6 10/300 GL | GE Healthcare | 17-5172-01 | |
| Tris | Roshe | 10708976001 | |
| Triton X-100 | Sigma | T8787 | |
| Tryptophan | Duchefa Biochemie | T0720.0100 | |
| Tubulin protein | Cytoskeleton | T240 | |
| Tubulin, biotinylated | Cytoskeleton | T333P | |
| Tubulin, TRITC Rhodamine | Cytoskeleton | TL530M | |
| Uracil | Sigma | U0750-100G | |
| Yeast nitrogen base | FORMEDIUM | CYN0401S | |
| α-GFP antibody | Santa Cruz Biotechnology | SC8036 | |
| β-mercaptoethanol | Sigma | M3148 |
Referências
- Singh, S. K., Pandey, H., Al-Bassam, J., Gheber, L. Bidirectional motility of kinesin-5 motor proteins: structural determinants, cumulative functions and physiological roles. Cellular and Molecular Life Sciences. 75 (10), 1757-1771 (2018).
- Hoyt, M. A., He, L., Totis, L., Saunders, W. S. Loss of function of Saccharomyces cerevisiae kinesin-related CIN8 and KIP1 is suppressed by KAR3 motor domain mutations. Genética. 135 (1), 35-44 (1993).
- Saunders, W. S., Hoyt, M. A. Kinesin-related proteins required for structural integrity of the mitotic spindle. Cell. 70 (3), 451-458 (1992).
- Hoyt, M. A., He, L., Loo, K. K., Saunders, W. S. Two Saccharomyces cerevisiae kinesin-related gene products required for mitotic spindle assembly. Journal of Cell Biology. 118 (1), 109-120 (1992).
- Gerson-Gurwitz, A., et al. Mid-anaphase arrest in S. cerevisiae cells eliminated for the function of Cin8 and dynein. Cellular and Molecular Life Sciences. 66 (2), 301-313 (2009).
- Fridman, V., Gerson-Gurwitz, A., Movshovich, N., Kupiec, M., Gheber, L. Midzone organization restricts interpolar microtubule plus-end dynamics during spindle elongation. EMBO Reports. 10 (4), 387-393 (2009).
- Movshovich, N., et al. Slk19-dependent mid-anaphase pause in kinesin-5-mutated cells. Journal of Cell Science. 121 (15), 2529-2539 (2008).
- Gerson-Gurwitz, A., et al. Directionality of individual kinesin-5 Cin8 motors is modulated by loop 8, ionic strength and microtubule geometry. Embo Journal. 30 (24), 4942-4954 (2011).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Shapira, O., Goldstein, A., Al-Bassam, J., Gheber, L. A potential physiological role for bi-directional motility and motor clustering of mitotic kinesin-5 Cin8 in yeast mitosis. Journal of Cell Science. 130 (4), 725-734 (2017).
- Goldstein-Levitin, A., Pandey, H., Allhuzaeel, K., Kass, I., Gheber, L. Intracellular functions and motile properties of bi-directional kinesin-5 Cin8 are regulated by neck linker docking. eLife. 10, 71036 (2021).
- Pandey, H., et al. Drag-induced directionality switching of kinesin-5 Cin8 revealed by cluster-motility analysis. Science Advances. 7 (6), 1687 (2021).
- Pandey, H., Popov, M., Goldstein-Levitin, A., Gheber, L. Mechanisms by which kinesin-5 motors perform their multiple intracellular functions. International Journal of Molecular Sciences. 22 (12), 6420 (2021).
- Fridman, V., et al. Kinesin-5 Kip1 is a bi-directional motor that stabilizes microtubules and tracks their plus-ends in vivo. Journal of Cell Science. 126, 4147-4159 (2013).
- Edamatsu, M. Bidirectional motility of the fission yeast kinesin-5, Cut7. Biochemical and Biophysical Research Communications. 446 (1), 231-234 (2014).
- Popchock, A. R., et al. The mitotic kinesin-14 KlpA contains a context-dependent directionality switch. Nature Communications. 8, 13999 (2017).
- Bodrug, T., et al. The kinesin-5 tail domain directly modulates the mechanochemical cycle of the motor domain for anti-parallel microtubule sliding. eLife. 9 (9), 51131 (2020).
- Gheber, L., Kuo, S. C., Hoyt, M. A. Motile properties of the kinesin-related Cin8p spindle motor extracted from Saccharomyces cerevisiae cells. Journal of Biological Chemistry. 274 (14), 9564-9572 (1999).
- Pandey, H., et al. Flexible microtubule anchoring modulates the bi-directional motility of the kinesin-5 Cin8. Cellular and Molecular Life Sciences. 78 (16), 6051-6068 (2021).
- Shapira, O., Gheber, L. Motile properties of the bi-directional kinesin-5 Cin8 are affected by phosphorylation in its motor domain. Scientific Reports. 6, 25597 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Britto, M., et al. Schizosaccharomyces pombe kinesin-5 switches direction using a steric blocking mechanism. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), 7483-7489 (2016).
- Kapitein, L. C., et al. Microtubule cross-linking triggers the directional motility of kinesin-5. Journal of Cell Biology. 182 (3), 421-428 (2008).
- Furuta, K., Edamatsu, M., Maeda, Y., Toyoshima, Y. Y. Diffusion and directed movement in vitro motile properties of fission yeast kinesin-14 Pkl1. Journal of Biological Chemistry. 283 (52), 36465-36473 (2008).
- Katrukha, E. A., et al. Probing cytoskeletal modulation of passive and active intracellular dynamics using nanobody-functionalized quantum dots. Nature Communications. 8, 14772 (2017).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Jakobs, M. A. H., Dimitracopoulos, A., Franze, K. KymoBulter, a deep learning software for automated kymograph analysis. eLife. 8, 42288 (2019).

