S. cerevisiae細胞から精製された双方向キネシン-5 Cin8の一分子およびクラスターの運動性
Summary
双方向有糸分裂キネシン-5 Cin8は、運動性の間に分裂して融合するクラスターに蓄積する。クラスターへの蓄積は、Cin8の速度と方向性も変化させます。ここでは、精製Cin8−GFPを用いた運動性アッセイおよびCin8の単一分子およびクラスターの運動性特性の分析のためのプロトコルが記載されている。
Abstract
有糸分裂バイポーラキネシン-5モーターは、スピンドルダイナミクスにおいて重要な機能を果たします。これらのモーターは、活性複合体の両端に位置する2対の触媒モータードメインを有するホモ四量体構造を示す。このユニークなアーキテクチャにより、キネシン-5モータは、逆平行スピンドル微小管(MT)を架橋してスライドさせることができ、スピンドルポールを分離する外向きの力を提供します。以前は、キネシン-5モーターはもっぱらプラスエンド指向であると考えられていました。しかし、最近の研究では、いくつかの真菌キネシン-5モーターがマイナス末端が単一分子レベルに向けられており、さまざまな実験条件下で方向性を切り替えることができることが明らかになりました。 サッカロミセス・セレビシエ・ キネシン−5 Cin8は、そのような双方向モータータンパク質の一例である:高イオン強度条件下では、Cin8の単一分子はMTのマイナス末端方向に移動する。また、Cin8は主にMTのマイナス端で運動性クラスターを形成し、そのようなクラスタリングはCin8が方向性を切り替え、ゆっくりとしたプラスエンド指向性を経験することを可能にすることも示された。この記事では、 S. cerevisiae 細胞におけるタンパク質過剰発現およびその精製から in vitro 単一分子運動性アッセイまで、GFPタグ付きキネシン-5 Cin8を使用するすべてのステップについて詳細なプロトコルを提供します。ここで説明する新しく開発された方法は、蛍光強度に基づいてCin8の単一分子とクラスターを区別するのに役立ちます。この方法は、Cin8の単一分子およびクラスターの運動性の別々の分析を可能にし、したがって、Cin8の運動性のクラスターサイズに対する依存性の特性評価を提供する。
Introduction
真核細胞内の多数の運動性事象は、分子運動タンパク質の機能によって媒介される。これらのモーターは、細胞骨格フィラメント、アクチンフィラメント、および微小管(MT)に沿って移動し、ATP加水分解の化学エネルギーを細胞内の生物学的運動性を駆動するために必要な運動学的および機械的力に変換する。MTベースのS. cerevisiae Cin8は、双極性のホモ四量体キネシン-5モータータンパク質であり、スピンドルMTを架橋してスライドさせる1。Cin8は、有糸分裂中、紡錘体アセンブリ2,3,4および分裂後期5,6,7中の紡錘体伸長において、本質的な機能を果たす。これまで、Cin8は双方向モータであり、異なる実験条件下で方向性を切り替えることが実証されていました。例えば、高いイオン強度条件下では、単一のCin8モータはMTのマイナス端に向かって移動するが、クラスタでは、マルチモータMTグライダーアッセイでは、および反並列MT間では、Cin8モータは主にMTのプラス端に向かって移動する8,9,10,11,12 .これらの発見は、いくつかの理由により非常に予想外であった。第一に、Cin8はアミノ末端に触媒モータードメインを持ち、そのようなモーターは以前はもっぱらプラスエンド指向性であると考えられていたが、Cin8は単一分子レベルでのマイナス末端指向性であることが示された。第二に、キネシンモーターはマイナス端またはプラス端のいずれかの単方向であると考えられていたが、Cin8は実験条件に応じて双方向であることが示された。最後に、有糸分裂スピンドルにおけるMT配向のために、スピンドルアセンブリ中のスピンドル極と分裂後期Bの分離におけるキネシン-5モータの古典的な役割は、それらが架橋するMT上のプラスエンド指向性によってのみ説明できた1,13。Cin8の双方向性に関する最初の報告に続いて、他のいくつかのキネシンモーターが双方向であることが実証された14,15,16、キネシンモーターの双方向運動性は、以前に信じられていたよりも一般的である可能性があることを示している。
細胞内では、Cin8も双方向で移動することが以前に報告されており8、いくつかのキネシン5モーターの双方向運動性が細胞内機能にとって重要であるという考えを支持している。また、双方向であることが報告された3つのキネシン-5モーターは真菌細胞由来であることから、このような細胞10においてキネシン-5モーターの双方向性に対する役割の可能性が最近提案されている。このモデルによると、有糸分裂中に核エンベロープが破壊されない真菌細胞の閉鎖有糸分裂では、キネシン-5モーターは、紡錘体組み立ての前に紡錘極を分離する初期力を提供する。このタスクを実行するために、主軸極分離の前に、キネシン-5モータは、単一の核MT上のマイナス端指向運動性によって、主軸極の近くに局在する。この位置に着くと、キネシン-5モーターはクラスタリングし、方向を切り替え、キャプチャし、隣接するスピンドルポールからMTをクロスリンクします。続いて、キネシン-5モータは、それらが架橋するMT上のプラスエンド指向性運動性によって極の初期分離を提供する。このモデルでは、真菌キネシン-5モータがスピンドルアセンブリでその役割を果たすために、単一MT上のマイナス端指向性運動性と、逆平行摺動中の架橋MT上のプラスエンド指向性運動性の両方が必要である1,13。
記載された方法の全体的な目標は、高純度の真菌GFPタグ付きキネシン-5 Cin8を取得し、単一分子およびCin8のクラスターの運動性を別々に分析しながら、単一分子運動性アッセイ(図1)を行うことである。単一分子とクラスターの間の分離は、Cin8の方向性に影響を与えることが実証された要因の1つがMTs10,12上のクラスターへの蓄積であるため、重要である。MT表面滑空およびMT摺動アッセイなどの代替運動性アッセイは、単一モータータンパク質の活性に関する情報を提供しない17、18。ここで説明する堅牢な単一分子運動性アッセイおよび分析方法は、キネシン-5モーター、Cin8およびKip1 10、11、12、14、19、20のさまざまな側面を特徴付けるために首尾よく適用されています。
ここでは、Cin8の過剰発現および精製、MTの重合、および単一分子運動性アッセイについて、詳細なプロトコールを提示する。さらに、Cin8の単一分子とクラスターを区別し、平均変位(MD)および平均二乗変位(MSD)分析によって単一モーター速度およびクラスター速度を決定するための分析も記載されている。このプロトコルは、研究者が手順のすべてのステップを視覚化し、このタイプのアッセイのトラブルシューティングを支援することを目的としています。
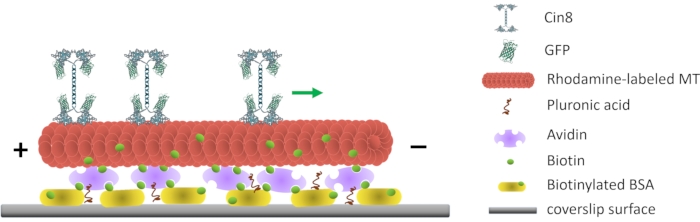
図1:一分子運動性アッセイの概略図。 ビオチン化蛍光MTはガラス表面に付着し、表面結合ビオチン化BSAと相互作用するアビジンでコーティングされている。緑色の矢印は、高イオン強度条件下での単一のCin8分子の移動方向を表す。+/- MTの極性を表します 。この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
この研究では、双方向キネシン-5 Cin8を用いた単一分子運動性アッセイおよび運動性分析のためのプロトコルが提示される。C末端における天然核局在化シグナル(NLS)を含む全長Cin8 18 は、天然宿主 S. cerevisiaeから精製されている。Cin8は核モータータンパク質であるため、液体窒素下で セレビシエ 菌細胞を粉砕することが、細胞溶解のための最も効率的な方法で?…
Declarações
The authors have nothing to disclose.
Acknowledgements
この研究は、L.G.に授与されたイスラエル科学財団助成金(ISF-386/18)とイスラエル二国間科学財団助成金(BSF-2019008)によって部分的に支援されました。
Materials
| Adenine | FORMEDIUM | DOC0230 | |
| ATP | Sigma | A7699 | |
| Biotinylated-BSA | Sigma | A8549 | |
| Casein | Sigma | C7078 | |
| Catalase (C40) | Sigma | C40 | |
| Creatine-Kinase | Sigma | C3755 | |
| Dithiothreitol (DTT) | Sigma | D0632 | |
| EDTA | Sigma | E5134 | |
| EGTA | Sigma | E4378 | |
| Fluorescence filter set for GFP | Chroma | 49002: ET-EGFP (FITC/Cy2) | |
| Fluorescence filter set for Rhodamine | Chroma | 49004: ET-CY3/TRITC | |
| Fluorescence inverted microscope | Zeiss | Axiovert 200M | |
| Galactose | Tivan Biotech | GAL02 | |
| Glucose | Sigma | G8270 | |
| Glucose Oxidase | Sigma | G7141 | |
| Glycerol | Sigma | G5516 | |
| GlycylGlycine | Merck | G0674 | |
| GMPCPP | Jana Bioscience | Nu-405L | |
| GTB | Cytoskeleton | BST01-010 | |
| GTP | Sigma | G8877 | |
| Histidine | Duchefa Biochemie | H0710.0100 | |
| ImageJ-FIJI software | https://imagej.net/plugins/trackmate/ | version 2.1.0/1.53c; Java 1.8.0_172 [64-bit] for Windows 10 | |
| Imidazole | Sigma | I0125 | |
| InstantBlue Coomassie Protein Stain | Abcam | ab119211 | |
| Lens | Zeiss | 100x/1.4 oil DIC objective | |
| Lysine | FORMEDIUM | DOC0161 | |
| Magnesium Chloride | Sigma | M8266 | |
| Methionine | Duchefa Biochemie | M0715.0100 | |
| Neo | Andor Technologies | sCMOS camera | |
| NeutraAvidin | Life | A2666 | |
| Ni-NTA Agarose | Invitrogen | R901-15 | |
| Phospho-Creatine | Sigma | P1937 | |
| Pipes | Sigma | P1851 | |
| Pluronic acid F-127 (poloxamer) | Sigma | P2443 | |
| Potassium Chloride | Sigma | P9541 | |
| Raffinose | Tivan Biotech | RAF01 | |
| Size Exclusion chromatography instument | GE Healthcare | AKTA Pure | |
| Spectrophotometer | ThermoFisher Scientific | NanoDrop | |
| Superose-6 10/300 GL | GE Healthcare | 17-5172-01 | |
| Tris | Roshe | 10708976001 | |
| Triton X-100 | Sigma | T8787 | |
| Tryptophan | Duchefa Biochemie | T0720.0100 | |
| Tubulin protein | Cytoskeleton | T240 | |
| Tubulin, biotinylated | Cytoskeleton | T333P | |
| Tubulin, TRITC Rhodamine | Cytoskeleton | TL530M | |
| Uracil | Sigma | U0750-100G | |
| Yeast nitrogen base | FORMEDIUM | CYN0401S | |
| α-GFP antibody | Santa Cruz Biotechnology | SC8036 | |
| β-mercaptoethanol | Sigma | M3148 |
Referências
- Singh, S. K., Pandey, H., Al-Bassam, J., Gheber, L. Bidirectional motility of kinesin-5 motor proteins: structural determinants, cumulative functions and physiological roles. Cellular and Molecular Life Sciences. 75 (10), 1757-1771 (2018).
- Hoyt, M. A., He, L., Totis, L., Saunders, W. S. Loss of function of Saccharomyces cerevisiae kinesin-related CIN8 and KIP1 is suppressed by KAR3 motor domain mutations. Genética. 135 (1), 35-44 (1993).
- Saunders, W. S., Hoyt, M. A. Kinesin-related proteins required for structural integrity of the mitotic spindle. Cell. 70 (3), 451-458 (1992).
- Hoyt, M. A., He, L., Loo, K. K., Saunders, W. S. Two Saccharomyces cerevisiae kinesin-related gene products required for mitotic spindle assembly. Journal of Cell Biology. 118 (1), 109-120 (1992).
- Gerson-Gurwitz, A., et al. Mid-anaphase arrest in S. cerevisiae cells eliminated for the function of Cin8 and dynein. Cellular and Molecular Life Sciences. 66 (2), 301-313 (2009).
- Fridman, V., Gerson-Gurwitz, A., Movshovich, N., Kupiec, M., Gheber, L. Midzone organization restricts interpolar microtubule plus-end dynamics during spindle elongation. EMBO Reports. 10 (4), 387-393 (2009).
- Movshovich, N., et al. Slk19-dependent mid-anaphase pause in kinesin-5-mutated cells. Journal of Cell Science. 121 (15), 2529-2539 (2008).
- Gerson-Gurwitz, A., et al. Directionality of individual kinesin-5 Cin8 motors is modulated by loop 8, ionic strength and microtubule geometry. Embo Journal. 30 (24), 4942-4954 (2011).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Shapira, O., Goldstein, A., Al-Bassam, J., Gheber, L. A potential physiological role for bi-directional motility and motor clustering of mitotic kinesin-5 Cin8 in yeast mitosis. Journal of Cell Science. 130 (4), 725-734 (2017).
- Goldstein-Levitin, A., Pandey, H., Allhuzaeel, K., Kass, I., Gheber, L. Intracellular functions and motile properties of bi-directional kinesin-5 Cin8 are regulated by neck linker docking. eLife. 10, 71036 (2021).
- Pandey, H., et al. Drag-induced directionality switching of kinesin-5 Cin8 revealed by cluster-motility analysis. Science Advances. 7 (6), 1687 (2021).
- Pandey, H., Popov, M., Goldstein-Levitin, A., Gheber, L. Mechanisms by which kinesin-5 motors perform their multiple intracellular functions. International Journal of Molecular Sciences. 22 (12), 6420 (2021).
- Fridman, V., et al. Kinesin-5 Kip1 is a bi-directional motor that stabilizes microtubules and tracks their plus-ends in vivo. Journal of Cell Science. 126, 4147-4159 (2013).
- Edamatsu, M. Bidirectional motility of the fission yeast kinesin-5, Cut7. Biochemical and Biophysical Research Communications. 446 (1), 231-234 (2014).
- Popchock, A. R., et al. The mitotic kinesin-14 KlpA contains a context-dependent directionality switch. Nature Communications. 8, 13999 (2017).
- Bodrug, T., et al. The kinesin-5 tail domain directly modulates the mechanochemical cycle of the motor domain for anti-parallel microtubule sliding. eLife. 9 (9), 51131 (2020).
- Gheber, L., Kuo, S. C., Hoyt, M. A. Motile properties of the kinesin-related Cin8p spindle motor extracted from Saccharomyces cerevisiae cells. Journal of Biological Chemistry. 274 (14), 9564-9572 (1999).
- Pandey, H., et al. Flexible microtubule anchoring modulates the bi-directional motility of the kinesin-5 Cin8. Cellular and Molecular Life Sciences. 78 (16), 6051-6068 (2021).
- Shapira, O., Gheber, L. Motile properties of the bi-directional kinesin-5 Cin8 are affected by phosphorylation in its motor domain. Scientific Reports. 6, 25597 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Britto, M., et al. Schizosaccharomyces pombe kinesin-5 switches direction using a steric blocking mechanism. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), 7483-7489 (2016).
- Kapitein, L. C., et al. Microtubule cross-linking triggers the directional motility of kinesin-5. Journal of Cell Biology. 182 (3), 421-428 (2008).
- Furuta, K., Edamatsu, M., Maeda, Y., Toyoshima, Y. Y. Diffusion and directed movement in vitro motile properties of fission yeast kinesin-14 Pkl1. Journal of Biological Chemistry. 283 (52), 36465-36473 (2008).
- Katrukha, E. A., et al. Probing cytoskeletal modulation of passive and active intracellular dynamics using nanobody-functionalized quantum dots. Nature Communications. 8, 14772 (2017).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Jakobs, M. A. H., Dimitracopoulos, A., Franze, K. KymoBulter, a deep learning software for automated kymograph analysis. eLife. 8, 42288 (2019).

