Tek Moleküllerin Motilitesi ve S. cerevisiae Hücrelerinden Saflaştırılmış Çift Yönlü Kinesin-5 Cin8 Kümeleri
Summary
Çift yönlü mitotik kinesin-5 Cin8, hareketlilikleri sırasında bölünen ve birleşen kümelerde birikir. Kümelerdeki birikim ayrıca Cin8’in hızını ve yönlülüğünü de değiştirir. Burada, saflaştırılmış Cin8-GFP ile motilitesi tahlilleri ve tek moleküllerin ve Cin8 kümelerinin hareketli özelliklerinin analizi için bir protokol açıklanmaktadır.
Abstract
Mitotik bipolar kinezin-5 motorlar, iş mili dinamiklerinde temel işlevleri yerine getirir. Bu motorlar, aktif kompleksin zıt uçlarında bulunan iki çift katalitik motor alanına sahip homo-tetramerik bir yapı sergiler. Bu benzersiz mimari, kinesin-5 motorlarının antiparalel mil mikrotübüllerini (MTs) çapraz bağlamasını ve kaydırmasını sağlar, böylece iş mili kutuplarını birbirinden ayıran dışa doğru yönlendirilmiş kuvveti sağlar. Daha önce, kinesin-5 motorlarının yalnızca artı uçlu yönlendirildiğine inanılıyordu. Bununla birlikte, son zamanlarda yapılan çalışmalar, birkaç mantar kinezin-5 motorunun eksi uçlu tek molekül seviyesine yönlendirildiğini ve çeşitli deneysel koşullar altında yönselliği değiştirebileceğini ortaya koymuştur. Saccharomyces cerevisiae kinesin-5 Cin8, bu tür çift yönlü motor proteinin bir örneğidir: yüksek iyonik mukavemet koşullarında, Cin8’in tek molekülleri, MT’lerin eksi uç yönünde hareket eder. Ayrıca, Cin8’in ağırlıklı olarak MT’lerin eksi ucunda hareketli kümeler oluşturduğu ve bu kümelenmenin Cin8’in yön değiştirmesine ve yavaş, artı uçlu yönlendirilmiş hareketliliğe maruz kalmasına izin verdiği gösterilmiştir. Bu makale, GFP etiketli kinesin-5 Cin8 ile çalışmanın tüm adımları için, S. cerevisiae hücrelerinde protein aşırı ekspresyonundan ve saflaştırılmasından in vitro tek moleküllü motilitesi testine kadar ayrıntılı bir protokol sunmaktadır. Burada açıklanan yeni geliştirilen bir yöntem, floresan yoğunluklarına bağlı olarak tek moleküller ve Cin8 kümeleri arasında ayrım yapmaya yardımcı olur. Bu yöntem, tek moleküllerin ve Cin8 kümelerinin hareketliliğinin ayrı ayrı analizini sağlar, böylece Cin8 hareketliliğinin küme boyutuna bağımlılığının karakterizasyonunu sağlar.
Introduction
Ökaryotik hücrelerdeki çok sayıda hareketlilik olayı, moleküler motor proteinlerin işlevi tarafından aracılık edilir. Bu motorlar sitoiskelet filamentleri, aktin filamentleri ve mikrotübüller (MTs) boyunca hareket eder ve ATP hidrolizinin kimyasal enerjisini, hücreler içindeki biyolojik hareketliliği yönlendirmek için gereken kinetik ve mekanik kuvvetlere dönüştürür. MT bazlı S. cerevisiae Cin8, iş mili MT’lerini çapraz bağlayan ve kaydıran bipolar, homotetramerik kinesin-5 motor proteinidir1. Cin8, mitoz sırasında, iş mili montajı 2,3,4’te ve anafaz 5,6,7 sırasında iş mili uzamasında temel işlevleri yerine getirir. Daha önce, Cin8’in farklı deneysel koşullar altında yönselliği değiştiren çift yönlü bir motor olduğu gösterilmişti. Örneğin, yüksek iyonik mukavemet koşulları altında, tek Cin8 motorları MT’lerin eksi ucuna doğru hareket ederken, kümelerde, çok motorlu MT kayma testlerinde ve antiparalel MT’ler arasında, Cin8 motorları esas olarak MTs 8,9,10,11,12’nin artı uçlarına doğru hareket eder. . Bu bulgular birkaç nedenden dolayı oldukça beklenmedikti. İlk olarak, Cin8 katalitik motor alanını amino terminusta taşır ve bu tür motorların daha önce sadece artı uçlu yönlendirildiğine inanılıyordu, oysa Cin8’in eksi uçlu tek molekül seviyesinde yönlendirildiği gösterildi. İkincisi, kinesin motorlarının eksi uçlu veya artı uçlu tek yönlü olduğuna inanılıyordu, oysa Cin8’in deneysel koşullara bağlı olarak çift yönlü olduğu gösterildi. Son olarak, mitotik mildeki MT oryantasyonu nedeniyle, kinezin-5 motorlarının iş mili montajı ve anafaz B sırasında iş mili direklerinin ayrılmasındaki klasik rolü, yalnızca 1,13’ü çapraz bağladıkları MT’ler üzerindeki artı uçlu yönlendirilmiş hareketlilikleri ile açıklanabilir. Cin8’in çift yönlülüğü hakkındaki ilk raporları takiben, diğer birkaç kinesin motorunun çift yönlü 14,15,16 olduğu gösterildi, bu da kinesin motorlarının çift yönlü hareketliliğinin daha önce inanıldığından daha yaygın olabileceğini gösteriyor.
Daha önce hücrelerde, Cin8’in çift yönlü bir şekilde hareket ettiğibildirilmiştir 8, bazı kinezin-5 motorlarının çift yönlü hareketliliğinin hücre içi fonksiyonları için önemli olduğu fikrini desteklemektedir. Ek olarak, çift yönlü olduğu bildirilen üç kinesin-5 motoru mantar hücrelerinden olduğundan, bu tür hücrelerde yakın zamanda kinesin-5 motorlarının çift yönlülüğü için olası bir rol önerilmiştir10. Bu modele göre, nükleer zarfın mitoz sırasında parçalanmadığı mantar hücrelerinin kapalı mitozunda, kinesin-5 motorları, iş mili montajından önce iş mili kutuplarını ayıran ilk kuvveti sağlar. Bu görevi yerine getirmek için, iş mili kutup ayrımından önce, kinesin-5 motorları, tek nükleer MT’ler üzerindeki eksi uçlu yönlendirilmiş hareketlilikleriyle iş mili kutuplarının yakınında lokalize olur. Bu konuma geldiğinde, kinesin-5 motorları kümelenir, yönselliği değiştirir, komşu mil direklerinden MT’leri yakalar ve çapraz bağlar. Daha sonra, kinesin-5 motorları, kutupların çapraz bağladıkları MT’lerde artı uçlu yönlendirilmiş hareketlilik ile ilk ayrımını sağlar. Bu modele göre, mantar kinezin-5 motorlarının iş mili düzeneği 1,13’teki rollerini yerine getirmesi için hem tek MT’lerde eksi uçlu yönlendirilmiş hareketlilik hem de çapraz bağlı MT’lerde artı uçlu yönlendirilmiş hareketlilik gereklidir.
Tarif edilen yöntemin genel amacı, yüksek saflıkta fungal GFP etiketli kinesin-5 Cin8 elde etmek ve tek moleküllerin ve Cin8 kümelerinin motilitesini ayrı ayrı analiz ederken tek moleküllü motilitesi testleri (Şekil 1) yapmaktır. Tek moleküller ve kümeler arasındaki ayrım önemlidir, çünkü Cin8’in yönlülüğünü etkilediği gösterilen faktörlerden biri, MTs10,12 üzerindeki kümelerde birikmesidir. MT yüzey kayma ve MT kayma testleri gibi alternatif hareketlilik testleri, tek motor proteinlerinin aktivitesi hakkında bilgi sağlamaz17,18. Burada açıklanan sağlam tek moleküllü hareketlilik testi ve analiz yöntemleri, kinezin-5 motorlarının, Cin8 ve Kip1 10,11,12,14,19,20’nin farklı yönlerini karakterize etmek için başarıyla uygulanmıştır.
Burada, Cin8 aşırı ekspresyonu ve saflaştırılması, MTs’lerin polimerizasyonu ve tek moleküllü motilitesi testi için ayrıntılı bir protokol sunulmaktadır. Ayrıca, tek moleküller ve Cin8 kümeleri arasında ayrım yapmak ve ortalama yer değiştirme (MD) ve ortalama kare yer değiştirme (MSD) analizi ile tek motor ve küme hızlarını belirlemek için yapılan analizler de açıklanmaktadır. Bu protokol, araştırmacıların prosedürlerin tüm adımlarını görselleştirmelerine ve bu tür tahlillerde sorun gidermeye yardımcı olmalarına yardımcı olmayı amaçlamaktadır.
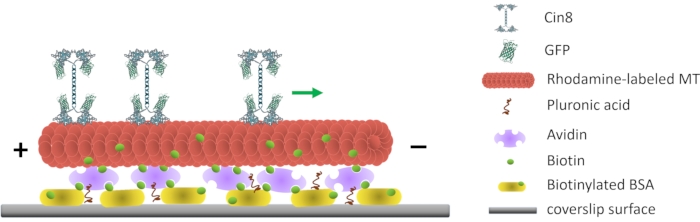
Şekil 1: Tek moleküllü motilitesi testinin şematik gösterimi. Biyotinile floresan MTs, yüzeye bağlı biyotinillenmiş BSA ile etkileşime giren Avidin ile kaplanmış cam yüzeye tutturulur. Yeşil ok, yüksek iyonik mukavemet koşulları altında tek Cin8 moleküllerinin hareket yönünü temsil eder. +/- MT’nin polaritesini temsil eder. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu çalışmada, çift yönlü kinezin-5 Cin8 ile tek moleküllü motilite testi için bir protokol ve motilitenin analizi sunulmuştur. C-terminalindeki doğal nükleer lokalizasyon sinyalini (NLS) içeren tam uzunluktakiCin8 18 , yerli konakçı S. cerevisiae’den arındırılmıştır. Cin8 bir nükleer motor proteini olduğundan, S. cerevisiae hücrelerinin sıvı azot altında öğütülmesi, hücre lizisi için en etkili yöntem olarak bulunmuştur. Lizisten sonra, metal afi…
Declarações
The authors have nothing to disclose.
Acknowledgements
Bu araştırma kısmen İsrail Bilim Vakfı hibesi (ISF-386/18) ve L.G.’ye verilen İsrail İki Uluslu Bilim Vakfı hibesi (BSF-2019008) tarafından desteklenmiştir.
Materials
| Adenine | FORMEDIUM | DOC0230 | |
| ATP | Sigma | A7699 | |
| Biotinylated-BSA | Sigma | A8549 | |
| Casein | Sigma | C7078 | |
| Catalase (C40) | Sigma | C40 | |
| Creatine-Kinase | Sigma | C3755 | |
| Dithiothreitol (DTT) | Sigma | D0632 | |
| EDTA | Sigma | E5134 | |
| EGTA | Sigma | E4378 | |
| Fluorescence filter set for GFP | Chroma | 49002: ET-EGFP (FITC/Cy2) | |
| Fluorescence filter set for Rhodamine | Chroma | 49004: ET-CY3/TRITC | |
| Fluorescence inverted microscope | Zeiss | Axiovert 200M | |
| Galactose | Tivan Biotech | GAL02 | |
| Glucose | Sigma | G8270 | |
| Glucose Oxidase | Sigma | G7141 | |
| Glycerol | Sigma | G5516 | |
| GlycylGlycine | Merck | G0674 | |
| GMPCPP | Jana Bioscience | Nu-405L | |
| GTB | Cytoskeleton | BST01-010 | |
| GTP | Sigma | G8877 | |
| Histidine | Duchefa Biochemie | H0710.0100 | |
| ImageJ-FIJI software | https://imagej.net/plugins/trackmate/ | version 2.1.0/1.53c; Java 1.8.0_172 [64-bit] for Windows 10 | |
| Imidazole | Sigma | I0125 | |
| InstantBlue Coomassie Protein Stain | Abcam | ab119211 | |
| Lens | Zeiss | 100x/1.4 oil DIC objective | |
| Lysine | FORMEDIUM | DOC0161 | |
| Magnesium Chloride | Sigma | M8266 | |
| Methionine | Duchefa Biochemie | M0715.0100 | |
| Neo | Andor Technologies | sCMOS camera | |
| NeutraAvidin | Life | A2666 | |
| Ni-NTA Agarose | Invitrogen | R901-15 | |
| Phospho-Creatine | Sigma | P1937 | |
| Pipes | Sigma | P1851 | |
| Pluronic acid F-127 (poloxamer) | Sigma | P2443 | |
| Potassium Chloride | Sigma | P9541 | |
| Raffinose | Tivan Biotech | RAF01 | |
| Size Exclusion chromatography instument | GE Healthcare | AKTA Pure | |
| Spectrophotometer | ThermoFisher Scientific | NanoDrop | |
| Superose-6 10/300 GL | GE Healthcare | 17-5172-01 | |
| Tris | Roshe | 10708976001 | |
| Triton X-100 | Sigma | T8787 | |
| Tryptophan | Duchefa Biochemie | T0720.0100 | |
| Tubulin protein | Cytoskeleton | T240 | |
| Tubulin, biotinylated | Cytoskeleton | T333P | |
| Tubulin, TRITC Rhodamine | Cytoskeleton | TL530M | |
| Uracil | Sigma | U0750-100G | |
| Yeast nitrogen base | FORMEDIUM | CYN0401S | |
| α-GFP antibody | Santa Cruz Biotechnology | SC8036 | |
| β-mercaptoethanol | Sigma | M3148 |
Referências
- Singh, S. K., Pandey, H., Al-Bassam, J., Gheber, L. Bidirectional motility of kinesin-5 motor proteins: structural determinants, cumulative functions and physiological roles. Cellular and Molecular Life Sciences. 75 (10), 1757-1771 (2018).
- Hoyt, M. A., He, L., Totis, L., Saunders, W. S. Loss of function of Saccharomyces cerevisiae kinesin-related CIN8 and KIP1 is suppressed by KAR3 motor domain mutations. Genética. 135 (1), 35-44 (1993).
- Saunders, W. S., Hoyt, M. A. Kinesin-related proteins required for structural integrity of the mitotic spindle. Cell. 70 (3), 451-458 (1992).
- Hoyt, M. A., He, L., Loo, K. K., Saunders, W. S. Two Saccharomyces cerevisiae kinesin-related gene products required for mitotic spindle assembly. Journal of Cell Biology. 118 (1), 109-120 (1992).
- Gerson-Gurwitz, A., et al. Mid-anaphase arrest in S. cerevisiae cells eliminated for the function of Cin8 and dynein. Cellular and Molecular Life Sciences. 66 (2), 301-313 (2009).
- Fridman, V., Gerson-Gurwitz, A., Movshovich, N., Kupiec, M., Gheber, L. Midzone organization restricts interpolar microtubule plus-end dynamics during spindle elongation. EMBO Reports. 10 (4), 387-393 (2009).
- Movshovich, N., et al. Slk19-dependent mid-anaphase pause in kinesin-5-mutated cells. Journal of Cell Science. 121 (15), 2529-2539 (2008).
- Gerson-Gurwitz, A., et al. Directionality of individual kinesin-5 Cin8 motors is modulated by loop 8, ionic strength and microtubule geometry. Embo Journal. 30 (24), 4942-4954 (2011).
- Roostalu, J., et al. Directional switching of the kinesin Cin8 through motor coupling. Science. 332 (6025), 94-99 (2011).
- Shapira, O., Goldstein, A., Al-Bassam, J., Gheber, L. A potential physiological role for bi-directional motility and motor clustering of mitotic kinesin-5 Cin8 in yeast mitosis. Journal of Cell Science. 130 (4), 725-734 (2017).
- Goldstein-Levitin, A., Pandey, H., Allhuzaeel, K., Kass, I., Gheber, L. Intracellular functions and motile properties of bi-directional kinesin-5 Cin8 are regulated by neck linker docking. eLife. 10, 71036 (2021).
- Pandey, H., et al. Drag-induced directionality switching of kinesin-5 Cin8 revealed by cluster-motility analysis. Science Advances. 7 (6), 1687 (2021).
- Pandey, H., Popov, M., Goldstein-Levitin, A., Gheber, L. Mechanisms by which kinesin-5 motors perform their multiple intracellular functions. International Journal of Molecular Sciences. 22 (12), 6420 (2021).
- Fridman, V., et al. Kinesin-5 Kip1 is a bi-directional motor that stabilizes microtubules and tracks their plus-ends in vivo. Journal of Cell Science. 126, 4147-4159 (2013).
- Edamatsu, M. Bidirectional motility of the fission yeast kinesin-5, Cut7. Biochemical and Biophysical Research Communications. 446 (1), 231-234 (2014).
- Popchock, A. R., et al. The mitotic kinesin-14 KlpA contains a context-dependent directionality switch. Nature Communications. 8, 13999 (2017).
- Bodrug, T., et al. The kinesin-5 tail domain directly modulates the mechanochemical cycle of the motor domain for anti-parallel microtubule sliding. eLife. 9 (9), 51131 (2020).
- Gheber, L., Kuo, S. C., Hoyt, M. A. Motile properties of the kinesin-related Cin8p spindle motor extracted from Saccharomyces cerevisiae cells. Journal of Biological Chemistry. 274 (14), 9564-9572 (1999).
- Pandey, H., et al. Flexible microtubule anchoring modulates the bi-directional motility of the kinesin-5 Cin8. Cellular and Molecular Life Sciences. 78 (16), 6051-6068 (2021).
- Shapira, O., Gheber, L. Motile properties of the bi-directional kinesin-5 Cin8 are affected by phosphorylation in its motor domain. Scientific Reports. 6, 25597 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Britto, M., et al. Schizosaccharomyces pombe kinesin-5 switches direction using a steric blocking mechanism. Proceedings of the National Academy of Sciences of the United States of America. 113 (47), 7483-7489 (2016).
- Kapitein, L. C., et al. Microtubule cross-linking triggers the directional motility of kinesin-5. Journal of Cell Biology. 182 (3), 421-428 (2008).
- Furuta, K., Edamatsu, M., Maeda, Y., Toyoshima, Y. Y. Diffusion and directed movement in vitro motile properties of fission yeast kinesin-14 Pkl1. Journal of Biological Chemistry. 283 (52), 36465-36473 (2008).
- Katrukha, E. A., et al. Probing cytoskeletal modulation of passive and active intracellular dynamics using nanobody-functionalized quantum dots. Nature Communications. 8, 14772 (2017).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Jakobs, M. A. H., Dimitracopoulos, A., Franze, K. KymoBulter, a deep learning software for automated kymograph analysis. eLife. 8, 42288 (2019).

