أدوات الموائع الدقيقة للتحقيق في التفاعلات الفطرية الميكروبية على المستوى الخلوي
Summary
نظرا لعتامة التربة ، لا يمكن بسهولة تصور التفاعلات بين الميكروبات المكونة لها بدقة خلوية. هنا ، يتم تقديم أداتين للسوائل الدقيقة ، والتي توفر فرصا جديدة للتحقيق في التفاعلات الفطرية الميكروبية. الأجهزة متعددة الاستخدامات وسهلة الاستخدام ، مما يتيح التحكم الزماني المكاني العالي والتصوير عالي الدقة على المستوى الخلوي.
Abstract
الفطريات الخيطية هي سكان ناجحون في التربة وتلعب دورا رئيسيا في النظم الإيكولوجية للتربة ، مثل تحلل المواد العضوية وغير العضوية ، وكذلك تنظيم مستويات المغذيات. هناك يجدون أيضا العديد من الفرص للتفاعل مع مجموعة متنوعة من الميكروبات الأخرى مثل البكتيريا أو الفطريات الأخرى. ومع ذلك ، فإن دراسة التفاعلات الفطرية على المستوى الخلوي يمكن أن تكون صعبة بسبب طبيعة التربة الشبيهة بالصندوق الأسود. ويجري تطوير أدوات جديدة للموائع الدقيقة لدراسة التفاعلات الفطرية؛ يتم تسليط الضوء على منصتين مصممتين لدراسة التفاعلات البكتيرية الفطرية والفطرية والفطرية. داخل هذه القنوات الدقيقة ، يمكن مراقبة التفاعلات الفطرية الميكروبية في بيئات فيزيائية كيميائية خاضعة للرقابة بدقة زمنية ومكانية أعلى مما كان ممكنا في السابق. وقد أسفر تطبيق هذه الأدوات عن العديد من الرؤى البيولوجية الجديدة، مثل ملاحظة الارتباط القطبي البكتيري بالهيفاي أو الكشف عن العداوات الفطرية الفطرية غير المميزة. ومن السمات الرئيسية لهذه المنهجيات سهولة استخدام هذه الأداة من قبل غير الخبراء، مما ينتج عنه تكنولوجيات قابلة للترجمة بدرجة عالية لاستخدامها في مختبرات علم الأحياء الدقيقة.
Introduction
التربة هي بيئة متنوعة بشكل استثنائي تحتوي على وفرة من الكائنات الحية الدقيقة التي لها دور أساسي في دورات الكربون والفوسفور 1,2. الفطريات الخيطية هي عنصر رئيسي في العديد من النظم الإيكولوجية كمتحللة للمواد العضوية وغير العضوية ويمكن أن تعزز تغذية النباتات من خلال تشكيل علاقات تكافلية 3,4. داخل التربة ، تتفاعل الفطريات ديناميكيا مع العديد من الميكروبات مثل الفطريات الأخرى5 والبكتيريا6 والفيروسات7 والديدان الخيطية8. هذه التفاعلات لها عواقب وخيمة على صحة التربة والنبات. ومع ذلك، وبسبب الافتقار إلى النظم التجريبية المناسبة القادرة على تصوير الكائنات الحية الدقيقة المتفاعلة بدقة عالية، لا يزال العديد منها غير محدد.
وللتحقيقات المتعلقة بالتفاعلات البكتيرية الفطرية والتفاعلات الفطرية والفطرية تطبيقات قيمة في طائفة من المجالات، بما في ذلك مضادات الميكروبات في الطب وعوامل المكافحة البيولوجية في الزراعة. على سبيل المثال ، ينتج الفطر Coprinopsis cinerea الببتيد copsin، الذي ثبت أنه يظهر نشاطا مضادا للبكتيريا ضد العامل الممرض البشري Listeria monocytogenes9. وبالمثل ، يستخدم المركب المشتق من الفطريات ، griseofulvin ، على نطاق واسع كعلاج للعدوى الفطرية البشرية ، بالإضافة إلى أنه قادر على تثبيط نمو الفطريات المسببة للأمراض النباتية Alternaria solani10,11. كما ثبت أن العديد من سلالات بكتيريا Bacillus subtilis التي تعيش في التربة هي عوامل فعالة للمكافحة الحيوية للنبات الفطري الممرض Rhizoctonia solani12,13. ومع ذلك، ونظرا للقيود المرتبطة بالمنهجيات التقليدية، فإن مؤسسات التمويل الدولية ومؤسسات التمويل الأجنبي غير مفهومة بشكل جيد على مستوى الخلايا المفردة.
عادة ما تستكشف الدراسات التقليدية BFIs و FFIs على النطاق الكلي باستخدام ألواح أجار مع نوعين أو أكثر في المواجهة. يتم تقييم تفاعلها عن طريق قياس معدلات النمو وإنتاج الأيض للأنواع المواجهة14،15،16 ؛ ومع ذلك ، يتم حل هذه المنهجية فقط على مستوى المستعمرة. لدراسة التفاعلات على المستوى الخلوي ، يمكن زراعة اللقاحات البكتيرية والفطرية على شرائح المجهر الزجاجية المغلفة بالأجار والتي يتم تصويرها بعد ذلك تحت المجهر17. ومع ذلك ، قد يكون من الصعب اتباع hypha واحد باستخدام شرائح المجهر بسبب عدم وجود حبس ، مما يعني أنه من الصعب الحصول على صور الفاصل الزمني. علاوة على ذلك ، فإن فرصة حصر الكائنات الحية الدقيقة الأخرى مكانيا داخل مناطق محددة من الميسيليوم الفطري أو إنشاء بيئات كيميائية محددة يمكن إزعاجها ، على سبيل المثال ، غير ممكنة في مثل هذه الإعدادات. تضيف طبيعة “الصندوق الأسود” للتربة أيضا إلى تعقيد دراسة التفاعلات الفطرية الميكروبية على مستوى الخلايا المفردة18. من خلال مراقبة الأنواع المتفاعلة بعيدا عن التنوع المذهل لميكروبيوم التربة ، يمكن تقييم الطريقة الدقيقة التي يتفاعل بها الأعضاء الأفراد. وبالتالي ، هناك حاجة مستمرة إلى منصات متعددة الاستخدامات تمكن من التصوير عالي الدقة وخلية واحدة ل BFIs و FFIs.
توفر تقنيات الموائع الدقيقة ، ما يسمى بأنظمة المختبر على رقاقة ، منصة مثالية لدراسة BFIs و FFIs على مستوى الخلايا المفردة. تم اعتماد مجال الموائع الدقيقة ، الناشئة عن التقنيات المطورة للتحليل الكيميائي والإلكترونيات الدقيقة ، من قبل العلوم البيولوجية19. تنظم تقنيات الموائع الدقيقة كميات صغيرة من السوائل داخل شبكة مخصصة من القنوات المصغرة ، لها بعد واحد على الأقل على مقياس الميكرومتر ، ويتوسع استخدامها في الأبحاث البيولوجية20. على وجه الخصوص ، تم تطوير أجهزة الموائع الدقيقة لدراسة نمو الفطريات الخيطية21،22،23،24،25،26،27،28،29،30. إحدى فوائد استخدام هذه التكنولوجيا هي أن حبس hyphae وتوزيع العناصر الغذائية داخل القنوات الدقيقة يشبه إلى حد كبير بنية بيئة التربة أكثر من طرق الأجار التقليدية31. في الآونة الأخيرة ، تم استخدام منصات الموائع الدقيقة للتحقيق في التفاعلات بين العدلات البشرية ومسببات الأمراض الفطرية32 ، والبكتيريا وجذور النباتات 33 ، وكذلك الفطريات والديدان الخيطية34,35.
واحدة من المزايا العديدة لاستخدام الموائع الدقيقة لدراسة التفاعلات الميكروبية تشمل التحكم المحدد في بيئة القنوات الدقيقة. على سبيل المثال ، يمكن استغلال أنظمة التدفق الرقائقي لتوليد تدرجات تركيز محددة ، وهو أمر مفيد بشكل خاص عند فحص التاكسي الكيميائي البكتيري36. ميزة أخرى هي أن الطبيعة الشفافة ل poly (dimethylsiloxane) (PDMS) ، وهو بوليمر مطاطي غير مكلف ومتوافق حيويا يستخدم عادة في تصنيع أجهزة الموائع الدقيقة ، يسهل التصوير عالي الدقة للخلايا المفردة باستخدام المجهر الساطع والفلوري37. وبالمثل ، فإن حبس الميكروبات داخل القنوات الدقيقة يعني أنه يمكن إجراء تجارب الفاصل الزمني التي تتعقب الخلايا المفردة ، مما يسمح بتسجيل الاستجابات الخلوية الفردية وتحديدها كميا37. وأخيرا، بما أنه يمكن تصميم أجهزة الموائع الدقيقة لتكون سهلة الاستخدام، يمكن استخدامها بسهولة من قبل غير الخبراء38.
ومن المهم تعزيز المعرفة بالتفاعلات بين الكائنات الحية الدقيقة التي تعيش في التربة لتحسين ممارسات الإدارة المستدامة للنظم الإيكولوجية التي تحافظ على التنوع البيولوجي وللتخفيف من أثر تغير المناخ على البيئات الأرضية39. وبالتالي ، فإن تطوير أدوات جديدة للموائع الدقيقة أمر أساسي لتوسيع فهم الفطريات وتفاعلاتها على المستوى الخلوي. وسيركز البروتوكول هنا على جهازين من أجهزة الموائع الدقيقة المنتجة لدراسة BFIs40 و FFIs41 كما هو موضح في الشكل 1.
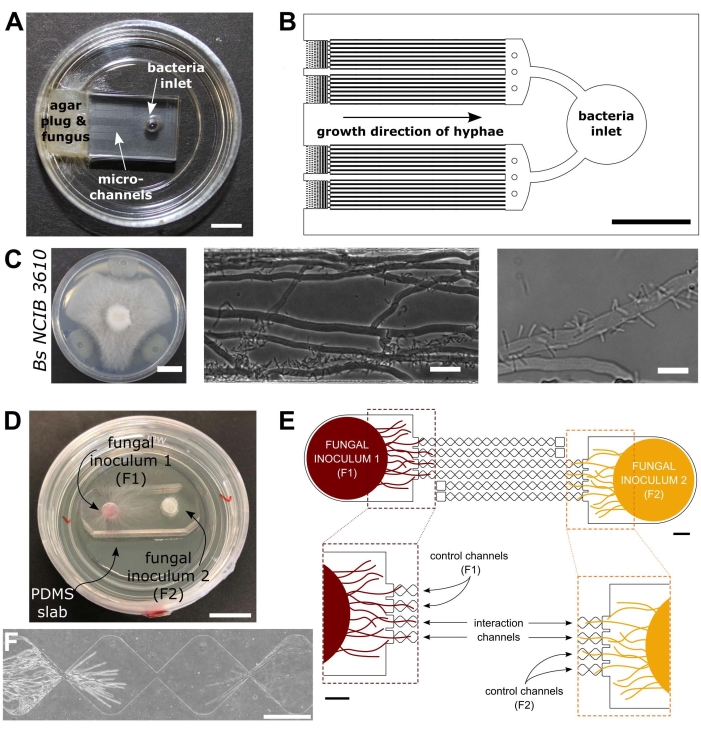
الشكل 1: التمثيل البصري والتخطيطي لأجهزة التفاعل البكتيري الفطري (BFI) والتفاعل الفطري الفطري (FFI). (أ) صورة لجهاز BFI. يتم وضع قابس mycelial عند مدخل أحد طرفي القنوات الدقيقة للسماح بنمو hyphal في الجهاز. المدخل البكتيري في الطرف المعاكس. شريط المقياس = 5 مم (B) نظرة عامة تخطيطية على جهاز BFI ، تصور موضع المداخل البكتيرية واتجاه نمو الواصلة من خلال القنوات الدقيقة التفاعلية. يبلغ عمق القنوات 10 ميكرومتر وعرضها 100 ميكرومتر وطولها 7 مم ، مع 28 قناة مراقبة في المجموع. (ج) فحص المواجهة على صفيحة أجار بين Coprinopsis cinerea و Bacillus subtilis NCIB 3610 ، شريط المقياس = 20 مم (يسار). صور مجهرية تظهر التفاعل بين C. cinerea و B. subtilis NCIB 3610 داخل القناة الدقيقة (الوسطى واليمنى) ، أي التعلق القطبي للبكتيريا ب hyphae الفطرية. شريط المقياس = 25 ميكرومتر (وسط) و 10 ميكرومتر (يمين). (د) صورة لجهاز FFI مرتبط بطبق بتري ذو قاع زجاجي ، ملقح مزدوج بسدادات mycelial. شريط المقياس = 1 سم (E) نظرة عامة تخطيطية لجهاز FFI. يتم إدخال اثنين من سدادات التطعيم الفطرية في المداخل في أي من طرفي الجهاز ، مما يسمح بالاستكشاف الواصلي للقنوات الدقيقة. ترتبط قنوات التحكم بمدخل فطري واحد فقط ولها قناة مسدودة ، مما يمنع التفاعلات بين فطريات الاختبار. تربط قنوات التفاعل كلا من المداخل الفطرية وتسمح بالتفاعلات الواصلة بين مواضيع الاختبار داخل القناة الدقيقة. تتكون كل قناة تفاعل من 18 قسما على شكل ماس ، يبلغ طولها الإجمالي 8.8 مم (490 × 430 ميكرومتر لكل ماسة) ، وعمقها 10 ميكرومتر ، ولها منطقة ربط بين كل ماسة تبلغ 20 ميكرومتر. يتم تكرار أنواع القنوات ، أشرطة المقياس = 1 مم. (F) منطقة التفاعل بين جبهتين واصليتين تقتربان ، تنمو من طرفي نقيض من قناة التفاعل المترابطة. صورة مجهرية لتباين الطور ، شريط مقياس = 250 ميكرومتر. تم تعديل اللوحات الواردة في هذا الشكل من Stanley et al., 2014 (A-C)40 and Gimeno et al., 2021 (D-F)41. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
تقدم هذه المقالة بروتوكولا لدراسة التفاعلات الفطرية الميكروبية باستخدام الموائع الدقيقة للقناة. يهدف المؤلفون إلى إظهار تنوع هذه الأجهزة وتشجيع التكيف لتناسب اهتمامات الباحث. باستخدام أجهزة BFI و FFI النموذجية ، يمكن دراسة التفاعلات الفطرية الميكروبية بمزيد من التفصيل مما كان يمكن الوصول…
Declarações
The authors have nothing to disclose.
Acknowledgements
نحن نقر بالدعم المالي المقدم من قسم الهندسة الحيوية في إمبريال كوليدج لندن و The Leverhulme Trust (مرجع منحة البحث: RPG-2020-352).
Materials
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
Referências
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).

