Mikrofluidische Werkzeuge zur Untersuchung pilzlich-mikrobieller Interaktionen auf zellulärer Ebene
Summary
Aufgrund der Opazität des Bodens können Wechselwirkungen zwischen seinen konstituierenden Mikroben nicht leicht mit zellulärer Auflösung sichtbar gemacht werden. Hier werden zwei mikrofluidische Werkzeuge vorgestellt, die neue Möglichkeiten bieten, pilzlich-mikrobielle Wechselwirkungen zu untersuchen. Die Geräte sind vielseitig und einfach zu bedienen und ermöglichen eine hohe räumlich-zeitliche Kontrolle und hochauflösende Bildgebung auf zellulärer Ebene.
Abstract
Filamentöse Pilze sind erfolgreiche Bewohner des Bodens und spielen eine wichtige Rolle in Bodenökosystemen, etwa beim Abbau organischer und anorganischer Stoffe, sowie bei der Regulierung des Nährstoffgehalts. Dort finden sie auch zahlreiche Möglichkeiten, mit einer Vielzahl anderer Mikroben wie Bakterien oder anderen Pilzen zu interagieren. Die Untersuchung von Pilzinteraktionen auf zellulärer Ebene kann jedoch aufgrund der Black-Box-ähnlichen Natur des Bodens eine Herausforderung darstellen. Neue mikrofluidische Werkzeuge werden für die Untersuchung von Pilzinteraktionen entwickelt; Zwei Plattformen zur Untersuchung von bakteriell-pilzlichen und Pilz-Pilz-Interaktionen werden hervorgehoben. Innerhalb dieser Mikrokanäle können pilzlich-mikrobielle Wechselwirkungen in kontrollierten physikalisch-chemischen Umgebungen mit höherer zeitlicher und räumlicher Auflösung als bisher beobachtet werden. Die Anwendung dieser Werkzeuge hat zahlreiche neue biologische Erkenntnisse hervorgebracht, wie z.B. die Beobachtung der bakteriellen polaren Bindung an Hyphen oder die Aufdeckung uncharakterisierter Pilz-Pilz-Antagonismen. Ein Schlüsselmerkmal dieser Methoden ist die einfache Verwendung dieses Tools durch Nicht-Experten, was zu hochgradig übersetzbaren Technologien für den Einsatz in mikrobiologischen Labors führt.
Introduction
Der Boden ist eine außergewöhnlich vielfältige Umgebung, die eine Fülle von Mikroorganismen enthält, die für Kohlenstoff- und Phosphorzyklen von entscheidender Bedeutung sind 1,2. Filamentöse Pilze sind ein wichtiger Bestandteil zahlreicher Ökosysteme als Zersetzer von organischer und anorganischer Substanz und können die Ernährung von Pflanzen durch die Bildung symbiotischer Beziehungenverbessern 3,4. Im Boden interagieren Pilze dynamisch mit einer Vielzahl von Mikroben wie anderen Pilzen5, Bakterien 6, Viren7 und Nematoden8. Diese Wechselwirkungen haben erhebliche Folgen für die Boden- und Pflanzengesundheit. Aufgrund des Mangels an geeigneten experimentellen Systemen, die in der Lage sind, interagierende Mikroorganismen mit hoher Auflösung abzubilden, bleiben viele jedoch undefiniert.
Untersuchungen zu bakteriell-pilzlichen Interaktionen (BFIs) und Pilz-Pilz-Interaktionen (FFIs) haben wertvolle Anwendungen in einer Reihe von Bereichen, darunter antimikrobielle Mittel in der Medizin und biologische Bekämpfungsmittel in der Landwirtschaft. Zum Beispiel produziert der Pilz Coprinopsis cinerea das Peptid Copsin, das nachweislich eine antibakterielle Aktivität gegen den menschlichen Erreger Listeria monocytogenes9 aufweist. Ebenso wird die pilzliche Verbindung Griseofulvin häufig zur Behandlung von menschlichen Pilzinfektionen eingesetzt und ist zusätzlich in der Lage, das Wachstum des pflanzenpathogenen Pilzes Alternaria solani10,11 zu hemmen. Mehrere Stämme des bodenbewohnenden Bakteriums Bacillus subtilis haben sich ebenfalls als wirksame Biokontrollmittel des pilzlichen Pflanzenpathogens Rhizoctonia solani12,13 erwiesen. Aufgrund von Einschränkungen, die mit traditionellen Methoden verbunden sind, werden BFIs und FFIs auf der Ebene einzelner Zellen jedoch nur unzureichend verstanden.
Konventionelle Studien untersuchen typischerweise BFIs und FFIs auf der Makroskala unter Verwendung von Agarplatten mit zwei oder mehr Arten in Konfrontation. Ihre Wechselwirkung wird durch Messung der Wachstumsraten und der Metabolitenproduktion der konfrontierenden Spezies14,15,16 bewertet; Diese Methodik wird jedoch nur auf Kolonieebene gelöst. Um Wechselwirkungen auf zellulärer Ebene zu untersuchen, können bakterielle und pilzliche Impfmittel auf mit Agar beschichteten Glasmikroskopobjektträgern kultiviert werden, die dann unter einem Mikroskopabgebildet werden 17. Dennoch kann es schwierig sein, einem einzelnen Hypha mit Objektträgern zu folgen, da es an Enge mangelt, was bedeutet, dass Zeitrafferbilder schwieriger zu erhalten sind. Darüber hinaus ist die Möglichkeit, andere Mikroorganismen räumlich in definierten Regionen des Pilzmyzels einzuschließen oder definierte chemische Umgebungen zu schaffen, die beispielsweise gestört werden können, in solchen Aufbauten nicht möglich. Die “Black Box” -Natur des Bodens trägt auch zur Komplexität der Untersuchung von Pilz-mikrobiellen Interaktionen auf der Ebene einzelner Zellenbei 18. Durch die Beobachtung interagierender Arten abseits der unglaublichen Vielfalt des Bodenmikrobioms kann die genaue Art und Weise, wie einzelne Mitglieder interagieren, beurteilt werden. Daher besteht weiterhin Bedarf an vielseitigen Plattformen, die eine hochauflösende Einzelzellbildgebung von BFIs und FFIs ermöglichen.
Mikrofluidische Technologien, sogenannte Lab-on-a-Chip-Systeme, bieten eine ideale Plattform für die Untersuchung von BFIs und FFIs auf der Ebene einzelner Zellen. Der Bereich der Mikrofluidik, der aus Technologien stammt, die für die chemische Analyse und Mikroelektronik entwickelt wurden, wurde von den Biowissenschaftenübernommen 19. Mikrofluidische Technologien regulieren kleine Mengen von Flüssigkeiten innerhalb eines maßgeschneiderten Netzwerks miniaturisierter Kanäle, die mindestens eine Dimension auf der Mikrometerskala haben, und ihre Verwendung in der biologischen Forschung nimmt zu20. Insbesondere wurden mikrofluidische Geräte entwickelt, um das Wachstum von fadenförmigen Pilzen 21,22,23,24,25,26,27,28,29,30 zu untersuchen. Ein Vorteil der Verwendung dieser Technologie besteht darin, dass der Einschluss von Hyphen und die Verteilung von Nährstoffen innerhalb von Mikrokanälen der Struktur der Bodenumgebung ähnlicher ist als herkömmliche Agarmethoden31. In jüngster Zeit wurden mikrofluidische Plattformen verwendet, um Wechselwirkungen zwischen menschlichen Neutrophilen und pilzlichen Krankheitserregern 32, Bakterien und Pflanzenwurzeln33 sowie Pilzen und Nematoden34,35 zu untersuchen.
Einer der vielen Vorteile der Verwendung von Mikrofluidik zur Untersuchung mikrobieller Wechselwirkungen ist die spezifische Steuerung der Mikrokanalumgebung. Zum Beispiel können laminare Strömungsregime genutzt werden, um definierte Konzentrationsgradienten zu erzeugen, was besonders bei der Untersuchung der bakteriellen Chemotaxis36 nützlich ist. Ein weiterer Vorteil ist, dass die transparente Natur von Poly(dimethylsiloxan) (PDMS), einem kostengünstigen, biokompatiblen Elastomerpolymer, das üblicherweise bei der Herstellung von mikrofluidischen Bauelementen verwendet wird, die hochauflösende Bildgebung einzelner Zellen mittels Hellfeld- und Fluoreszenzmikroskopieermöglicht 37. Ebenso bedeutet der Einschluss von Mikroben in Mikrokanälen, dass Zeitrafferexperimente, die einzelne Zellen verfolgen, durchgeführt werden können, so dass einzelne zelluläre Reaktionen aufgezeichnet und quantifiziert werdenkönnen 37. Da mikrofluidische Geräte benutzerfreundlich gestaltet werden können, können sie von Nicht-Experten leicht eingesetzt werden38.
Die Förderung des Wissens über die Wechselwirkungen zwischen bodenbewohnenden Mikroorganismen ist wichtig, um nachhaltige Ökosystembewirtschaftungspraktiken zu verbessern, die die biologische Vielfalt erhalten und die Auswirkungen des Klimawandels auf die terrestrische Umwelt mildern39. Daher ist die Entwicklung neuartiger mikrofluidischer Werkzeuge von grundlegender Bedeutung, um das Verständnis von Pilzen und ihren Wechselwirkungen auf zellulärer Ebene zu erweitern. Das Protokoll konzentriert sich hier auf zwei mikrofluidische Geräte, die für die Untersuchung der BFIs40 und FFIs41 hergestellt wurden, wie in Abbildung 1 dargestellt.
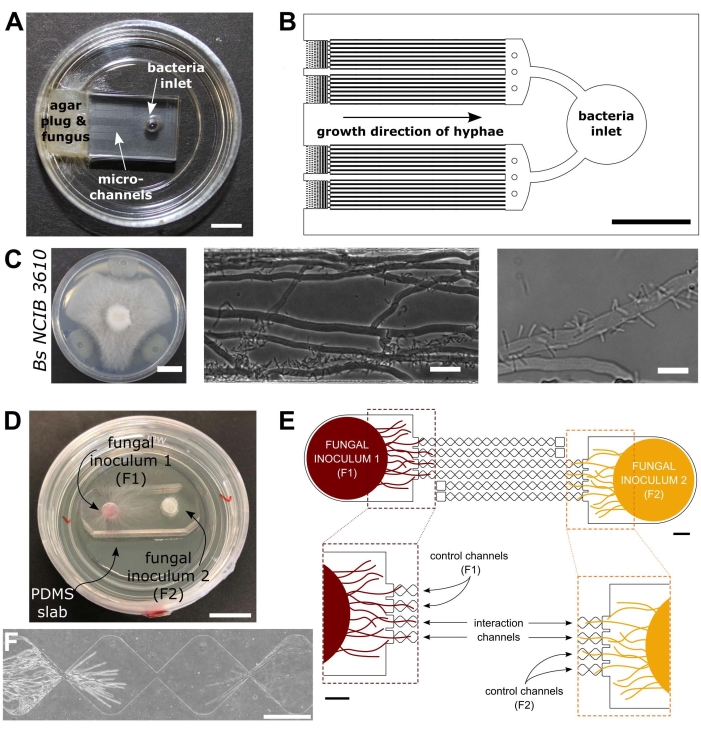
Abbildung 1: Visuelle und schematische Darstellung der Geräte für die bakterielle-pilzische Interaktion (BFI) und die Pilz-Pilz-Interaktion (FFI). (A) Bild des BFI-Geräts. Ein Myzelstopfen wird am Eingang zu einem Ende der Mikrokanäle platziert, um das Wachstum der Hyphen in das Gerät zu ermöglichen. Der bakterielle Einlass befindet sich am gegenüberliegenden Ende. Maßstabsleiste = 5 mm. (B) Schematische Übersicht des BFI-Geräts, das die Positionierung der bakteriellen Einlässe und die Richtung des Hyphenwachstums durch die Interaktionsmikrokanäle darstellt. Die Kanäle sind 10 μm tief, 100 μm breit und 7 mm lang, mit insgesamt 28 Beobachtungskanälen. (C) Konfrontationstest auf Agarplatte zwischen Coprinopsis cinerea und Bacillus subtilis NCIB 3610, Skalenstab = 20 mm (links). Mikroskopische Aufnahmen, die die Wechselwirkung zwischen C. cinerea und B. subtilis NCIB 3610 innerhalb des Mikrokanals (Mitte und rechts) zeigen, d.h. die polare Anheftung von Bakterien an Pilzhyphen. Skalenbalken = 25 μm (Mitte) und 10 μm (rechts). (D) Abbildung des FFI-Geräts, das an eine Petrischale mit Glasboden gebunden ist, die mit Myzelstopfen doppelt beimpft ist. Maßstabsleiste = 1 cm. (E) Schematische Übersicht des FFI-Geräts. Zwei Pilzimpfstopfen werden an beiden Enden des Geräts in die Einlässe eingeführt, was eine hyphalische Exploration der Mikrokanäle ermöglicht. Die Steuerkanäle sind nur mit einem Pilzeinlass verbunden und haben einen Sackgassenkanal, der Wechselwirkungen zwischen den Testpilzen verhindert. Interaktionskanäle verbinden beide Pilzeinlässe und ermöglichen hyphalische Interaktionen zwischen den Probanden innerhalb des Mikrokanals. Jeder Interaktionskanal besteht aus 18 rautenförmigen Abschnitten, die eine Gesamtlänge von 8,8 mm (490 x 430 μm pro Diamant), 10 μm tief und einen Verbindungsbereich zwischen jedem Diamanten von 20 μm messen. Kanaltypen werden dupliziert, Maßstabsbalken = 1 mm. (F) Interaktionszone zwischen zwei sich nähernden Hyphenfronten, die von gegenüberliegenden Enden des miteinander verbundenen Interaktionskanals wächst. Phasenkontrastmikroskopie-Bild, Maßstabsbalken = 250 μm. Die Paneele in dieser Abbildung wurden von Stanley et al., 2014 (A-C)40 und Gimeno et al., 2021 (D-F)41 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Dieser Artikel stellt ein Protokoll zur Untersuchung von Pilz-mikrobiellen Wechselwirkungen unter Verwendung der Kanalmikrofluidik vor. Ziel der Autoren ist es, die Vielseitigkeit dieser Geräte zu demonstrieren und die Anpassung an die Interessen des Forschers zu fördern. Mit Hilfe der beispielhaften BFI- und FFI-Geräte können pilzlich-mikrobielle Wechselwirkungen detaillierter untersucht werden, als bisher zugänglich. Durch die Beseitigung der Hintergrundkomplexität und Heterogenität des Bodens, die Moderation de…
Declarações
The authors have nothing to disclose.
Acknowledgements
Wir danken der finanziellen Unterstützung des Department of Bioengineering am Imperial College London und des Leverhulme Trust (Research Grant Reference: RPG-2020-352).
Materials
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
Referências
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).

