Outils microfluidiques pour sonder les interactions fongiques-microbiennes au niveau cellulaire
Summary
En raison de l’opacité du sol, les interactions entre ses microbes constitutifs ne peuvent pas être facilement visualisées avec une résolution cellulaire. Ici, deux outils microfluidiques sont présentés, qui offrent de nouvelles opportunités pour étudier les interactions fongiques-microbiennes. Les appareils sont polyvalents et simples à utiliser, permettant un contrôle spatio-temporel élevé et une imagerie haute résolution au niveau cellulaire.
Abstract
Les champignons filamenteux sont des habitants prospères du sol et jouent un rôle majeur dans les écosystèmes du sol, tels que la décomposition de la matière organique et inorganique, ainsi que la régulation des niveaux de nutriments. Ils y trouvent également de nombreuses occasions d’interagir avec une variété d’autres microbes tels que des bactéries ou d’autres champignons. L’étude des interactions fongiques au niveau cellulaire, cependant, peut être difficile en raison de la nature du sol ressemblant à une boîte noire. De nouveaux outils microfluidiques sont en cours de développement pour l’étude des interactions fongiques; deux plateformes conçues pour étudier les interactions bactérien-fongique et fongique-fongique sont mises en évidence. Au sein de ces microcanaux, les interactions fongiques-microbiennes peuvent être surveillées dans des environnements physico-chimiques contrôlés à une résolution temporelle et spatiale plus élevée qu’auparavant. L’application de ces outils a donné lieu à de nombreuses nouvelles connaissances biologiques, telles que l’observation de l’attachement polaire bactérien aux hyphes ou la révélation d’antagonismes fongiques-fongiques non caractérisés. Une caractéristique clé de ces méthodologies concerne la facilité d’utilisation de cet outil par des non-experts, produisant des technologies hautement traduisibles pour une utilisation dans les laboratoires de microbiologie.
Introduction
Le sol est un environnement exceptionnellement diversifié contenant une abondance de micro-organismes qui jouent un rôle déterminant dans les cyclesdu carbone et du phosphore 1,2. Les champignons filamenteux sont une composante majeure de nombreux écosystèmes en tant que décomposeurs de matière organique et inorganique et peuvent améliorer la nutrition des plantes grâce à la formation de relations symbiotiques 3,4. Dans le sol, les champignons interagissent dynamiquement avec une multitude de microbes tels que d’autres champignons5, bactéries6, virus7 et nématodes8. Ces interactions ont des conséquences importantes sur la santé des sols et des plantes. Pourtant, en raison d’un manque de systèmes expérimentaux appropriés capables d’imager les micro-organismes en interaction avec une haute résolution, beaucoup restent indéfinis.
Les recherches concernant les interactions bactériens-fongiques (IFI) et les interactions fongiques-fongiques (IFF) ont des applications précieuses dans divers domaines, y compris les antimicrobiens en médecine et les agents de lutte biologique en agriculture. Par exemple, le champignon Coprinopsis cinerea produit le peptide copsine, dont il a été démontré qu’il présente une activité antibactérienne contre l’agent pathogène humain Listeria monocytogenes9. De même, le composé dérivé du champignon, la griséofulvine, est largement utilisé comme traitement des infections fongiques humaines et est en outre capable d’inhiber la croissance du champignon phytopathogène Alternaria solani10,11. Il a également été démontré que plusieurs souches de la bactérie bacillus subtilis sont des agents de lutte biologique efficaces de l’agent pathogène fongique des plantes Rhizoctonia solani12,13. Néanmoins, en raison des limites associées aux méthodologies traditionnelles, les IFI et les IFF sont mal compris au niveau des cellules individuelles.
Les études conventionnelles explorent généralement les IFI et les IFF à l’échelle macro en utilisant des plaques de gélose avec deux espèces ou plus en confrontation. Leur interaction est évaluée en mesurant les taux de croissance et la production de métabolites de l’espèce confrontante 14,15,16; cependant, cette méthodologie n’est résolue qu’au niveau de la colonie. Pour étudier les interactions au niveau cellulaire, les inoculants bactériens et fongiques peuvent être cultivés sur des lames de microscope en verre recouvertes d’agar qui sont ensuite imagées au microscope17. Néanmoins, il peut être difficile de suivre un seul hyphe à l’aide de lames de microscope en raison d’un manque de confinement, ce qui signifie que les images time-lapse sont plus difficiles à obtenir. En outre, la possibilité de confiner spatialement d’autres micro-organismes dans des régions définies du mycélium fongique ou de créer des environnements chimiques définis qui peuvent être perturbés, par exemple, n’est pas possible dans de telles configurations. La nature « boîte noire » du sol ajoute également à la complexité de l’étude des interactions fongiques-microbiennes au niveau des cellules individuelles18. En observant les espèces en interaction loin de l’incroyable diversité du microbiome du sol, la manière exacte dont les membres individuels interagissent peut être évaluée. Ainsi, il existe un besoin continu de plates-formes polyvalentes qui permettent l’imagerie unicellulaire à haute résolution des IFI et des IFF.
Les technologies microfluidiques, appelées systèmes de laboratoire sur puce, constituent une plate-forme idéale pour l’étude des BFI et des IFF au niveau des cellules individuelles. Le domaine de la microfluidique, issu des technologies développées pour l’analyse chimique et la microélectronique, a été adopté par les sciences biologiques19. Les technologies microfluidiques régulent de petits volumes de fluides au sein d’un réseau sur mesure de canaux miniaturisés, ayant au moins une dimension à l’échelle micrométrique, et leur utilisation dans la recherche biologique s’étend20. En particulier, des dispositifs microfluidiques ont été développés pour examiner la croissance des champignons filamenteux 21,22,23,24,25,26,27,28,29,30. L’un des avantages de l’utilisation de cette technologie est que le confinement des hyphes et la distribution des nutriments dans les microcanaux ressemblent davantage à la structure de l’environnement du sol que les méthodes conventionnelles d’agar31. Récemment, des plateformes microfluidiques ont été utilisées pour étudier les interactions entre les neutrophiles humains et les agents pathogènes fongiques32, les bactéries et les racines des plantes33, ainsi que les champignons et les nématodes34,35.
L’un des nombreux avantages de l’utilisation de la microfluidique pour étudier les interactions microbiennes comprend le contrôle spécifique de l’environnement des microcanaux. Par exemple, les régimes d’écoulement laminaire peuvent être exploités pour générer des gradients de concentration définis, ce qui est particulièrement utile lors de l’examen de la chimiotaxie bactérienne36. Un autre avantage est que la nature transparente du poly(diméthylsiloxane) (PDMS), un polymère élastomère biocompatible peu coûteux couramment utilisé dans la fabrication de dispositifs microfluidiques, facilite l’imagerie à haute résolution de cellules individuelles à l’aide de la microscopie à fond clair et à fluorescence37. De même, le confinement des microbes dans des microcanaux signifie que des expériences en accéléré de suivi de cellules individuelles peuvent être effectuées, permettant d’enregistrer et de quantifier les réponses cellulaires individuelles37. Enfin, comme les dispositifs microfluidiques peuvent être conçus pour être conviviaux, ils peuvent être facilement utilisés par des non-experts38.
Il est important de mieux connaître les interactions entre les micro-organismes vivant dans le sol pour améliorer les pratiques de gestion durable des écosystèmes qui maintiennent la biodiversité et atténuer l’impact des changements climatiques sur les environnements terrestres39. Ainsi, le développement de nouveaux outils microfluidiques est fondamental pour élargir la compréhension des champignons et de leurs interactions au niveau cellulaire. Le protocole ici se concentrera sur deux dispositifs microfluidiques produits pour l’étude des BFI40 et41 tels que représentés à la figure 1.
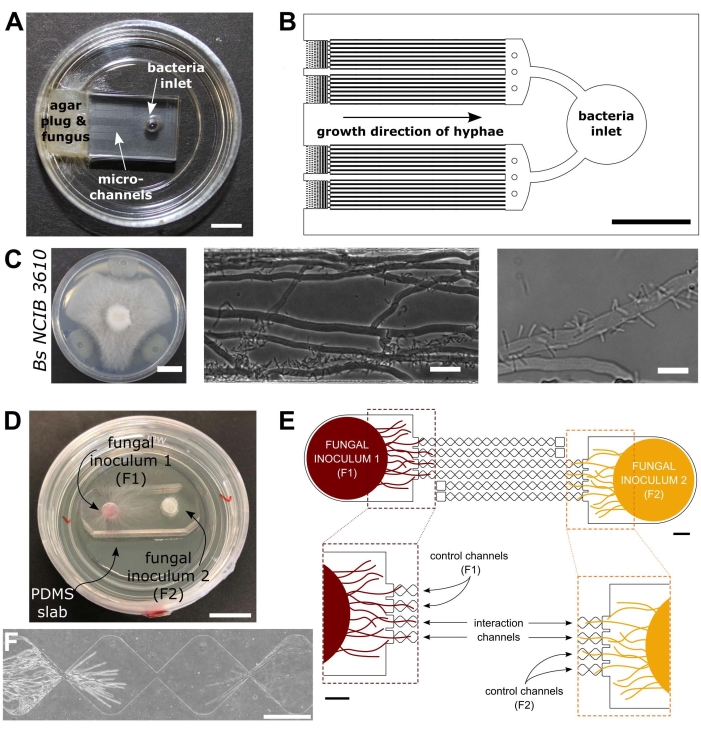
Figure 1 : Représentation visuelle et schématique des dispositifs d’interaction bactérienne-fongique (BFI) et d’interaction fongique (FFI). (A) Image du dispositif BFI. Un bouchon mycélien est placé à l’entrée d’une extrémité des microcanaux pour permettre la croissance hyphale dans l’appareil. L’entrée bactérienne se trouve à l’extrémité opposée. Barre d’échelle = 5 mm. (B) Vue d’ensemble schématique du dispositif BFI, décrivant le positionnement des entrées bactériennes et la direction de la croissance hyphale à travers les microcanaux d’interaction. Les canaux ont une profondeur de 10 μm, une largeur de 100 μm et une longueur de 7 mm, avec 28 canaux d’observation au total. (C) Essai de confrontation sur plaque de gélose entre Coprinopsis cinerea et Bacillus subtilis NCIB 3610, barre d’échelle = 20 mm (à gauche). Images microscopiques montrant l’interaction entre C. cinerea et B. subtilis NCIB 3610 dans le microcanal (milieu et droite), c’est-à-dire la fixation polaire des bactéries aux hyphes fongiques. Barre d’échelle = 25 μm (au milieu) et 10 μm (à droite). (D) Image du dispositif FFI collé à une boîte de Petri à fond de verre, double inoculée avec des bouchons mycéliens. Barre d’échelle = 1 cm. (E) Vue d’ensemble schématique du périphérique FFI. Deux bouchons d’inoculant fongiques sont introduits dans les entrées à chaque extrémité de l’appareil, permettant l’exploration hyphale des microcanaux. Les canaux de contrôle sont connectés à une seule entrée fongique et ont un canal sans issue, empêchant les interactions entre les champignons d’essai. Les canaux d’interaction relient les deux entrées fongiques et permettent des interactions hyphales entre les sujets testés au sein du microcanal. Chaque canal d’interaction se compose de 18 sections en forme de diamant, mesurant une longueur totale de 8,8 mm (490 x 430 μm par diamant), 10 μm de profondeur et ayant une région de connexion entre chaque diamant de 20 μm. Les types de canaux sont dupliqués, barres d’échelle = 1 mm. (F) Zone d’interaction entre deux fronts hyphales approchants, se développant à partir des extrémités opposées du canal d’interaction interconnecté. Image de microscopie à contraste de phase, barre d’échelle = 250 μm. Les panneaux de cette figure ont été modifiés à partir de Stanley et al., 2014 (A-C)40 et Gimeno et al., 2021 (D-F)41. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Cet article présente un protocole pour l’étude des interactions fongiques-microbiennes à l’aide de la microfluidique des canaux. Les auteurs visent à démontrer la polyvalence de ces dispositifs et à encourager l’adaptation en fonction des intérêts du chercheur. En utilisant les dispositifs BFI et FFI exemplaires, les interactions fongiques-microbiennes peuvent être étudiées plus en détail qu’auparavant. En supprimant la complexité et l’hétérogénéité du fond du sol, en modérant la croissance d…
Declarações
The authors have nothing to disclose.
Acknowledgements
Nous reconnaissons le soutien financier du département de bio-ingénierie de l’Imperial College de Londres et du Leverhulme Trust (référence de subvention de recherche: RPG-2020-352).
Materials
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
Referências
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).

