11.11:
انتقالات المرحلة: التصاعد والترسب
11.11:
انتقالات المرحلة: التصاعد والترسب
يمكن أن تنتقل بعض المواد الصلبة مباشرة إلى الحالة الغازية ، متجاوزة الحالة السائلة ، عبر عملية تعرف باسم التسامي. في درجة حرارة الغرفة والضغط القياسي ، قطعة من الثلج الجاف (CO2 الصلب) يتصاعد، ويبدو أنه يختفي تدريجيًا دون أن يتشكل أي سائل على الإطلاق. يتصاعد الثلج والجليد في درجات حرارة أقل من نقطة انصهار الماء، وهي عملية بطيئة قد تتسارع بفعل الرياح وانخفاض الضغط الجوي على ارتفاعات عالية. وعندما يتم تسخين اليود الصلب، يتصاعد الصلب ويتشكل بخار أرجواني زاهي. يسمى عكس التصاعد الترسيب، وهي عملية تتكثف فيها المواد الغازية مباشرة في الحالة الصلبة ، متجاوزة الحالة السائلة. وتشكيل الصقيع هو مثال على الترسيب.
مثل التبخر ، تتطلب عملية التصاعد مدخلات من الطاقة للتغلب على عوامل الجذب بين الجزيئات. وبالتالي ، فإن التصاعد هو انتقال طور ماص للحرارة. المحتوى الحراري للتسامي ،ΔHsub، هو الطاقة المطلوبة لتحويل مول واحد من مادة من الحالة الصلبة إلى الحالة الغازية. على سبيل المثال ، يتم تمثيل تصاعد ثاني أكسيد الكربون بواسطة:

وبالمثل، فإن التغير في المحتوى الحراري لعملية الترسيب العكسي يساوي الحجم ولكنه عكس ذلك في الإشارة إلى ذلك من أجل التسامي. نظراً لأن الترسيب ينطوي على تكوين قوى بين الجزيئات ، فهو مرحلة انتقالية طاردة للحرارة.

ضع في اعتبارك إلى أي مدى يجب التغلب على عوامل الجذب بين الجزيئات لتحقيق انتقال طور معين. يتطلب تحويل مادة صلبة إلى سائل التغلب على عوامل الجذب هذه جزئيًا فقط ؛ يتطلب الانتقال إلى الحالة الغازية التغلب عليها تمامًا. ونتيجة لذلك ، فإن المحتوى الحراري لانصهار مادة ما يكون أقل من المحتوى الحراري الخاص بالتبخير. يمكن استخدام هذا المنطق نفسه لاشتقاق علاقة تقريبية بين المحتوى الحراري لجميع تغييرات الطور لمادة معينة. على الرغم من أنه ليس وصفًا دقيقًا تمامًا ، يمكن تصميم نموذج التسامي بشكل ملائم باعتباره عملية ذوبان متتابعة من خطوتين متبوعة بالتبخير من أجل تطبيق قانون هيس. من هذا المنطلق ، يمكن تقدير المحتوى الحراري للتسامي لمادة ما كمجموع محتواه من الانصهار والتبخير.
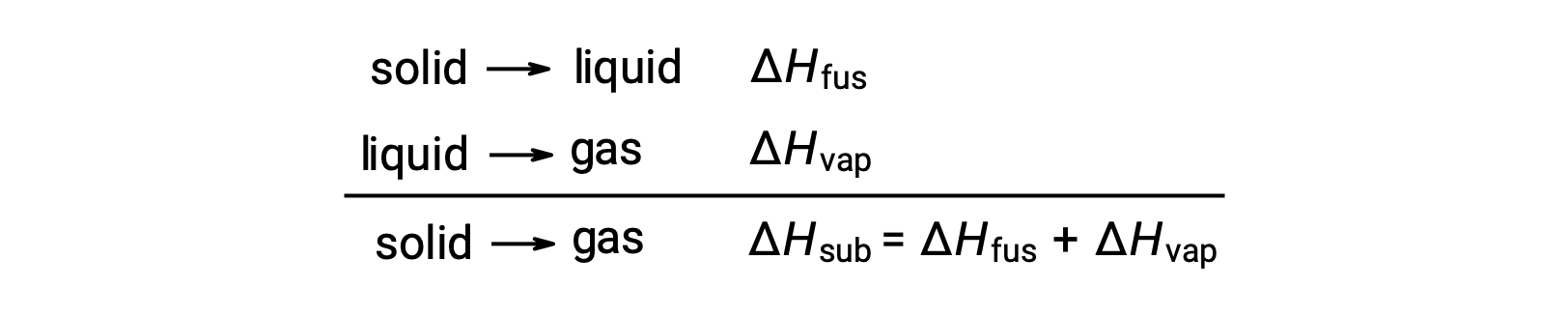
هذا النص مقتبس من Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
