11.11:
Transições de Fase: Sublimação e Deposição
11.11:
Transições de Fase: Sublimação e Deposição
Alguns sólidos podem fazer a transição diretamente para o estado gasoso, contornando o estado líquido, através de um processo conhecido como sublimação. À temperatura ambiente e à pressão padrão, um pedaço de gelo seco (CO2 sólido) sublima, parecendo desaparecer gradualmente sem nunca formar qualquer líquido. A neve e o gelo sublimam a temperaturas abaixo do ponto de fusão da água, um processo lento que pode ser acelerado pelos ventos e as pressões atmosféricas reduzidas a altitudes elevadas. Quando o iodo sólido é aquecido, o sólido sublima e forma-se um vapor roxo vivo. O inverso da sublimação é chamado de deposição, um processo no qual as substâncias gasosas se condensam diretamente para o estado sólido, contornando o estado líquido. A formação de geada é um exemplo de deposição.
Como a vaporização, o processo de sublimação requer uma entrada de energia para superar as atrações intermoleculares. A sublimação é, portanto, uma transição de fase endotérmica. A entalpia de sublimação, ΔHsub, é a energia necessária para converter um mole de uma substância do estado sólido para o estado gasoso. Por exemplo, a sublimação do dióxido de carbono é representada por:

Da mesma forma, a mudança de entalpia para o processo inverso de deposição é igual em magnitude, mas oposta em sinal em relação à sublimação. Como a deposição envolve a formação de forças intermoleculares, é uma transição de fase exotérmica.

Considere a medida em que as atrações intermoleculares devem ser superadas para alcançar uma determinada transição de fase. A conversão de um sólido para um líquido requer que essas atrações sejam superadas apenas parcialmente; a transição para o estado gasoso exige que sejam completamente superadas. Como resultado, a entalpia de fusão de uma substância é inferior à sua entalpia de vaporização. Esta mesma lógica pode ser utilizada para obter uma relação aproximada entre as entalpias de todas as alterações de fase para uma determinada substância. Embora não seja uma descrição inteiramente precisa, a sublimação pode ser convenientemente modelada como um processo sequencial de fusão em duas etapas, seguido pela vaporização, a fim de aplicar a Lei de Hess. Visto desta forma, a entalpia de sublimação para uma substância pode ser estimada como a soma das suas entalpias de fusão e vaporização.
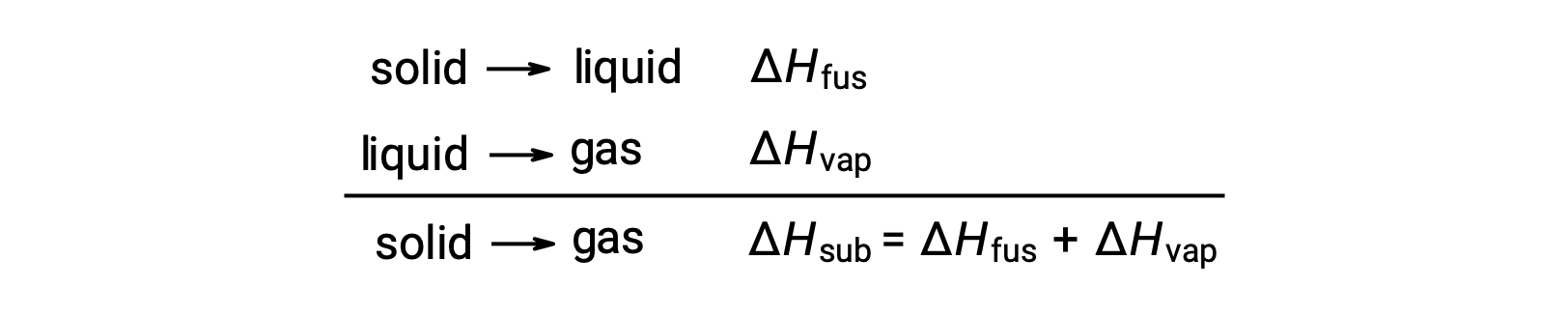
Este texto é adaptado de Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
