15.4:
pHスケール
15.4:
pHスケール
ヒドロニウムイオンと水酸化物イオンは、純水にもすべての水溶液にも存在し、その濃度は水のイオン積(Kw)で決まる反比例の関係にあります。水溶液中のこれらのイオンの濃度は、しばしば溶液の特性や他の溶質の化学的挙動を決定する重要な要素となります。2つの異なる溶液のヒドロニウムイオンや水酸化物イオンの濃度は、100万倍、10億倍、あるいは1兆倍の差があります。このような桁違いの量を表現するには、対数目盛を用いるのが一般的です。ここで、[H3O+]は溶液中のヒドロニウムイオンのモル濃度です。
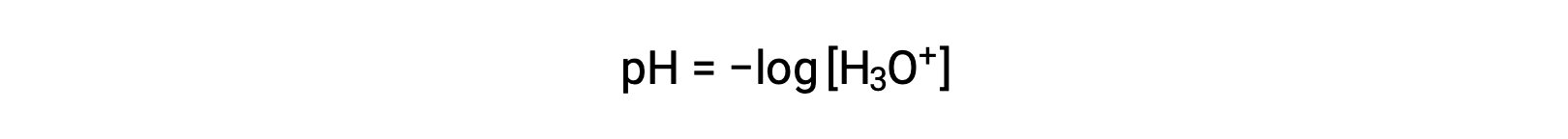
この式を再整理してヒドロニウムイオンのモル濃度を分離すると、同等の式が得られます。
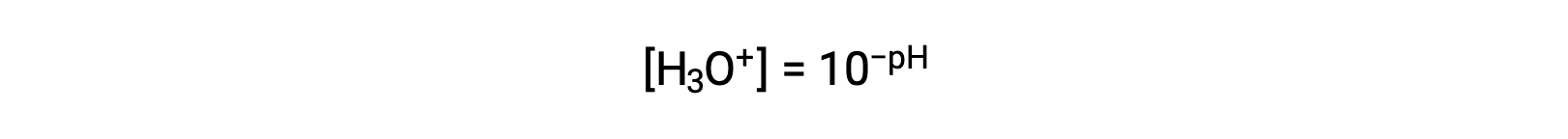
同様に、水酸化物イオンのモル度はpOHとして表すことができます。:

or
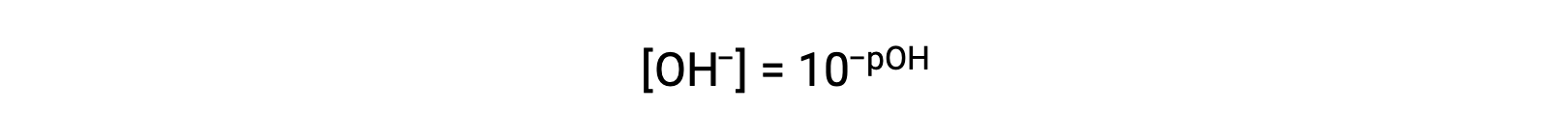
最後に、これらの2つのイオン濃度の関係をpHあるいはpOHで表すと、KWの式から簡単に導かれます。 :
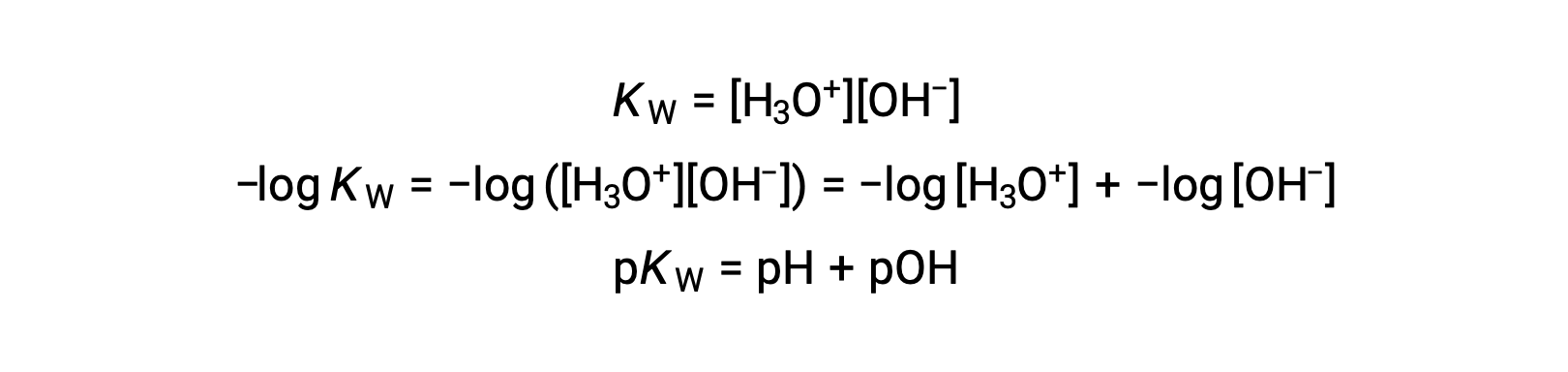
25 °Cでは、KWの値は1.0 × 10−14となります。
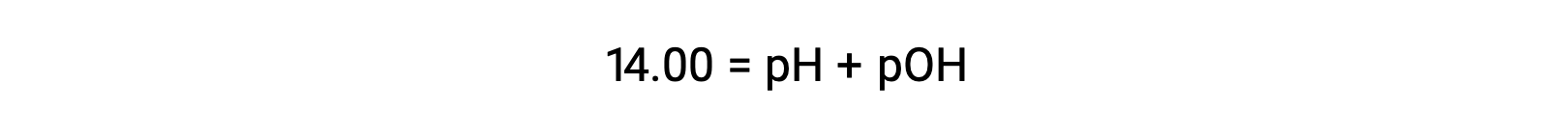
純水(または中性溶液)中のヒドロニウムイオンのモル比は、25 °Cで1.0 ×10−7 Mです。したがって、この温度での中性溶液のpHとpOHは次のようになります。
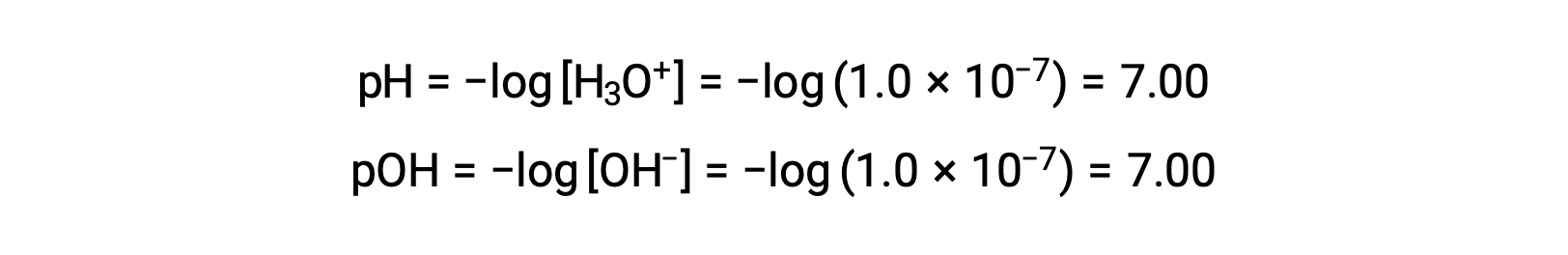
そして、この温度ではヒドロニウムイオンのモル数が1.0 × 10−7Mより大きく、水酸化物イオンのモル数が1.0 × 10−7Mより小さいものが酸性溶液となる(pH値が7.00より小さく、pOH値が7.00より大きいものに相当)。塩基性溶液とは、ヒドロニウムイオンのモル数が1.0 × 10−7 M未満で、水酸化物イオンのモル数が1.0 × 10−7 M以上のもの(pH値が7.00以上、pOH値が7.00未満に相当)を指します。
自己解離定数KWは温度に依存するため、pH値と酸性/中性/塩基性の相関関係は、25 °C以外の温度では異なります。例えば、80°Cでの純水のヒドロニウムモル度は4.9 × 10−7 Mであり、これは次のpH値とpOH値に対応します。

この温度では、中性溶液はpH = pOH = 6.31、酸性溶液はpHが6.31未満でpOHが6.31以上、塩基性溶液はpHが6.31以上でpOHが6.31未満となります。この区別は、36 – 40℃前後の恒温動物の酵素反応など、他の温度で起こるプロセスを研究する際に重要となります。特に断りのない限り、pH値は25℃での値であると推定されます。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.2: pH and pOH.
Suggested Reading
- van Lubeck, Henk. "Why not replace pH and pOH by just one real acidity grade, AG?." Journal of Chemical Education 76, no. 7 (1999): 892. https://pubs.acs.org/doi/pdf/10.1021/ed076p892
