15.4:
Escala de pH
15.4:
Escala de pH
Os iões hidrónio e hidróxido estão presentes tanto em água pura como em todas as soluções aquosas, sendo as suas concentrações inversamente proporcionais, conforme determinado pelo produto iónico da água (Kw). As concentrações desses iões em uma solução são muitas vezes determinantes críticos das propriedades da solução e dos comportamentos químicos dos seus outros solutos. Duas soluções diferentes podem diferir nas suas concentrações de iões hidrónio ou hidróxido em um milhão, mil milhões, ou mesmo um bilião de vezes. Um meio comum de expressar quantidades que podem abranger muitas ordens de grandeza é usar uma escala logarítmica. O pH de uma solução é, portanto, definido como mostrado aqui, onde [H3O+] é a concentração molar de iões hidrónio na solução:
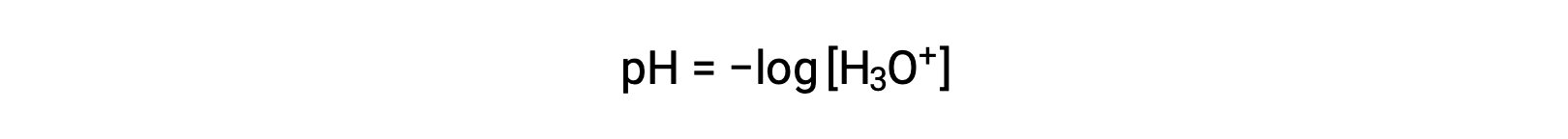
Reorganizando esta equação para isolar a molaridade do ião hidrónio produz a expressão equivalente:
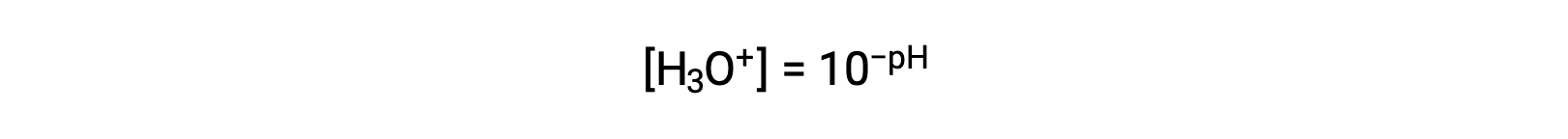
Da mesma forma, a molaridade do ião hidróxido pode ser expressa como uma função p ou pOH:

ou
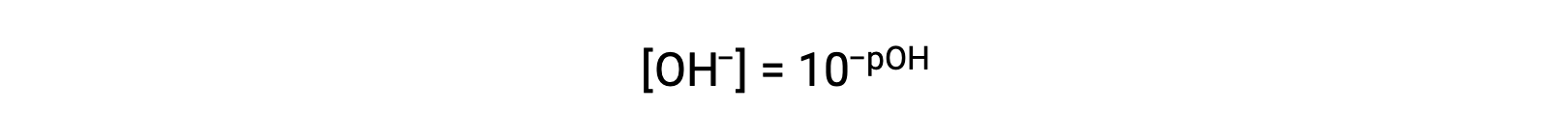
Por fim, a relação entre estas duas concentrações de iões expressas como funções p é facilmente derivada da expressão KW:
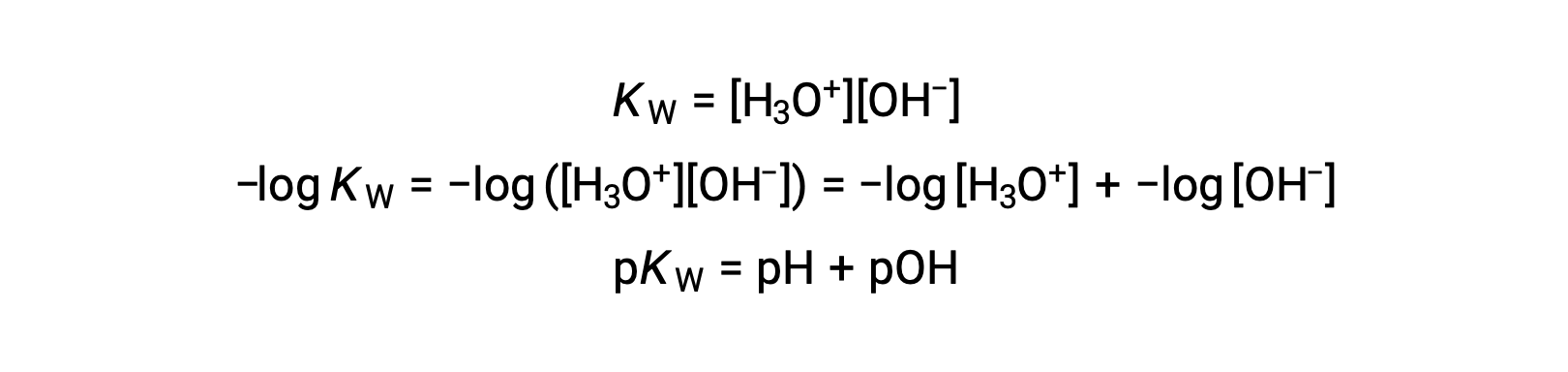
A 25 °C, o valor de KW é 1,0 × 10−14, pelo que:
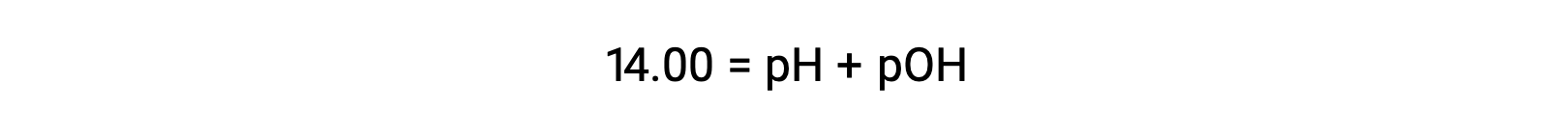
A molaridade de iões hidrónio em água pura (ou qualquer solução neutra) é de 1,0 × 10−7 M a 25 °C. O pH e o pOH de uma solução neutra a esta temperatura são, por conseguinte:
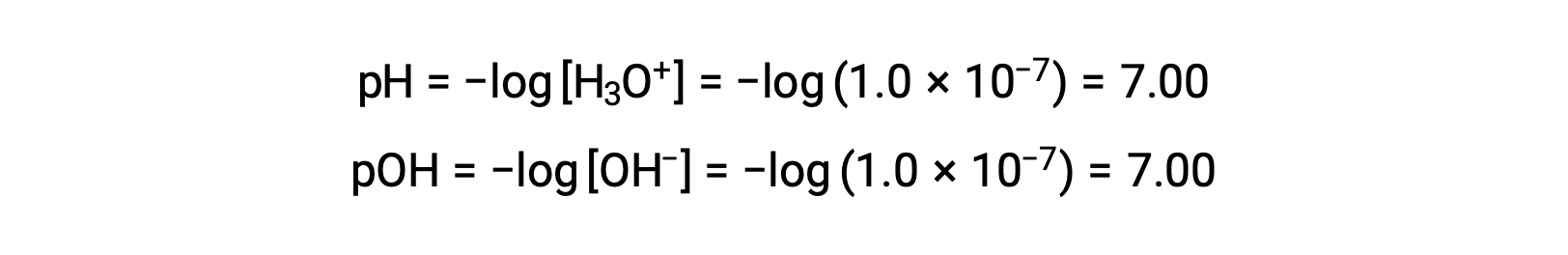
E assim, a essa temperatura, soluções ácidas são aquelas com molaridades de iões hidrónio maiores que 1,0 × 10−7 M e molaridades de iões hidróxido menores que 1,0 × 10−7 M (correspondendo a valores de pH menores que 7,00 e valores de pOH maiores que 7,00). Soluções básicas são aquelas com molaridades de iões hidrónio inferiores a 1,0 × 10−7 M e molaridades de iões hidróxido superiores a 1,0 × 10−7 M (correspondendo a valores de pH superiores a 7,00 e valores de pOH inferiores a 7,00).
Como a constante de autoionização KW é dependente da temperatura, essas correlações entre os valores de pH e os adjetivos ácido/neutro/básico serão diferentes a temperaturas diferentes de 25 °C. Por exemplo, a molaridade de hidrónio da água pura a 80°C é de 4,9 × 10−7 M, o que corresponde a valores de pH e pOH de:

A essa temperatura, as soluções neutras apresentam pH = pOH = 6,31, as soluções ácidas apresentam pH menor que 6,31 e pOH maior que 6,31, enquanto que as soluções básicas apresentam pH maior que 6,31 e pOH menor que 6,31. Esta distinção pode ser importante ao estudar certos processos que ocorrem a outras temperaturas, tais como reações enzimáticas em organismos de sangue quente a uma temperatura de cerca de 36 – 40 °C. Salvo indicação em contrário, presume-se que as referências aos valores de pH são as de 25 °C.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.2: pH and pOH.
Suggested Reading
- van Lubeck, Henk. "Why not replace pH and pOH by just one real acidity grade, AG?." Journal of Chemical Education 76, no. 7 (1999): 892. https://pubs.acs.org/doi/pdf/10.1021/ed076p892
