20.9:
نظرية المجال البلوري - المجمعات الرباعية السطوح والمربعة المستوية
20.9:
نظرية المجال البلوري - المجمعات الرباعية السطوح والمربعة المستوية
المجمعات الرباعية السطوح
تنطبق نظرية المجال البلوري (CFT) على الجزيئات في الأشكال الهندسية بخلاف ثماني السطوح. في المجمعات الثمانية السطوح، فإن فصوص dx2−y2 ومدارات dz2 تشير مباشرة إلى الروابط. بالنسبة للمجمعات رباعية السطوح، تظل المدارات d في مكانها، ولكن مع وجود أربعة روابط ترابطية فقط تقع بين المحاور. لا يشير أي من المدارات مباشرة إلى روابط رباعية السطوح. ومع ذلك، فإن مدارات dx2−y2 and dz2 (على طول المحاور الديكارتية) تتداخل مع الروابط الأقل من مدارات dxy, dxz, and dyz. عن طريق القياس مع مخطط ثماني السطوح، يمكن التنبؤ بمخطط الطاقة لمدارات d في مجال بلوري رباعي السطوح كما هو موضح في الشكل 1. ولتجنب الارتباك، يمكن التنبؤ بالمخطط الثماني السطوح eg تصبح المجموعة مجموعة رباعي سطوح e ، وتصبح مجموعة ثماني السطوح t2g مجموعة t2 .
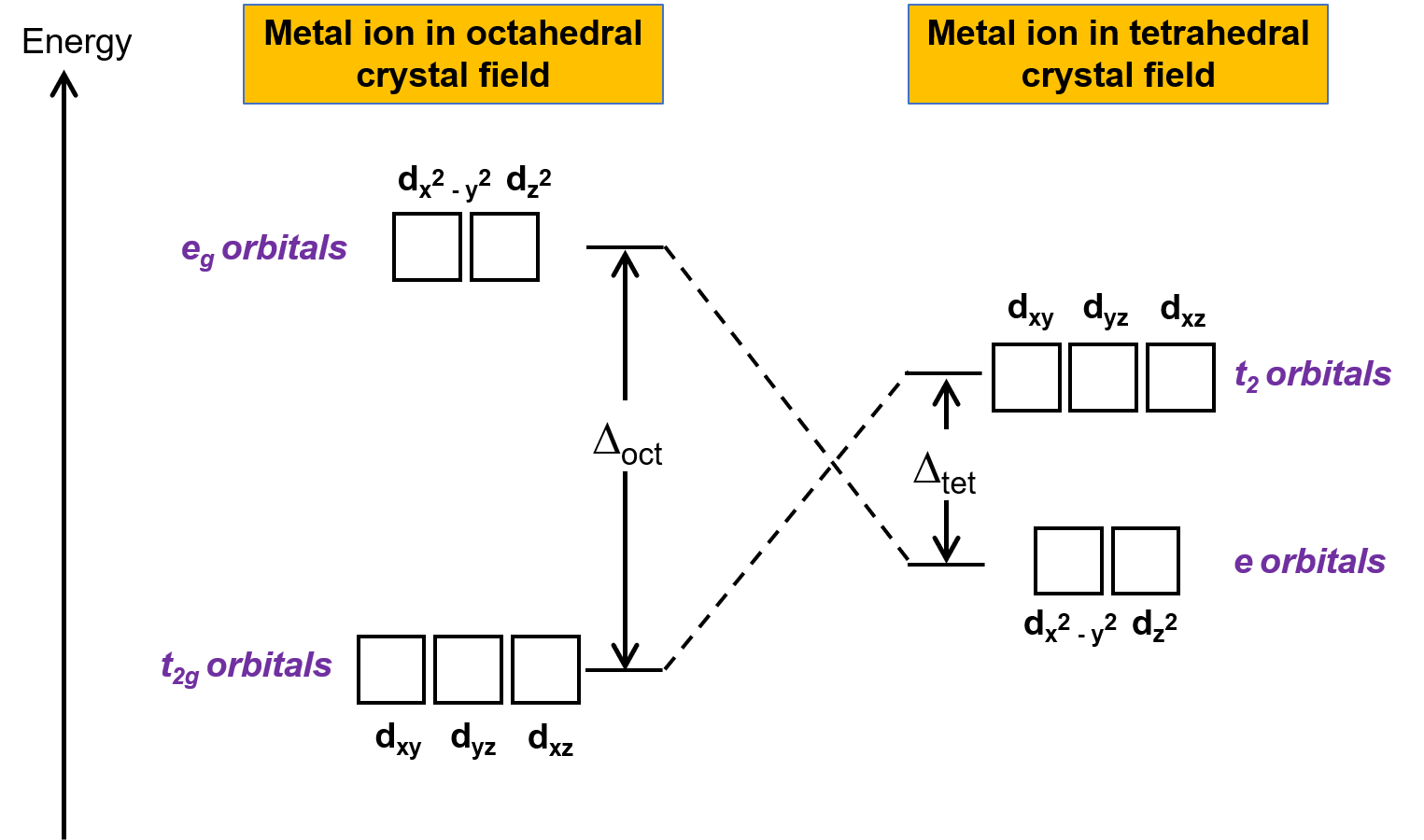
الشكل 1. انقسام المدارات d لأيون المعدن تحت الحقول البلورية ثماني السطوح ورباعية السطوح. بالمقارنة مع المجال البلوري ثماني السطوح، فإن نمط الانقسام في المجال البلوري رباعي السطوح مقلوب. تعد طاقة تقسيم المجال البلوري لمجمع ثماني السطوح، أو Δأوكت، أكبر من طاقة تقسيم المجال البلوري لمركب رباعي السطوح، Δتيت .
نظرًا لأن نظرية المجال البلوري CFT تعتمد على التنافر الإلكتروستاتيكي، فإن المدارات الأقرب إلى الروابط سوف تتزعزع وترتفع في الطاقة بالنسبة لمجموعة المدارات الأخرى. يكون الانقسام أقل من معقدات الثمانية السطوح لأن التداخل أقل، وبالتالي فإن طاقة تقسيم المجال البلوري، أو Δتيت عادة ما تكون صغيرة.
مجمعات مستوية مربعة
الهندسة الشائعة الأخرى هي الشكل المستوي المربع. من الممكن اعتبار هندسة مستوية مربعة كهيكل ثماني السطوح مع إزالة زوج من الروابط ترانس. من المفترض أن تكون الروابط التي تمت إزالتها في المحور z. يغير هذا توزيع مدارات d، حيث تصبح المدارات الموجودة على أو بالقرب من z-محور أكثر استقرارًا، وتلك الموجودة على أو بالقرب من x- أو y-محور أقل استقرارًا. ينتج عن هذا الثماني السطوح t2g ومجموعات eg تعطي نمط تقسيم أكثر تعقيدًا (الشكل 2).
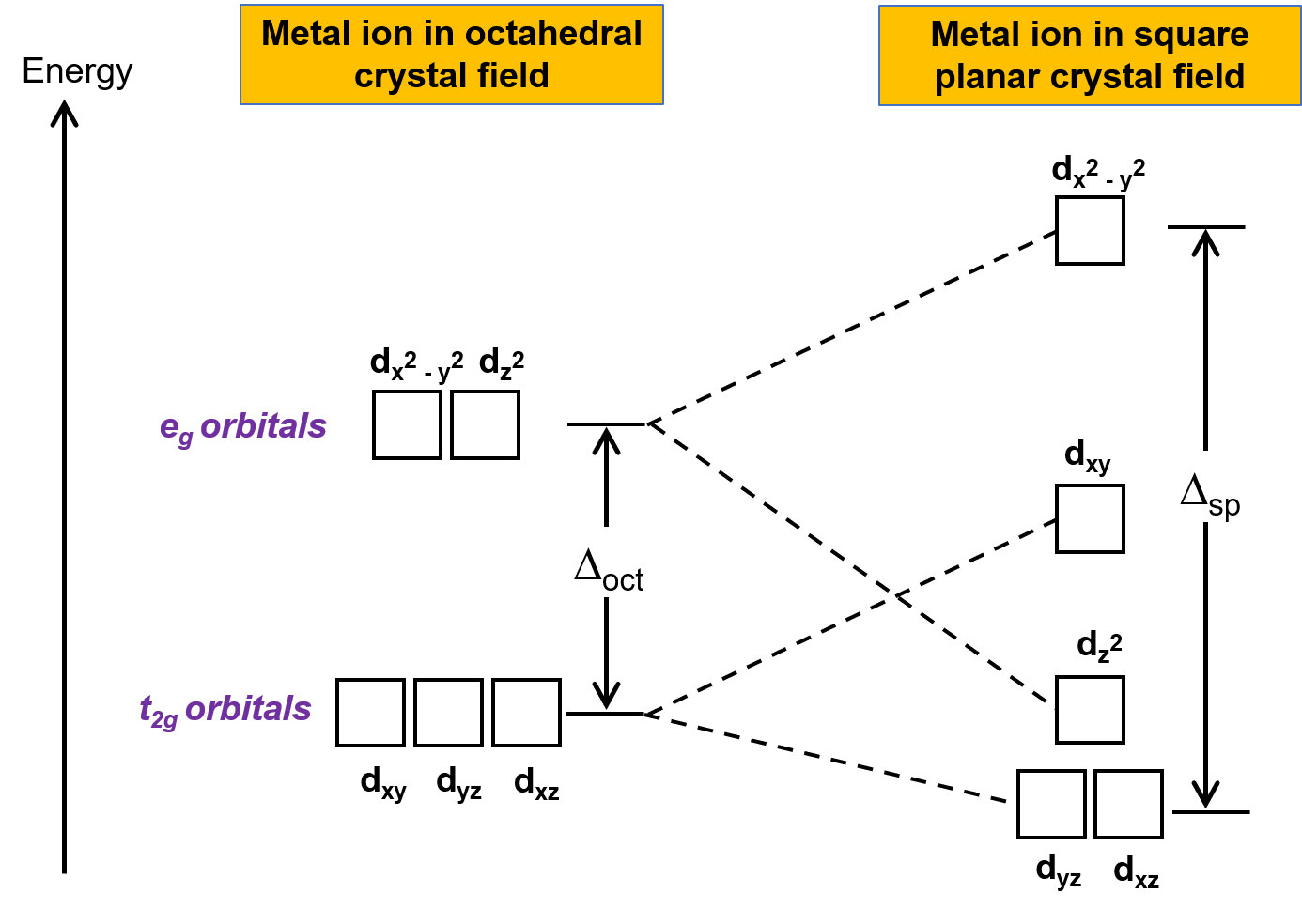
الشكل 2. تقسيم مجموعة t2g و مجموعة eg من المدارات في حقل بلوري مربع مستو. طاقة فصل المجال البلوري للمجمعات المستوية المربعة، أو Δsp، أكبر من Δoct.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
