20.9:
Kristal Alan Teorisi - Tetrahedral ve Kare Düzlemsel Kompleksler
20.9:
Kristal Alan Teorisi - Tetrahedral ve Kare Düzlemsel Kompleksler
Tetrahedral Kompleksler
Kristal alan teorisi (CFT), oktahedral dışındaki geometrilerdeki moleküller için geçerlidir. Oktahedral komplekslerde, dx2−y2 ve dz2 orbitallerinin lobları doğrudan ligandlara işaret eder. Tetrahedral kompleksler için, d orbitalleri yerinde kalır, ancak eksenler arasında sadece dört ligand bulunur. Orbitallerin hiçbiri doğrudan tetrahedral ligandlara işaret etmez. Bununla birlikte, dx2−y2 ve dz2 orbitalleri (Kartezyen eksenler boyunca) dxy, dxz ve dyz orbitallerinden daha az ligandlarla örtüşür. Oktahedral duruma benzer şekilde, bir tetrahedral kristal alanındaki d orbitalleri için enerji diyagramı, Şekil 1’de gösterildiği gibi tahmin edilebilir. Karışıklığı önlemek için, oktahedral eg seti bir tetrahedral e seti haline gelir ve oktahedral t2g seti bir t2 seti haline gelir.
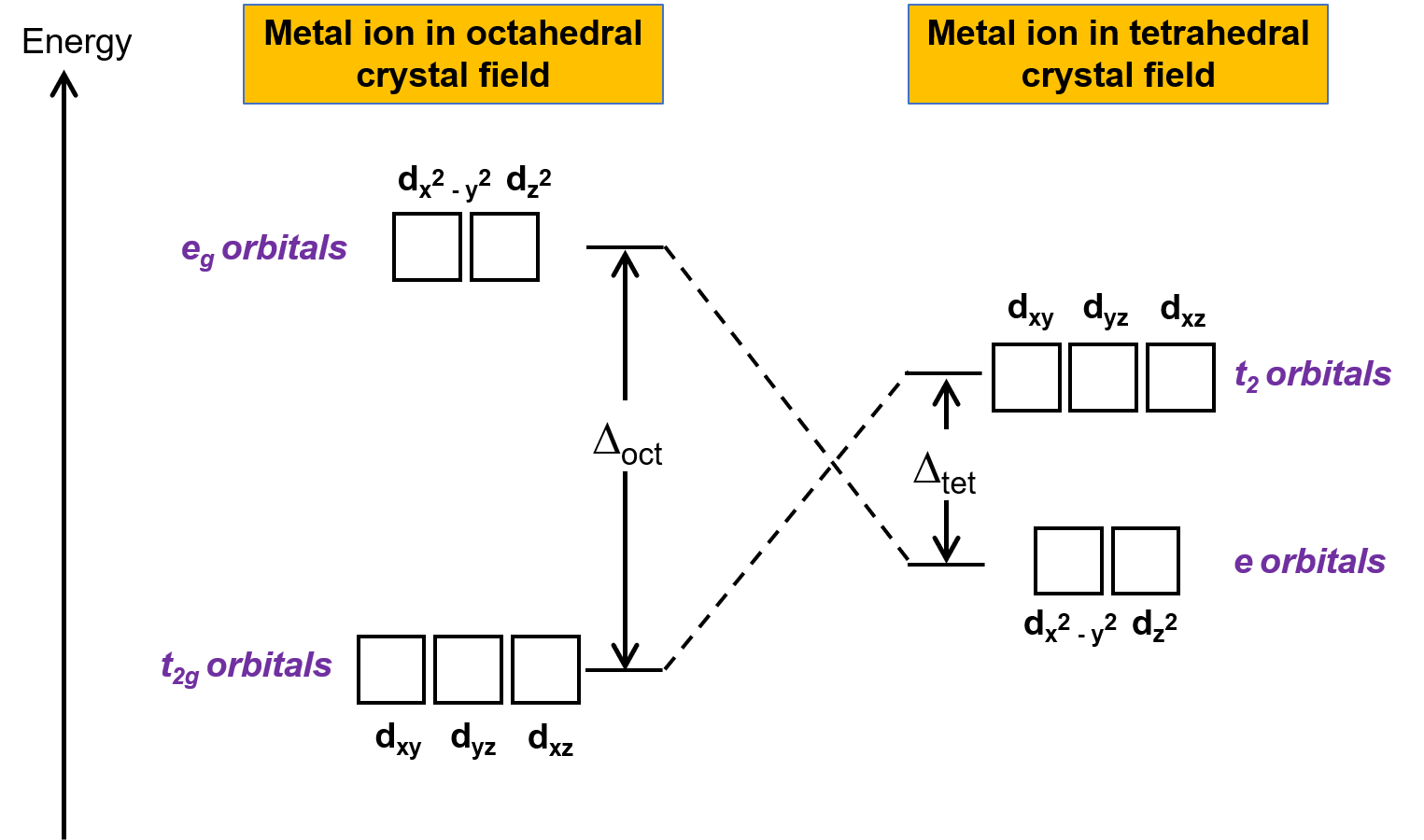
Şekil 1. Metal iyonunun d orbitallerinin oktahedral ve tetrahedral kristal alanları altında bölünmesi. Oktahedral kristal alanına kıyasla, tetrahedral kristal alanındaki bölme deseni ters çevrilmiştir. Oktahedral kompleksin kristal alan bölme enerjisi Δoct, tetrahedral kompleksin kristal alan bölme enerjisinden Δtet daha büyüktür.
CFT elektrostatik itmeye dayandığından, ligandlara daha yakın olan orbitaller dengesizleştirilecek ve diğer orbital kümesine göre enerjide yükselecektir. Bölünme, oktahedral komplekslerden daha azdır, çünkü örtüşme daha azdır, bu nedenle kristal alan bölme enerjisi Δtet , genellikle küçüktür.
Kare Düzlemsel Kompleksler
Diğer yaygın geometri kare düzlemseldir. Bir kare düzlemsel geometriyi, bir çift çıkarılmış trans ligand içeren bir oktahedral yapı olarak düşünmek mümkündür. Çıkarılan ligandların z ekseni üzerinde olduğu varsayılmaktadır. Bu, z eksenindeki veya yakınındaki orbitallerin daha kararlı hale gelmesi ve x- veya y eksenlerindeki veya yakınındaki orbitallerin daha az kararlı hale gelmesi nedeniyle d orbitallerinin dağılımını değiştirir. Bu, oktahedral t2g ve eg kümelerinin bölünmesine neden olur ve daha karmaşık bir bölme deseni verir (Şekil 2).
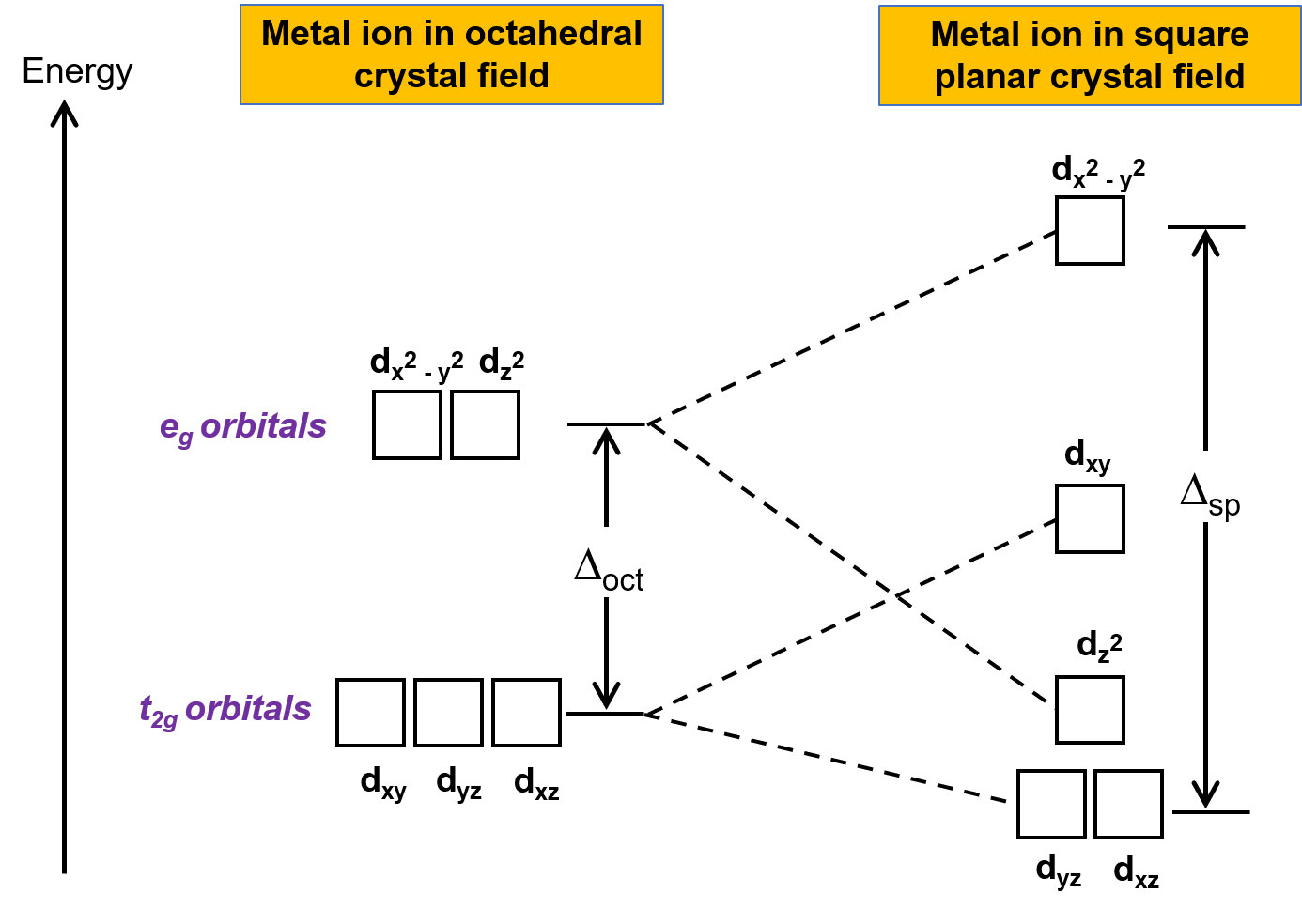
Şekil 2. t2g kümesinin ve eg kümesinin kare düzlemsel bir kristal alanda bölünmesi. Kare düzlemsel komplekslerin veya Δsp‘nin kristal alan bölme enerjisi Δoct‘den daha büyüktür.
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Section 19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
