20.9:
Teoria do Campo Cristalino - Complexos Tetraédricos e Quadrados Planares
20.9:
Teoria do Campo Cristalino - Complexos Tetraédricos e Quadrados Planares
Complexos Tetraédricos
A teoria do campo cristalino (TCC) é aplicável a moléculas em geometrias não octaédricas. Em complexos octaédricos, os lóbulos das orbitais dx2−y2 e dz2 apontam diretamente para os ligandos. Para complexos tetraédricos, as orbitais d permanecem no lugar, mas com apenas quatro ligandos localizados entre os eixos. Nenhuma das orbitais aponta diretamente para os ligandos tetraédricos. No entanto, as orbitais dx2−y2 e dz2 (ao longo dos eixos Cartesianos) sobrepõem-se menos com os ligandos do que as orbitais dxy, dxz, e dyz. Por analogia com o caso octaédrico, o diagrama de energia para as orbitais d em um campo cristalino tetraédrico pode ser previsto como mostrado na Figura 1. Para evitar confusão, o conjunto octaédrico eg torna-se um conjunto tetraédrico e, e o conjunto octaédrico t2g torna-se um conjunto t2.
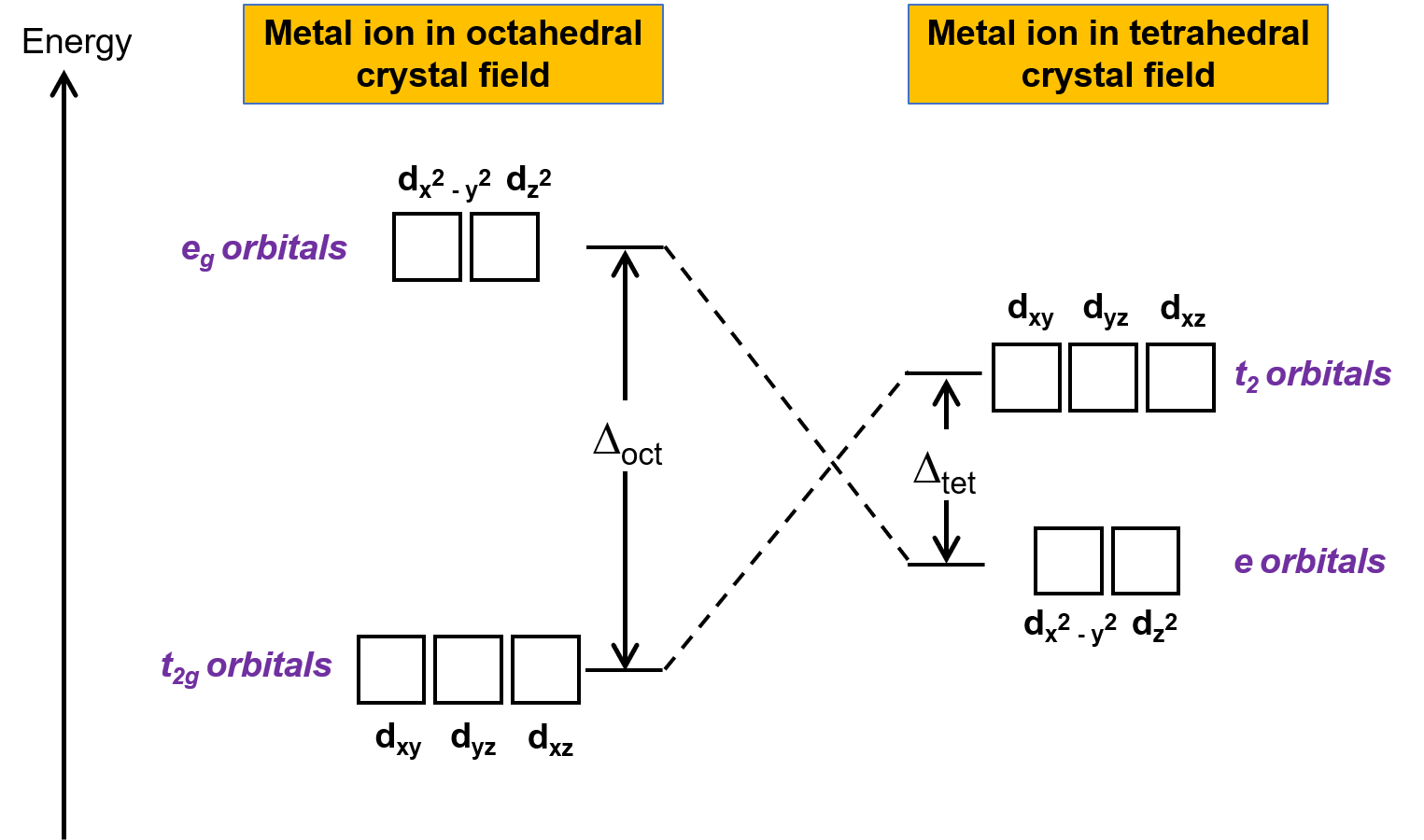
Figura 1. Divisão das orbitais d do ião de metal sob campos cristalinos octaédricos e tetraédricos. Em comparação com o campo cristalino octaédrico, o padrão de divisão no campo cristalino tetraédrico é invertido. A energia da divisão de campo cristalino do complexo octaédrico, ou Δoct, é maior do que a energia de divisão de campo cristalino do complexo tetraédrico, Δtet .
Como a TCC é baseada na repulsão eletrostática, as orbitais mais próximas dos ligandos serão desestabilizadas e elevadas em energia em relação ao outro conjunto de orbitais. A divisão é menor que para complexos octaédricos porque a sobreposição é menor, então a energia de divisão de campo cristalino, ou Δtet é geralmente pequena.
Complexos Quadrados Planos
A outra geometria comum é a quadrada plana. É possível considerar uma geometria quadrada plana como uma estrutura octaédrica com um par de ligandos trans removidos. Presume-se que os ligandos removidos estejam no eixo z. Isto altera a distribuição das orbitais d, à medida que as orbitais no eixo z ou perto dele se tornam mais estáveis, e as nos eixos x ou y ou perto deles se tornam menos estáveis. Isto resulta na divisão dos conjuntos octaédricos t2g e eg e dá um padrão de divisão mais complicado (Figura 2).
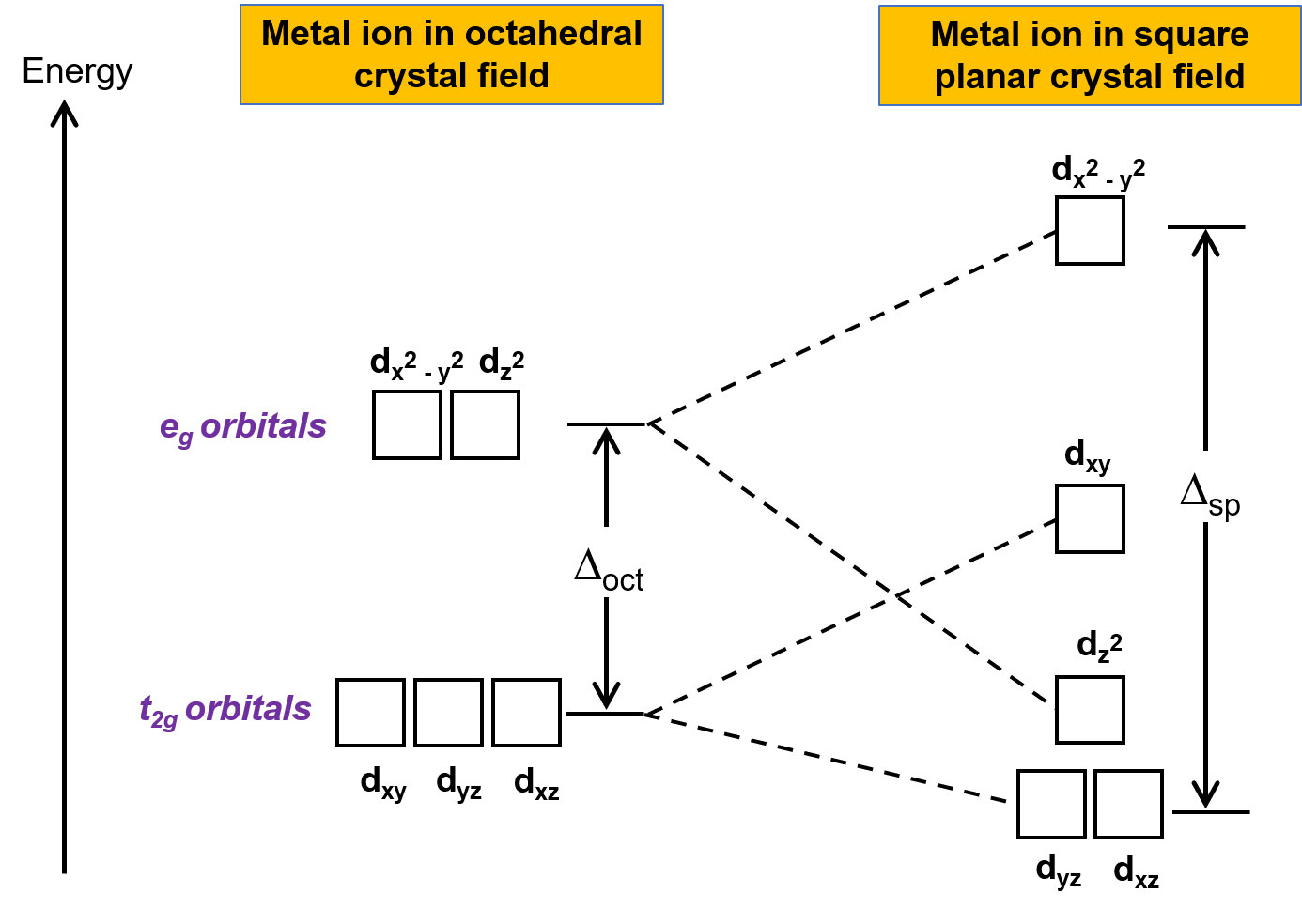
Figura 2. Divisão do conjunto t2g e do conjunto eg de orbitais em um campo cristalino quadrado plano. A energia de divisão de campo cristalino de complexos quadrados planos, ou Δsp, é maior que Δoct.
Este texto é adaptado de Openstax, Chemistry 2e, Section 19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
