ЦГМФ-применимо Метод расширения для агрегатов человека нервных стволовых и предшественники клеток, полученных из плюрипотентных стволовых клеток или плода ткани головного мозга
Summary
Этот протокол описан новый механический способ измельчения, что позволяет расширение сферических нервных стволовых и клеток-предшественников агрегатов без диссоциации к суспензии отдельных клеток. Поддержание клеток / клеток контакт позволяет быстро и стабильный рост на протяжении более 40 пассажей.
Abstract
Методика расширения ячейки, чтобы накопить большое количество клеток из одного образца для научных экспериментов и клинических испытаний значительно обогатило бы стволовых клеток сообщество. Многие методы текущие расширения являются трудоемкими и дорогостоящими, и тех, которые связаны полной диссоциации может вызвать несколько стволовые и клеток-предшественников типы пройти дифференциации или рано старение. Для преодоления этих проблем, мы разработали автоматизированную механическую метод пассажей называют "рубить", что является простым и недорогим. Этот метод позволяет избежать химической или ферментативной диссоциации на отдельные клетки и вместо этого позволяет масштабного расширения взвешенных, сфероидных культур, которые поддерживают постоянный контакт клеток / клеток. Способ измельчения имеет в основном были использованы для мозга плода, полученных нейронных клеток-предшественников или нейросферах, и недавно был опубликован для использования с нервных стволовых клеток, полученных из эмбриональных и индуцированных плюрипотентных стволовых клеток. Процедура увлеченностиэс посева нейросферы на культуре ткани чашки Петри, а затем передавая резкий, стерильный нож через клетки эффективно автоматизировать утомительный процесс вручную механически диссоциации каждую сферу. Приостановка клеток в культуре создает благоприятную соотношении между площадью поверхности к объему; как более 500000 клетки могут быть выращены в пределах одного нейросфера менее 0,5 мм в диаметре. В одном T175 колбу, более 50 миллионов клетки могут расти в суспензионных культур по сравнению с только 15 миллионов в прикрепленных культур. Важно отметить, что рубить процедура использовалась в соответствии с действующим надлежащей производственной практики (цГМФ), что позволяет массовое производство количество продуктов клинико-класса клеток.
Introduction
Существует долгая история расширения грызунов нервные стволовые клетки в культуре или как монослоя 1-3 или совокупных нейросферы 4-7. Кроме того, человека нервные клетки-предшественники (hNPCs), выделенные из различных регионов развивающегося центральной нервной системы 8-17 были расширены в пробирке. Эти клетки являются би-мощным, способны дифференцироваться в обоих астроцитов и нейронов и были очень полезный инструмент в изучении развития нервной системы 18,19 и болезни механизм 20,21. hNPCs также пересадить в различных животных моделях заболеваний центральной нервной системы с различными уровнями интеграции, выживание и функциональных эффектов 22-24.
Традиционно, грызун или фетальных НПС человека подвергаются воздействию факторов роста – часто эпидермальный фактор роста (EGF) и / или фактор роста фибробластов-2 (FGF-2) 25-28 – и как липкое, так и 29 три-Мерные системы сферические, как правило, пассировать с помощью ферментативной диссоциации в одной клеточной суспензии 30-34. Стандартный метод расширить клетки для исследований или клинического применения является как приверженец монослоя из-за легкого манипулирования. Тем не менее, мы показали, что пассажи однослойные и нейросфера hNPCs с ферментативных или химических растворов привело в начале старения 35. Кроме того, ферментативной диссоциации может привести к повышению уровня дифференцировки и кариотипа аномалий на основе данных продемонстрированы с эмбриональными стволовыми клетками 36-38. Хотя стандартный метод пассажей hNPCs выпустил текущий надлежащей производственной практики (цГМФ) класса продуктов, которые прошли в фазе 1 клинических испытаний (стволовые клетки Inc, Neuralstem Инк), метод разрешается только несколько раундов амплификации клетки, ограничивая банковские потенциал.
Очевидно, что крупные научно-исследовательские эксперименты и будущие клинические испытания могут воспользоваться возможностьюраспространяются клеток в натуральном и с задержкой старения, способствующих росту масштабную и сотовый банкинга. Чтобы удовлетворить эту потребность, мы разработали новый и автоматизированный способ механически пассажей неповрежденных нейросферы по "рубить" их в малых кластеров поддерживать клетки к клетке контакт. Этот метод значительно увеличить их срок службы 39 и суспензионной культуры позволяет более эффективно использовать пространство инкубатора по сравнению с однослойных культур, как видно с альтернативным методом 3D биореактор культуры 40. При условии, протокол измельчения позволяет для производства крупномасштабных банков от одного плода образца больше, чем канал 10, маловероятного подвиг, используя стандартные методы пассажей. Хотя этот метод для пассажи hNPCs является нетрадиционным, она растет в популярности, и был недавно, опубликованные с другими типами клеток, таких как нервные стволовые клетки, полученные из человеческих эмбриональных и индуцированных плюрипотентных стволовых клеток, что позволяет крупномасштабных расширение для различных приложений, включая возможность в версииИтро моделирование болезнь 41-46. Важно отметить, что цГМФ-класс hNPC банк клеток уже производится с помощью метода разделочную, демонстрируя, что метод может быть применен к будущим клинического применения.
Protocol
Representative Results
Discussion
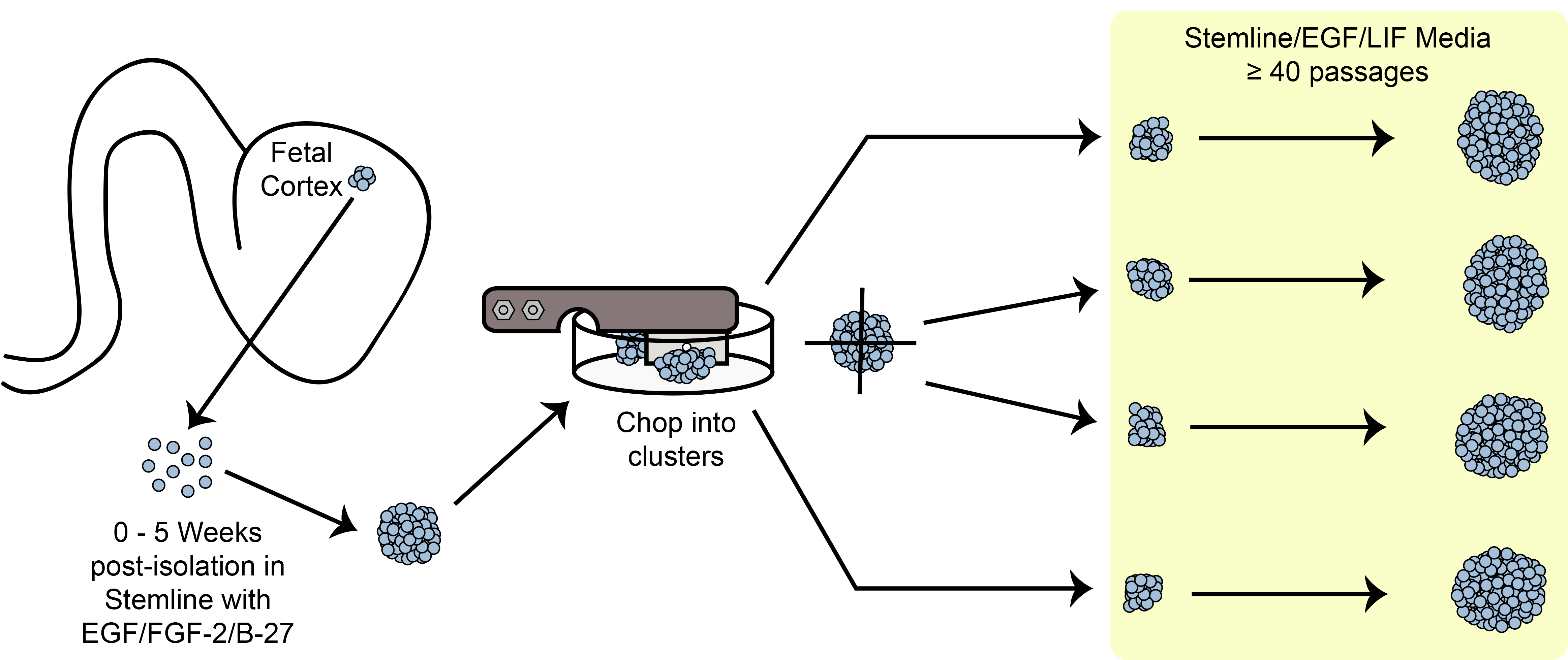
Рисунок 6. Разделочные Схематическое. Расширение клетки сфероид стволовых / предшественники в культуре с использованием метода механической разделочную.
Критические шаги </p…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим доктора Soshana Свендсен для критического анализа и редактирования этого отчета. Эта работа была способствовало по NIH / NINDS 1U24NS078370-01 и CIRM DR2A-05320.
Materials
| Beaker, 50 mL | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 mL inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 mL | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 mL | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 mL | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 mL | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 mL | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 mL | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern – Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37°C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1 – 10 μL | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100 – 1000 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2 – 20 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20 – 200 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μL | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1000 μL | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μL | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μL | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 mL | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 mL | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 mL | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 mL | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1X) | Life Technologies | 12563-011 |
References
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neuroscience. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. -. IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson’s disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 .
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. i. P. S. C. Induced pluripotent stem cells from patients with Huntington’s disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).

