وهناك طريقة توسيع المركب-ينطبق على مجاميع من العصبية الجذعية البشرية والخلايا المشتقة من الخلايا السلف الجذعية المحفزة أو الجنين أنسجة المخ
Summary
يصف هذا البروتوكول طريقة تقطيع الميكانيكية الرواية التي تسمح للتوسع كروية العصبية الجذعية والخلية السلف المجاميع دون التفكك إلى تعليق خلية واحدة. الحفاظ على الاتصال خلية / خلية يسمح النمو السريع والمستقر لأكثر من 40 المقاطع.
Abstract
ومن شأن التوسع تقنية خلية لجمع أعداد كبيرة من الخلايا من عينة واحدة لتجارب البحوث والتجارب السريرية تستفيد كثيرا المجتمع الخلايا الجذعية. العديد من وسائل التوسع الحالية هي شاقة ومكلفة، وتلك التي تنطوي على التفكك الكامل قد يسبب العديد من أنواع الخلايا الجذعية والسلف للخضوع لتمايز أو الشيخوخة المبكرة. للتغلب على هذه المشاكل، وقد وضعنا طريقة الركض الميكانيكية الآلية المشار إليها باسم "تقطيع" التي هي بسيطة وغير مكلفة. هذا الأسلوب يتجنب التفكك الكيميائية أو الإنزيمية في الخلايا واحد ويسمح لتوسيع نطاق واسع من علق، كروي الثقافات التي تحافظ على اتصال مستمر خلية / خلية بدلا من ذلك. وقد استخدمت في المقام الأول طريقة تقطيع للخلايا الجنينية المستمدة من الدماغ العصبية السلف أو neurospheres، ومؤخرا تم نشرها للاستخدام مع الخلايا الجذعية العصبية المشتقة من الخلايا الجذعية المحفزة الجنينية والتي يسببها. ويضم هذا الإجراءوفاق بذر neurospheres على طبق بتري زراعة الأنسجة ويمر بعد ذلك حاد، شفرة معقمة من خلال أتمتة الخلايا بشكل فعال في عملية شاقة من الانفصال يدويا ميكانيكيا كل مجال. تعليق الخلايا في الثقافة يوفر سطح نسبة مواتية المنطقة إلى حجم؛ كما أكثر من 500،000 الخلايا يمكن زراعتها داخل neurosphere واحد من أقل من 0.5 ملم في القطر. في واحدة قارورة T175، يمكن أن أكثر من 50 مليون تنمو الخلايا في الثقافات تعليق مقارنة ب 15 مليون فقط في الثقافات ملتصقة. الأهم من ذلك، وقد استخدم هذا الإجراء في إطار تقطيع الممارسات التصنيعية الجيدة الحالية (المركب)، والسماح إنتاج كمية الشامل من المنتجات الخلية السريرية الصف.
Introduction
هناك تاريخ طويل من توسيع الخلايا الجذعية العصبية في الثقافة القوارض إما أحادي الطبقة 1-3 أو 4-7 neurospheres الكلي. بالإضافة إلى ذلك، تم توسيع الخلايا الاصلية العصبية البشرية (hNPCs) المعزولة من مناطق مختلفة من الجهاز العصبي المركزي النامية في المختبر 8-17. هذه الخلايا هي ثنائية قوية، وقادرة على التفريق في كل من الخلايا النجمية والخلايا العصبية، وكانت أداة مفيدة جدا في دراسة التنمية العصبية وأمراض 18،19 20،21 آلية. كما تم زرع hNPCs في العديد من نماذج حيوانية مختلفة من أمراض الجهاز العصبي المركزي مع مستويات متفاوتة من التكامل والبقاء والآثار الفنية 22-24.
تقليديا، يتعرض الجنين القوارض أو الشخصيات المستمدة من الإنسان إلى عوامل النمو – عامل نمو البشرة في كثير من الأحيان (صندوق تعديل العولمة الأوروبي) و / أو عامل نمو الخلايا الليفية-2 (FGF-2) 25-28 – وكلاهما تمسكا 29 وثلاثةعادة و passaged أنظمة كروي الأبعاد باستخدام تفارق الأنزيمية في تعليق خلية واحدة 30-34. الطريقة القياسية لتوسيع الخلايا لأغراض البحث أو استخدام السريري هو بمثابة أحادي الطبقة ملتصقة بسبب التلاعب سهلة. ومع ذلك، ونحن قد أظهرت أن أحادي الطبقة الركض وneurosphere hNPCs مع الأنزيمية أو المحاليل الكيميائية أدى إلى الشيخوخة المبكرة 35. بالإضافة إلى ذلك، قد يؤدي تفارق الأنزيمية في زيادة مستويات التمايز والنمط النووي شذوذ استنادا إلى بيانات أظهرت مع الخلايا الجذعية الجنينية 36-38. على الرغم من أن أسلوب قياسي للhNPCs الركض وقد أنتجت ممارسة التصنيع الجيدة الحالية (المركب) منتجات الصف التي مرت في مرحلة التجارب السريرية 1 (الخلايا الجذعية شركة، Neuralstem شركة)، سمحت الطريقة فقط بضع جولات من التضخيم الخلية، مما يحد من المصرفية المحتملة.
بشكل واضح، يمكن أن التجارب البحثية الكبيرة والتجارب السريرية في المستقبل الاستفادة من القدرة علىنشر الخلايا بكميات كبيرة ومع تأخر الشيخوخة للسماح نمو واسع النطاق والمصرفية الخلية. لتلبية هذه الحاجة، قمنا بتطوير الرواية وسيلة مؤتمتة من neurospheres سليمة الركض ميكانيكيا بواسطة "تقطيع" لهم في مجموعات صغيرة للحفاظ على اتصال الخلية الى خلية. هذه الطريقة زيادة كبيرة تسمح عمر 39 وتعليق ثقافتهم استخدام أكثر فعالية من مساحة الحاضنة مقارنة الثقافات أحادي الطبقة، كما رأينا مع بديل 3D طريقة الثقافة مفاعل حيوي 40. بروتوكول تقطيع قدمت يسمح لإنتاج البنوك على نطاق واسع من عينة واحدة الجنين أكبر من مرور 10، إنجازا غير المرجح باستخدام أساليب الركض القياسية. في حين أن هذا الأسلوب لhNPCs الركض هو غير تقليدية، هو في تزايد شعبية وتم مؤخرا، نشرت مع أنواع الخلايا الأخرى مثل الخلايا الجذعية العصبية المشتقة من الأجنة البشرية والخلايا الجذعية المحفزة، مما يتيح توسيع نطاق واسع لمختلف التطبيقات بما في ذلك في الخامسitro النمذجة المرض 41-46. الأهم من ذلك، وقد تم بالفعل إنتاج المركب الصف hNPC بنك الخلايا مع أسلوب التقطيع، مما يدل على أن هذه التقنية يمكن تطبيقها تجاه التطبيقات السريرية في المستقبل.
Protocol
Representative Results
Discussion
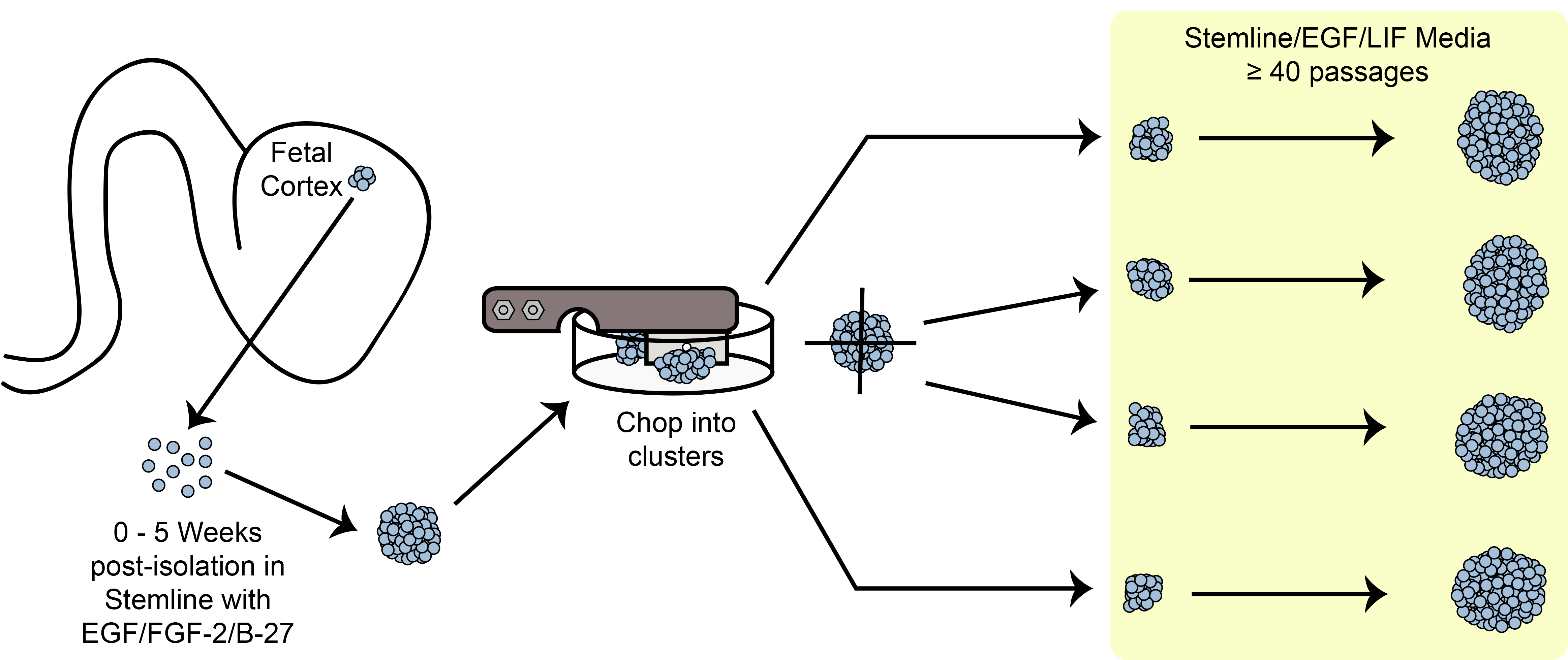
الرقم 6. تقطيع تخطيطي. توسيع الخلايا الجذعية كروي / السلف في الثقافة باستخدام طريقة تقطيع الميكانيكية.
خطوات حاسمة
<p class="jove_content" style=";…Disclosures
The authors have nothing to disclose.
Acknowledgements
نشكر الدكتور Soshana سفندسن لمراجعة نقدية وتحرير هذا التقرير. وقد ساهم هذا العمل من قبل المعاهد الوطنية للصحة / NINDS 1U24NS078370-01 وCIRM DR2A-05320.
Materials
| Beaker, 50 mL | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 mL inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 mL | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 mL | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 mL | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 mL | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 mL | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 mL | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern – Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37°C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1 – 10 μL | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100 – 1000 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2 – 20 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20 – 200 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μL | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1000 μL | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μL | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μL | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 mL | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 mL | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 mL | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 mL | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1X) | Life Technologies | 12563-011 |
References
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neuroscience. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. -. IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson’s disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 .
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. i. P. S. C. Induced pluripotent stem cells from patients with Huntington’s disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).

