Une méthode d'extension cGMP applicable pour les agrégats de neurones humains des cellules souches et progénitrices dérivées de cellules souches pluripotentes ou fœtale tissu cérébral
Summary
Ce protocole décrit un procédé de découpage mécanique nouvelle qui permet l'expansion de souches et de cellules progénitrices neurales agrégats sphériques sans dissociation d'une suspension cellulaire unique. Maintenir le contact cellule / cellule permet une croissance rapide et stable depuis plus de 40 passages.
Abstract
Une technique d'expansion cellulaire d'amasser un grand nombre de cellules à partir d'un seul échantillon pour des expériences de recherche et d'essais cliniques bénéficierait grandement de la communauté sur les cellules souches. De nombreuses méthodes d'expansion actuels sont laborieuses et coûteuses, et ceux qui impliquent la dissociation complète peuvent provoquer plusieurs types de souches et de cellules progénitrices à subir une différenciation ou la sénescence précoce. Pour surmonter ces problèmes, nous avons mis au point une méthode de repiquage mécanique automatisé dénommé "hachage" qui est simple et peu coûteux. Cette technique évite la dissociation chimique ou enzymatique dans les cellules simples et place permet l'expansion à grande échelle de suspension, cultures sphéroïde qui maintiennent le contact cellule / cellule constante. Le procédé de hachage a été utilisée principalement pour les cellules cérébrales fœtales dérivé progénitrices neurales ou des neurosphères, et a été récemment publiée pour une utilisation avec des cellules souches neurales dérivées de cellules souches embryonnaires pluripotentes et induits. La procédure impliquantes semis neurosphères sur une culture de tissu boîte de Pétri, puis en passant une lame tranchante, stérile à travers les cellules automatiser efficacement le processus fastidieux de la main dissocier mécaniquement chaque sphère. Mise en suspension des cellules en culture fournit une surface rapport favorable surface sur volume; que plus de 500 000 cellules peuvent être cultivées dans un seul neurosphères de moins de 0,5 mm de diamètre. Dans un flacon T175, plus de 50 millions de cellules peuvent se développer dans des cultures en suspension contre seulement 15 millions en cultures adhérentes. Surtout, la procédure de hachage a été utilisé dans les bonnes pratiques de fabrication (cGMP), permettant la production de la quantité de masse de produits de cellules de qualité clinique.
Introduction
Il ya une longue histoire de l'expansion des cellules souches neurales rongeurs en culture soit une monocouche 1-3 ou 4-7 neurosphères globales. En outre, les cellules progénitrices neurales humaines (hNPCs) isolés à partir de différentes régions du développement du système nerveux central 8-17 ont été élargies in vitro. Ces cellules sont bi-puissant, capable de se différencier en astrocytes et les neurones les deux et ont été un outil très utile pour étudier le développement neural 18,19 et 20,21 mécanisme maladie. hNPCs ont également été transplantées dans de nombreux modèles de la maladie du système nerveux central des animaux différents avec différents niveaux d'intégration, à la survie et les effets fonctionnels 22-24.
Traditionnellement, les rongeurs ou NPC foetales humaines dérivées sont exposés à des facteurs de croissance épidermique – souvent facteur de croissance (EGF) et / ou le facteur de croissance des fibroblastes-2 (FGF-2) et 25 à 28 – 29 à la fois adhérent et troisSystèmes de sphéroïdes dimensions sont généralement soumises à des passages en utilisant la dissociation enzymatique dans une suspension à cellule unique 30-34. La méthode standard pour développer des cellules pour la recherche ou l'utilisation clinique est comme une monocouche adhérente raison d'une manipulation facile. Cependant, nous avons montré que des passages monocouches et neurosphères hNPCs avec des solutions chimiques ou enzymatiques ont donné lieu à la sénescence précoce 35. En outre, la dissociation enzymatique peut entraîner une augmentation des niveaux de différenciation et des anomalies caryotypiques d'après les données démontré avec des cellules souches embryonnaires de 36 à 38. Bien que la méthode standard de hNPCs de passages a produit les bonnes pratiques de fabrication (BPF) des produits de qualité qui sont passés en phase 1 des essais cliniques (cellules souches Inc., Neuralstem Inc.), la méthode autorisée seulement quelques cycles d'amplification cellulaire, ce qui limite la potentiel bancaire.
De toute évidence, les grandes expériences de recherche et d'essais cliniques futurs pourraient bénéficier de la capacité depropager des cellules en vrac et à la sénescence retardée pour permettre la croissance à grande échelle et de banques de cellules. Pour répondre à ce besoin, nous avons développé une façon nouvelle et automatisé de neurosphères intactes mécaniquement passages par "couper" en petits groupes pour maintenir le contact de cellule à cellule. Ce procédé augmente considérablement leur durée de vie et la culture en suspension 39 permet une utilisation plus efficace de l'espace de l'incubateur par rapport aux cultures en monocouche, comme on le voit avec une méthode de culture 3D de bioréacteur alternatif 40. Le protocole permet de hachage prévu pour la production de banques à grande échelle d'un échantillon foetal supérieur passage 10, un exploit peu probable en utilisant des procédés standards de repiquage. Bien que cette méthode pour hNPCs de repiquage n'est pas conventionnelle, il est de plus en plus en popularité et a été récemment publié avec d'autres types tels que les cellules souches neurales dérivées de l'embryon humain et les cellules souches pluripotentes induites cellulaires, permettant l'expansion à grande échelle pour diverses applications, notamment dans vITRO modélisation de la maladie 41-46. Surtout, un hNPC banque de cellules cGMP de qualité a déjà été produit avec le procédé de hachage, ce qui démontre que la technique peut être appliquée à de futures applications cliniques.
Protocol
Representative Results
Discussion
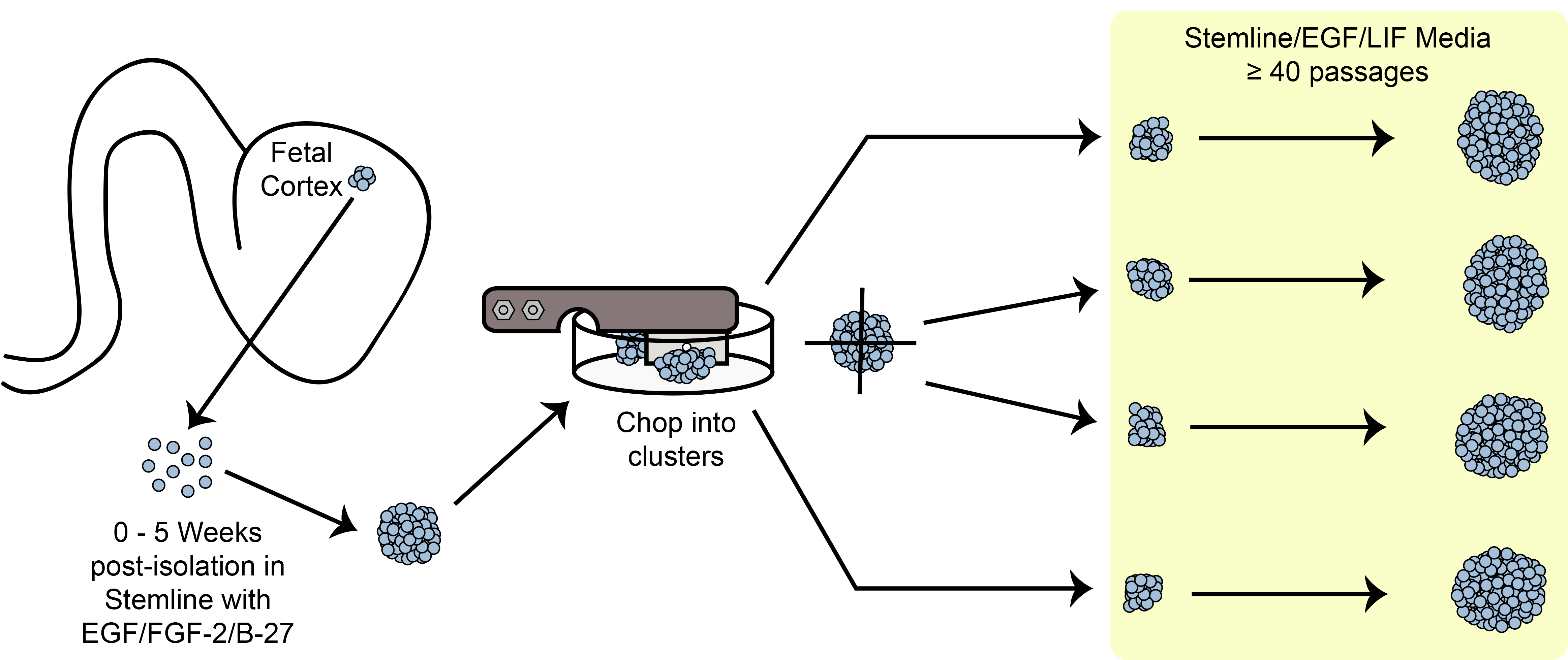
Figure 6. Schéma découper. L'expansion des cellules souches du sphéroïde / progénitrices en culture selon la méthode de découpage mécanique.
Étapes critiques
Un aperçu du paradigme de l'expansion de coupe est représentée sur la figure 6. HNPC taille de la sphè…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous remercions le Dr Soshana Svendsen à la critique et l'édition de ce rapport. Ce travail a été fourni par le NIH / NINDS 1U24NS078370-01 et le CIRM DR2A-05320.
Materials
| Beaker, 50 mL | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 mL inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 mL | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 mL | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 mL | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 mL | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 mL | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 mL | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern – Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37°C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1 – 10 μL | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100 – 1000 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2 – 20 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20 – 200 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μL | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1000 μL | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μL | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μL | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 mL | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 mL | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 mL | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 mL | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1X) | Life Technologies | 12563-011 |
References
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neuroscience. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. -. IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson’s disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 .
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. i. P. S. C. Induced pluripotent stem cells from patients with Huntington’s disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).

