使用静态器官培养研究腭融合的方法
Summary
腭发展研究是由腭裂,出生缺陷,它强行巨大的医疗负担,并可以留下持久的缺陷的发生率动机。我们在这里展示了一种技术,可用于研究参与腭发展和融合不同信号通路的培养腭。
Abstract
唇腭裂是最常见的所有出生缺陷。从骨髓间充质货架的次生腭形成覆盖着上皮细胞附着,形成中线上皮煤层(MES)。该理论认为MES细胞遵循上皮至间质转变(EMT),细胞凋亡和迁移,使稠腭1。在MES的完全解体是腭融合与周围间质细胞的最后一个基本阶段。我们提供味觉器官培养的方法。 在体外协议开发允许生物和分子过程的融合过程中的研究。这种技术的的应用有很多,包括评估响应外源化学试剂,监管和生长因子和特异性蛋白质的效果。腭器官培养具有许多优点,包括:在操作的开发使用体内研究认为是不可能的不同阶段。
Introduction
口面裂是最主要的颅面先天缺陷。另外,当以在考虑所有可能的颅面畸形,这些是在新生儿2第二最常见的出生异常。腭裂发生在约1在每700出生在美国(美国)每年,腭裂的发生率等于475所生的子女,每月兔唇或15个孩子,每个3天裂。世界各地的孩子大约有1%生每年展品某种形式的颅面畸形学的。
腭和唇的裂需要非常昂贵和复杂的过程与谁有这种异常的患者终生影响。估计费用为每一个病人口腔裂约为$ 10万个4。与唇腭裂患者的治疗需要一个团队的医生,包括颅面外科,耳鼻喉科,遗传学家,麻醉医师,言语语言病理学家,营养学家,正牙医生,prosthodontists,心理学家,神经外科医生,和眼科医生。
在腭,次级腭产生作为副产物配对,最初垂直增长和经受舌头的鼻背上述腭搁板标高。随着海拔的配对腭增长对(在小鼠E14.5 -E15和9周人)中线。内侧缘上皮细胞(MEE),涵盖了架子尖端附着形成中线上皮煤层。
这之后是上皮至间质转变和/或凋亡,以允许充质汇合。反对MEE的附着力是一个重要事件,其变更导致腭裂。然而,只有少数研究调查了腭5的初始粘合性。硬腭形式由分化的间充质细胞的成骨细胞。口感可以产生谱号的畸形发展吨口味有或没有唇部的参与。
腭器官培养技术被广泛应用于很多实验室在过去30年6,7了。
在这个协议中,我们详细描述腭解剖和静态器官培养的方法。一动不动器官培养的优点是,它允许腭融合。这种技术已经被成功地用于在我们的实验室对许多聚变和信令实验8,9。然而该技术的范围广阔,可以用于每当静态器官培养系统是必需的,包括响应外源性化学药剂的评价中,在不同的途径和特定蛋白质调节的生长因子的作用。
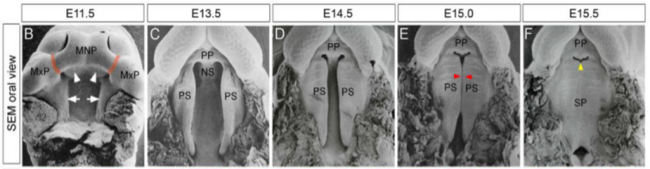
图1.鼠标腭,小鼠腭的发展阶段。(BF)扫描 ELE二级腭ctron显微照片(SEM)的代表发展时期。红色箭头:显示腭粘附和融合的初始部分。黄箭头:点到初级和次级口味融合后,将消失之间的空间(重印从考夫曼11与许可PLOS之一)。
Protocol
Representative Results
Discussion
本文中的方案提供了从胚胎解剖腭为13.5天胚胎的方法。从小鼠胚胎腭分别在无血清的培养基中培养在95% 的 O 2,5%CO 2的气氛下在37℃。成功的腭夹层是极其依赖于多种因素,在从安乐死的小鼠的培养完成的胚胎时在操作过程中的每个步骤。一的影响腭融合的最重要因素是启动器官培养所需要的时间;胚胎必须在13.5作为二次腭货架是水平的胚胎天,但还没有开始熔化( 图1)…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors do not have any acknowledgements.
Materials
| BGJb | Invitrogen | ||
| Penicillin/Streptomycin | Lonza Inc. | 17-602E | 100X |
| Petri dishes | VWR | 25384-088 | 100x15mm |
| Center-well organ culture dish | Falcon | #353037 | 60×15 mm |
| Wire triangular grid | Custom made with stainless steel wire mesh to fit the organ culture dish well. | ||
| Polycarbonate filter | GE& Water and Process Technologies | K04BP04700 | Black 0.4 micron, 47 mm |
| Stereo microscope | ZEISS Stemi SR | ||
| Culture hood | NUAIRE Laminar Flow | ||
| Microdissecting forceps | Dumont Medical | #5 | |
| Microdissecting scissors | Kent Scientific Corporation | INS14003-G | Vannas Scissors, straight, 8cm long, 0.1mm tips, 5mm blades, German made |
| Microdissecting scissors | Kent Scientific Corporation | INS500086 | Vannas Scissors, straight, 8.5cm long, 0.025mm x 0.015mm tips, 7mm blades |
| Microdissecting scissors | Kent Scientific Corporation | INS14127-G | Spring scissors curved curved, 10.5cm long, 8mm blades, German made |
| Surgical currete (spoon spatula) | Hu-friedy | CM 2/4 | |
| Protector laboratory hood | Labconco | ||
| Incubator | Thermo Scientific | Farma | |
| Series11 water Jacket | |||
| Co2 incubator | |||
| PBS | GIBCO | 10010-023 | 1X |
| Fiber optic Light source | Fiber-light Dolan-Jenner | PL-750 | |
| Embedding cassette | Statlab | EC301 | |
| Kim Wipes | VWR | 470173-504 | |
References
- Nawshad, A. Palatal seam disintegration to die or not to die that is no longer the question. Developmental dynamics an official publication of the American Association of Anatomists. 237, 2643-2656 (2008).
- Strong, E. B., Buckmiller, L. M. Management of the cleft palate. Facial plastic surgery clinics of North America. 9, 15-25 (2001).
- Witt, P. D., Marsh, J. L. Advances in assessing outcome of surgical repair of cleft lip and cleft palate. Plastic and reconstructive surgery. 100, 1907-1917 (1997).
- 4miloro, . principles of oral and maxillofafcial surgery. 209, 231-249 (1984).
- Mima, J. Regulation of the epithelial adhesion molecule CEACAM1 is important for palate formation. PloS one. 8, e61653 (2013).
- Carette, M. J., Ferguson, M. W. The fate of medial edge epithelial cells during palatal fusion in vitro an analysis by DiI labelling and confocal microscopy. Development (Cambridge, England). 114, 379-388 (1992).
- Ferguson, M. W., Honig, L. S., Slavkin, H. C. Differentiation of cultured palatal shelves from alligator chick and mouse embryos. The Anatomical record. 209, 231-249 (1984).
- San Miguel, S. Ephrin reverse signaling controls palate fusion via a PI3 kinase dependent mechanism. Developmental dynamics an official publication of the American Association of Anatomists. 240, 357-364 (2011).
- Kang, P., Svoboda, K. K. PI 3 kinase activity is required for epithelial mesenchymal transformation during palate fusion. Developmental dynamics an official publication of the American Association of Anatomists. 225, 316-322 (2002).
- RD, L. . Histopathologic Technic and Practical Histochemistry. , (1965).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1992).
- Taher, L. Global gene expression analysis of murine limb development. PloS one. 6, e28358 (2011).

