Hochauflösende Strukturkernspintomographie des menschlichen Subcortex<I> In-vivo-</I> Und Postmortem
Summary
Here we present a protocol to determine the minimum number images that needed to be registered and averaged to resolve subcortical structures and test whether the individual layers of the LGN could be resolved in the absence of physiological noise.
Abstract
Der Fokus dieser Studie war es, die Auflösungsgrenzen der strukturellen MRI eines postmortalen Hirn Vergleich zu lebenden menschlichen Gehirn zu testen. Die Auflösung der strukturellen MRT in vivo wird letztlich durch physiologische Lärm, einschließlich Pulsation, Atmung und Kopfbewegung begrenzt. Obwohl Imaging Hardware weiter zu verbessern, ist es immer noch schwierig, Strukturen auf der Millimeterskala lösen. Zum Beispiel die primären visuellen sensorischen Bahnen Synapsen am lateralen Kniehöcker (LGN), eine visuelle Relais und Steuerkern im Thalamus, die normalerweise in sechs verschachtelte monokularen Schichten organisiert. Bildgebungsstudien waren nicht in der Lage, zuverlässig zwischen diese Schichten aufgrund ihrer geringen Größe, die geringer als 1 mm dick sind.
Das Auflösungsgrenze von strukturellen MRI, in einer post mortem Gehirn wurde getestet, indem mehrere Bilder über eine lange Dauer (~ 24 h) gemittelt. Das Ziel war es zu prüfen, ob es möglich ist, die einzelnen L behebenAyers der LGN in Abwesenheit von physiologischen Rauschen. Ein Protonendichte (PD) 1 gewichtete Impulsfolge mit unterschiedlicher Auflösung und andere Parameter, die minimale Anzahl der Bilder notwendig, registriert werden zu bestimmen und gemittelt, um zuverlässig zu unterscheiden, die LGN und anderen subkortikalen Regionen. Die Ergebnisse wurden auch Bilder in lebenden menschlichen Gehirn erfasst verglichen. In vivo Probanden wurden, um die zusätzliche Wirkung von physiologischen Störungen in der minimalen Anzahl von PD-Scans benötigt subkortikalen Strukturen, nützlich in klinischen Anwendungen zu unterscheiden bestimmen abgetastet.
Introduction
Das Ziel dieser Untersuchung war es, die Auflösungsgrenzen der strukturellen MRT in Abwesenheit von physiologischen Lärm testen. Protonendichte (PD) gewichtete Bilder wurden in einer post mortem Gehirn über eine lange Zeitdauer (zwei bis 24 hr-Sitzungen) erworben, um die minimale Anzahl von Bildern, die registriert werden benötigt ermitteln und gemittelt, um die subkortikalen Strukturen aufzulösen. Zum Vergleich wurden auch PD-gewichteten Bildern auch in lebenden Menschen über eine Anzahl von Sessions erworben. Insbesondere war es das Ziel, festzustellen, ob es wäre in einem Best-Case-Szenario möglich ist, alle sechs einzelnen Schichten der menschlichen LGN, die etwa 1 mm dick (Abbildung 1) sind zu lösen.
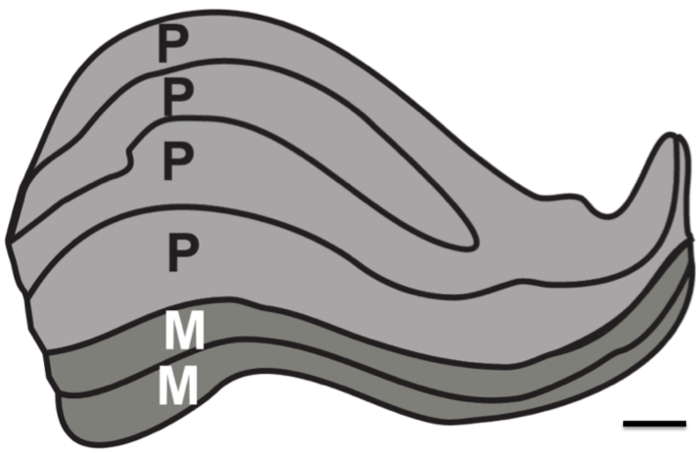
Abbildung 1. Menschen Corpus geniculatum laterale Schichten. Schematische Darstellung der Schichtstruktur des LGN. Großzellige (M) Schicht größerer neuronalen umfasstZellgröße und kleinere Zelldichte, die verantwortlich für die Lösung Bewegung und natürlich Konturen sind (Schichten 1-2, dargestellt als dunkelgrau). Kleinzelligen Schichten (P) von kleineren neuronalen Zellgröße und größere Zelldichte, die für die Lösung fein Form und Farbe (Schichten 4-6, hellgrau dargestellt) zuständig sind, zusammen. Maßstabsleiste 1 mm. Abbildung basierend auf gefärbten menschlichen LGN 12.
Die räumliche Auflösung der MRT wird verbessert, wenn die Matrixgröße erhöht wird, und als Feld (FOV) und Schichtdicke verringert. Jedoch verringert eine erhöhte Auflösung des Signal-Rausch-Verhältnis (SNR), das proportional zu der Voxelvolumen ist. SNR ist auch proportional zu der Quadratwurzel der Anzahl von Messungen. In lebenden Menschen, auch wenn mehrere Bilder können über eine Anzahl von getrennten Imaging-Sitzungen erworben werden, die ultimative Auflösung wird durch physiologische Rauschen begrenzt, wie Atmung, Kreislauf-Pulsationen und Kopfbewegung.
Hoch-Auflösung (0,35 mm in der Ebene liegende Voxel) Pd gewichtete Scans wurden erworben. PD-Scans verbessern grauen und weißen Kontrast im Thalamus 1, und führen zu Bildern, die T 1 und T 2 Wirkungen zu minimieren. Sein Bild ist abhängig von der Dichte von Protonen in der Form von Wasser und Makromolekülen, wie Proteinen und Fett in dem Bildgebungsvolumen. Die erhöhte Anzahl der Protonen in einem Gewebe ein helleres Signal auf dem Bild aufgrund der höheren Längsmagnetisierungskomponente 2.
PD-gewichtete Scans wurden gesammelt, da sie einen höheren Kontrast der subkortikalen Strukturen mit dem umgebenden Gewebe. Andere Kontraste wie T1- und T2-gewichteten Bildern führen zu Schwierigkeiten bei der Abgrenzung subkortikalen Strukturen wie der LGN durch kleinere Kontrast-zu-Rausch-Verhältnisse, wie ƒ 1,3 bestimmt.
Ebenso fanden früheren Studien, dass PD-gewichteten Bildern von Formalin fixiert post-mortem Gehirnen resulted in höheren Kontrastunterschiede zwischen grauen und weißen Substanz im Vergleich zu T1- und T2-gewichteten Bildern, die ähnliche graue und weiße Bild egal Intensitäten 3,4 hatte. Die zugrunde liegenden biophysikalischen Faktoren können diese Unterschiede zu erklären. T1 (längs) und T2 (quer) Relaxationszeiten der Wasserstoffprotonen davon abhängen, wie Wasser bewegt sich innerhalb des Gewebes. Fixiermittel wie Formalin Arbeit von vernetzenden Proteinen. Zwischen verschiedenen Gewebetypen sind die Unterschiede zwischen Wasser mit eingeschränkter Mobilität, wenn Fixiermittel verwendet werden. Reduziert T1 Gewebekontrast wurde nach der Fixierung beobachtet, wohingegen die Unterschiede in der relativen Dichte von Protonen innerhalb von Gehirngewebe erhöhte sich mit der Fixierung bessere Gradationsdifferenzierung 3, 4.
Frühere Studien haben die LGN in PD-gewichtete Scans identifiziert, mit einem 1,5 T 5,6,7, und bei 3 T-Scanner 8,9. Es ist wichtig, diese Abtastungen zu erhalten, um in der Lage, genau darzulegen, das Ausmaß sein,die LGN. Um eine vollständige Abdeckung der subkortikalen Kerne zu erhalten, wurden 18 PD-gewichteten Scheiben innerhalb des Thalamus erhalten. Jeder Band wurde auf das Doppelte der Entschließung 1024 Matrix neu abgetastet, (0,15 mm in der Ebene Voxelgröße), verkettete, Motion korrigiert und gemittelt, um eine hochauflösende 3D-Bild der subkortikalen Strukturen zu erzeugen. Die optimale Anzahl der PD-Bilder für das folgende Slice Anordnung erforderlich war 5, die Verringerung Scan-Zeit auf weniger als 15 min in lebenden Menschen. Nur noch 1 Bild PD war erforderlich, um subkortikalen Regionen deutlich abzugrenzen in der post mortem Gehirn, Verringerung der Zykluszeit auf weniger als 3 min (Abbildung 2 und 3).
Eine ganze Formalin fixierten postmortalen Hirnprobe wurde von einer Frau, die von Herzstillstand im Alter von 82 Jahre gestorben war gescannt. Überprüfung der medizinischen Unterlagen ergab, dass sie hatte: chronisch obstruktive Lungenerkrankungen, Angina, Dreibett-Bypass-Operation 8 Jahre vor dem Tod, Gebärmutterkrebs mit Hysterektomie behandelt7 Jahre vor dem Tod, Hyperlipidämie, Glaukom und Katarakt-Chirurgie. Postmortalen Hirnprobe wurde in 10% neutral gepuffertem Formalin immersionsfixiert für mindestens 3 Wochen bei 4 ° C postmortalen Hirn wurde mit dem gleichen Bildgebungsprotokoll als auch mit anderen Parametern im Verlauf von vielen Stunden für die Bildqualität Vergleiche gescannt . Nur die optimierten Parameter für das Protokoll beschrieben.
Protocol
Representative Results
Discussion
Diese Studie beschreibt ein optimiertes Protokoll in Erfassungs- und Analysetechnik, um hochauflösende PD gewichtete Bilder der subkortikalen Regionen zu erhalten. Eine Anzahl von Scanparametern wurden geprüft und mit den signifikantesten in Bezug auf die Matrixgröße, Voxelgrße und Bandbreite, um das SNR zu erhöhen und die Anzahl der Erfassungen, ein kritischer Schritt in der Lage, hochauflösende subkortikalen Strukturen bestimmen, modifiziert. In Verbindung mit der Suche nach der optimalen Parameter innerhalb vo…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge the following funding sources, the Natural Sciences and Engineering Research Council of Canada (NSERC), the Dorothy Pitts Research Fund (NG), and the Nicky and Thor Eaton Research Fund. The authors acknowledge Kevin DeSimone, and Aman Goyal and for their knowledge in MRI acquisition and analysis expertise.
Materials
| Magnetom Trio 3T MRI | Siemens (Erlangen, Germany). | ||
| Vacuum cushion hand | Siemens | Mat No: 4765454 | Manufactured by: Johannes-Stark-Stk. 8 D-92224 Amberg |
References
- Devlin, J. T., et al. Reliable identification of the auditory thalamus using multi-modal structural analyses. NeuroImage. 30 (4), 1112-1120 (2006).
- Fellner, F., et al. True proton density and T2-weighted turbo spin-echo sequences for routine MRI of the brain. Neuroradiology. 36 (8), 591-597 (1994).
- Schumann, C. M., Buonocore, M. H., Amaral, D. G. Magnetic resonance imaging of the post-mortem autistic brain. J Autism Dev Disord. 31 (6), 561-568 (2001).
- Tovi, M., Ericsson, A. Measurements of T1 and T2 over time in formalin-fixed human whole-brain specimens. Acta Radiol. 33 (5), 400-404 (1992).
- Fujita, N., et al. Lateral geniculate nucleus: anatomic and functional identification by use of MR imaging. Am J Neuroradiol. 22 (9), 1719-1726 (2001).
- Bridge, H., Thomas, O., Jbabdi, S., Cowey, A. Changes in connectivity after visual cortical brain damage underlie altered visual function. Brain. 131 (6), 1433-1444 (2008).
- Gupta, N., et al. Atrophy of the lateral geniculate nucleus in human glaucoma detected by magnetic resonance imaging. Br J Opthalmol. 93 (1), 56-60 (2009).
- Dai, H., et al. Assessment of lateral geniculate nucleus atrophy with 3T MR imaging and correlation with clinical stage of glaucoma. Am J Neuroradiol. 32 (7), 1347-1353 (2011).
- McKetton, L., Kelly, K. R., Schneider, K. A. Abnormal lateral geniculate nucleus and optic chiasm in human albinism. J Comp Neurol. 522 (11), 2680-2687 (2014).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Dietrich, O., Raya, J. G., Reeder, S. B., Reiser, M. F., Schoenberg, S. O. Measurement of signal-to-noise ratios in MR images: influence of multichannel coils, parallel imaging, and reconstruction filters. J Magn Reson Imaging. 26 (2), 375-385 (2007).
- Andrews, T. J., Halpern, S. D., Purves, D. Correlated size variations in human visual cortex, lateral geniculate nucleus, and optic tract. J Neurosci. 17 (8), 2859-2868 (1997).
- Pfefferbaum, A., Sullivan, E. V., Adalsteinsson, E., Garrick, T., Harper, C. Postmortem MR imaging of formalin-fixed human brain. NeuroImage. 21 (4), 1585-1595 (2004).

