De alta resolución de imagen de resonancia magnética estructural del subcorteza Humano<I> En Vivo</I> Y Postmortem
Summary
Here we present a protocol to determine the minimum number images that needed to be registered and averaged to resolve subcortical structures and test whether the individual layers of the LGN could be resolved in the absence of physiological noise.
Abstract
El objetivo de este estudio fue probar los límites de resolución de resonancia magnética estructural de un cerebro postmortem en comparación con los que viven los cerebros humanos. La resolución de la resonancia magnética estructural en vivo está limitada en última instancia por el ruido fisiológico, incluyendo pulsación, la respiración y el movimiento de la cabeza. Aunque el hardware de imagen sigue mejorando, todavía es difícil de resolver estructuras en la escala de milímetro. Por ejemplo, el visual vías sensoriales sinapsis primaria en el núcleo geniculado lateral (LGN), un relé de control visual y el núcleo en el tálamo, que normalmente está organizado en seis capas intercaladas monoculares. Los estudios de neuroimagen no han sido capaces de distinguir de forma fiable estas capas debido a su pequeño tamaño que tienen menos de 1 mm de espesor.
El límite de resolución de MRI estructural, en un cerebro postmortem fue probada usando múltiples imágenes como promedio durante un larga duración (~ 24 h). El propósito era probar si era posible para resolver el l individuoAyers del LGN en la ausencia de ruido fisiológico. Una densidad de protones (PD) 1 secuencia de pulso ponderado se utiliza con diferentes resolución y otros parámetros para determinar el número mínimo de imágenes necesarias para ser registrado y promedió para distinguir de forma fiable el LGN y otras regiones subcorticales. Los resultados también se compararon con las imágenes adquiridas en vivir cerebros humanos. In vivo sujetos fueron escaneados con el fin de determinar los efectos adicionales de ruido fisiológico sobre el número mínimo de exploraciones PD necesarios para diferenciar las estructuras subcorticales, útiles en aplicaciones clínicas.
Introduction
El propósito de esta investigación fue probar los límites de resolución de resonancia magnética estructural en la ausencia de ruido fisiológico. Proton densidad (PD) imágenes ponderadas fueron adquiridas en un cerebro postmortem durante un período largo (dos ~ 24 sesiones hr) para determinar el número mínimo de imágenes que deben ser registrados y se promediaron para resolver las estructuras subcorticales. Para la comparación, PD imágenes ponderadas también se adquirieron en los seres humanos que viven durante un número de sesiones. En particular, el objetivo era determinar si sería posible en un mejor escenario para resolver los seis capas individuales del LGN humana, que son aproximadamente 1 mm de espesor (Figura 1).
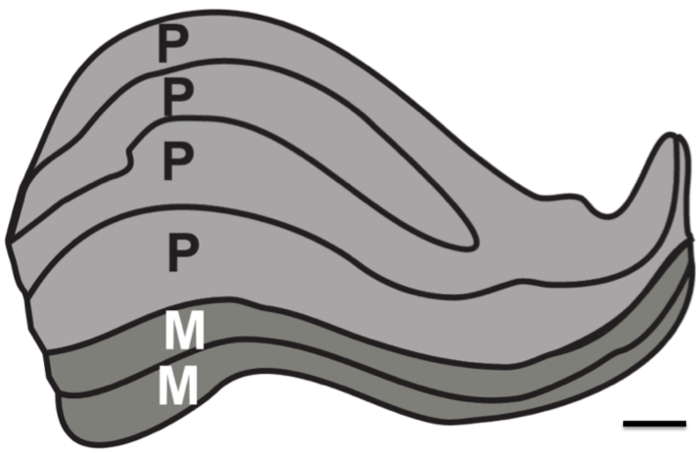
Figura 1. capas humano núcleo geniculado lateral. Esquemática de la estructura laminar del LGN. Magnocelular (M) se componen de capas más grande neuronalel tamaño celular y la densidad de células más pequeñas que son responsable de resolver los contornos de movimiento y de curso (capas 1-2, se muestra como gris oscuro). Parvocelulares capas (P) se componen de menor tamaño de la célula neuronal y más grande la densidad de células que son responsables de la resolución de fine-forma y el color (capas 4-6, representado como gris claro). Barra de escala 1 mm. Figura basado en manchado LGN 12 humana.
La resolución espacial en la RM se mejora cuando se aumenta el tamaño de la matriz, y cuando se reducen campo de visión (FOV) y grosor de corte. Sin embargo, el aumento de la resolución se reduce la relación señal a ruido (SNR), que es proporcional al volumen de voxel. SNR también es proporcional a la raíz cuadrada del número de mediciones. En los seres humanos que viven, aunque varias imágenes pueden ser adquiridas durante un número de sesiones de formación de imágenes separadas, la resolución final está limitada por el ruido fisiológico, tales como la respiración, las pulsaciones circulatorio y movimiento de la cabeza.
Alto-Resolución (0.35 mm voxels en el plano) PD exploraciones ponderados fueron adquiridas. Exploraciones PD mejorar contraste gris y blanco en el tálamo 1, y dan como resultado imágenes que minimicen T 1 y T 2 efectos. Su imagen depende de la densidad de protones en la forma de agua y macromoléculas tales como proteínas y grasas en el volumen de formación de imágenes. El aumento del número de protones en un tejido resulta en una señal más brillante en la imagen debido a la componente longitudinal superior de la magnetización 2.
Exploraciones PD ponderada se recogieron ya que proporcionan un mayor contraste de las estructuras subcorticales con el tejido circundante. Otros contrastes, como T1 y T2 provoque dificultades en la delimitación de las estructuras subcorticales como el LGN debido a menores proporciones de contraste-ruido, según lo determinado ƒ 1,3.
Del mismo modo, los estudios anteriores encontraron que las imágenes PD ponderada de formol fija cerebros post mortem resulted en mayores diferencias de contraste entre la materia gris y blanca en comparación con T1 y T2 que tenían intensidades de imagen materia gris y blanca similares 3,4. Los determinantes biofísicos subyacentes pueden explicar estas diferencias. T1 (longitudinal) y T2 (transversal) tiempos de relajación de los protones de hidrógeno dependerá de cómo el agua se mueve dentro del tejido. Los agentes de fijación tales como el trabajo en formol por proteínas de reticulación. Las diferencias entre la movilidad del agua se reducen entre los diferentes tipos de tejidos cuando se utilizan fijadores. Reducción de contraste de los tejidos T1 se ha observado después de la fijación, mientras que las diferencias en la densidad relativa de protones dentro de los tejidos del cerebro aumenta con la fijación, proporcionando una mejor diferenciación de contraste 3, 4.
Estudios previos han identificado la LGN en las exploraciones PD ponderada utilizando un 1,5 T 5,6,7, y en 3 T escáner 8,9. Es crítico para obtener estas exploraciones para ser capaz de esbozar exactitud el alcance deel LGN. Para mantener la cobertura total de los núcleos subcorticales, 18 rebanadas PD ponderada se obtuvieron en el tálamo. Cada volumen se volvió a muestrear al doble de la matriz de la resolución 1024, (0.15 mm Tamaño voxel en el plano), concatenados, movimiento corregido y promedió para producir una imagen en 3D de alta resolución de las estructuras subcorticales. El número óptimo de imágenes PD necesarios para la siguiente receta rebanada fue de 5, lo que reduce el tiempo de exploración a menos de 15 minutos en los seres humanos que viven. Sólo 1 imagen de dominio fue requerido para delimitar claramente las regiones subcorticales del cerebro postmortem, reduciendo el tiempo de exploración a menos de 3 min (Figura 2 y 3).
Toda una muestra de cerebro postmortem fijado en formol fue explorado de una mujer que había muerto de un paro cardiorrespiratorio a la edad de 82 años. Revisión de registros médicos reveló que ella tenía: la enfermedad pulmonar obstructiva crónica, la cirugía de pecho, triple bypass 8 años antes de su muerte, el cáncer uterino tratadas con histerectomía7 años antes de la muerte, hiperlipidemia, glaucoma, y cirugía de cataratas. El espécimen cerebral postmortem de inmersión se fijó en 10% de formalina tamponada neutra durante al menos 3 semanas a 4 ° C.El cerebro postmortem fue escaneada con el mismo protocolo de formación de imágenes, así como con otros parámetros en el transcurso de muchas horas para las comparaciones de calidad de imagen . Sólo los parámetros optimizados se describirán para el protocolo.
Protocol
Representative Results
Discussion
Este estudio describe un protocolo optimizado en la adquisición y técnica de análisis con el fin de obtener una alta resolución PD imágenes ponderadas de las regiones subcorticales. Un número de parámetros de análisis fueron probados y modificado con los más significativos relacionados con tamaño de la matriz, el tamaño de voxel, y ancho de banda para aumentar la SNR y disminuir el número de adquisiciones, un paso crítico en ser capaz de determinar las estructuras subcorticales de alta resolución. En conju…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge the following funding sources, the Natural Sciences and Engineering Research Council of Canada (NSERC), the Dorothy Pitts Research Fund (NG), and the Nicky and Thor Eaton Research Fund. The authors acknowledge Kevin DeSimone, and Aman Goyal and for their knowledge in MRI acquisition and analysis expertise.
Materials
| Magnetom Trio 3T MRI | Siemens (Erlangen, Germany). | ||
| Vacuum cushion hand | Siemens | Mat No: 4765454 | Manufactured by: Johannes-Stark-Stk. 8 D-92224 Amberg |
References
- Devlin, J. T., et al. Reliable identification of the auditory thalamus using multi-modal structural analyses. NeuroImage. 30 (4), 1112-1120 (2006).
- Fellner, F., et al. True proton density and T2-weighted turbo spin-echo sequences for routine MRI of the brain. Neuroradiology. 36 (8), 591-597 (1994).
- Schumann, C. M., Buonocore, M. H., Amaral, D. G. Magnetic resonance imaging of the post-mortem autistic brain. J Autism Dev Disord. 31 (6), 561-568 (2001).
- Tovi, M., Ericsson, A. Measurements of T1 and T2 over time in formalin-fixed human whole-brain specimens. Acta Radiol. 33 (5), 400-404 (1992).
- Fujita, N., et al. Lateral geniculate nucleus: anatomic and functional identification by use of MR imaging. Am J Neuroradiol. 22 (9), 1719-1726 (2001).
- Bridge, H., Thomas, O., Jbabdi, S., Cowey, A. Changes in connectivity after visual cortical brain damage underlie altered visual function. Brain. 131 (6), 1433-1444 (2008).
- Gupta, N., et al. Atrophy of the lateral geniculate nucleus in human glaucoma detected by magnetic resonance imaging. Br J Opthalmol. 93 (1), 56-60 (2009).
- Dai, H., et al. Assessment of lateral geniculate nucleus atrophy with 3T MR imaging and correlation with clinical stage of glaucoma. Am J Neuroradiol. 32 (7), 1347-1353 (2011).
- McKetton, L., Kelly, K. R., Schneider, K. A. Abnormal lateral geniculate nucleus and optic chiasm in human albinism. J Comp Neurol. 522 (11), 2680-2687 (2014).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Dietrich, O., Raya, J. G., Reeder, S. B., Reiser, M. F., Schoenberg, S. O. Measurement of signal-to-noise ratios in MR images: influence of multichannel coils, parallel imaging, and reconstruction filters. J Magn Reson Imaging. 26 (2), 375-385 (2007).
- Andrews, T. J., Halpern, S. D., Purves, D. Correlated size variations in human visual cortex, lateral geniculate nucleus, and optic tract. J Neurosci. 17 (8), 2859-2868 (1997).
- Pfefferbaum, A., Sullivan, E. V., Adalsteinsson, E., Garrick, T., Harper, C. Postmortem MR imaging of formalin-fixed human brain. NeuroImage. 21 (4), 1585-1595 (2004).

