Udvikling af en Backbone cyklisk peptid Bibliotek som potentielle Antiparasitære Therapeutics Brug mikrobølgebestråling
Summary
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
Abstract
Protein-protein interaktioner (PPI) er tæt involveret i næsten alle biologiske processer, og er forbundet med mange humane sygdomme. Derfor er der en stor indsats for at målrette PPI i grundforskning og i den farmaceutiske industri. Protein-protein interfaces er normalt store, flade og mangler ofte lommer, hvilket komplicerer opdagelsen af små molekyler, der er målrettet sådanne steder. Alternative målretningsmetoder anvendelse af antistoffer har begrænsninger på grund af dårlig oral biotilgængelighed, lav celle-permeabilitet, og produktion ineffektivitet.
Anvendelse af peptider til at målrette PPI grænseflader har flere fordele. Peptider har højere konformationsfleksibilitet, øget selektivitet, og de er generelt billige. Men peptider har deres egne begrænsninger, herunder dårlig stabilitet og ineffektivitet krydser cellemembraner. For at overvinde sådanne begrænsninger, kan peptid cyklisering udføres. Ringslutning har vist sig at forbedre peptid selektivitet, Metabolisk stabilitet og biotilgængelighed. Men forudsige den bioaktive konformation af et cyklisk peptid er ikke trivielt. For at overvinde denne udfordring, et attraktivt tilgang det screene et fokuseret bibliotek for at skærm, hvor alle skelet cykliske peptider har den samme primære sekvens, men adskiller sig i parametre, der påvirker deres konformation, såsom ringstørrelse og position.
Vi beskriver en detaljeret protokol til at syntetisere et bibliotek af backbone cykliske peptider rettet mod specifikke parasit PPI. Ved hjælp af en rationel tilgang til design, udviklede vi peptider afledt fra stilladset protein L eishmania receptor for aktiveret C-kinase (LACK). Vi antager, at sekvenser i LACK som er konserveret i parasitter, men ikke i pattedyrsvært homolog, kan repræsentere interaktionssites for proteiner, som er kritiske for parasitterne levedygtighed. De cykliske peptider blev syntetiseret under anvendelse mikrobølgebestråling at reducere reaktionstider og øgeeffektivitet. Udvikle et bibliotek af backbone cykliske peptider med forskellige ringstørrelser letter en systematisk screening for de biologisk aktive konformation. Denne metode giver en generel, hurtig og let måde at syntetisere cykliske peptider.
Introduction
Protein-protein interaktioner (PPI) spiller en central rolle i de fleste biologiske processer, fra intracellulære signaltransduktion til celledød 1. Derfor rettet PPI'er er af fundamental betydning for grundforskning og terapeutiske anvendelser. PPI kan reguleres ved en specifik og konstant antistoffer, men antistoffer er kostbare og vanskelige at fremstille og har dårlig biotilgængelighed. Alternativt kan PPI målrettes af små molekyler. Små molekyler er lettere at syntetisere og billig sammenlignet med antistoffer; men de er relativt mindre fleksible og passer bedre til små hulrum end store protein-protein interfaces 2,3. Forskellige undersøgelser har vist, at peptider, som er enklere og billigere end antistoffer og mere fleksibel end små molekyler, kan binde protein grænseflader og regulere PPI 4,5. Den globale terapeutiske peptid marked blev vurderet omkring femten milliarder dollars i 2013 og vokser 10,5% annually 6. Desuden er der mere end 50 markedsførte peptider, omkring 270 peptider i forskellige faser af klinisk afprøvning, og omkring 400 peptider i avancerede prækliniske faser 7. Selvom mange peptider bliver brugt som medicin, peptider stadig udgøre en række udfordringer, der begrænser deres udbredte anvendelse, herunder ringe biotilgængelighed og stabilitet, ineffektivitet i krydsning cellemembraner, og konformationel fleksibilitet 8,9. Et alternativ til at overvinde disse ulemper er at anvende forskellige ændringer, såsom lokale (D-aminosyre og N-alkylering) og globalt (cyklisering) begrænsninger 8,10-12. Disse ændringer opstår også naturligt. For eksempel cyclosporin A, et immunosuppressivt cyklisk naturligt forekommende peptid, indeholder en enkelt D-aminosyre og undergår N-alkylering modifikationer 13,14.
Ændring af naturlige aminosyrer til at inducere lokale begrænsninger, såsom D- og N-alkylering, ofte påvirker peptidet9; s biologisk aktivitet. Men ringslutning, hvor sekvensen af interesse kan forblive den samme, er mere tilbøjelige til at bevare den biologiske aktivitet. Ringslutning er en yderst attraktiv måde at begrænse peptidkonformationel plads ved at reducere ligevægten mellem forskellige konformationer. Det vil normalt øge den biologiske aktivitet og selektivitet ved at begrænse peptidet til aktive konformation, der medierer én funktion. Cyklisering forbedrer også peptid stabilitet ved at holde peptidet i en konformation, der er mindre anerkendt af nedbrydende enzymer. Faktisk blev cykliske peptider vist sig at have forbedret metabolisk stabilitet, biotilgængelighed, og selektivitet i forhold til deres lineære modstykker 15-17.
Imidlertid kan cyklisering være et tveægget sværd, eftersom i nogle tilfælde begrænsningen kan forhindre peptiderne i at opnå en bioaktiv form. For at overvinde denne forhindring, en fokuseret bibliotek, hvor alle peptider har den samme primære sequence og dermed konstant farmakoforer kan syntetiseres. Peptider i biblioteket er forskellige i parametre, som påvirker deres struktur, såsom ringstørrelse og position, med henblik på efterfølgende at screene for den mest bioaktive konformation 9,18.
Peptider kan syntetiseres både i opløsning og af en fastfase-peptidsyntese (SPPS) tilgang, som nu er mere udbredt peptidsyntese tilgang og vil blive diskuteret yderligere. SPPS er en proces, hvorved kemiske omdannelser udføres på en fast bærer via en linker til fremstilling af en bred vifte af syntetiske forbindelser 19. SPPS muliggør samling peptider ved træk kobling af aminosyrer på en trinvis måde fra C-terminus, som er fastgjort til en fast bærer, til den N-terminale ende. N-a-aminosyre-sidekæder skal maskeres med beskyttelsesgrupper, som er stabile i reaktionsbetingelserne, der anvendes under peptid forlængelse for at sikre tilsætning af en aminosyre pr step. I det sidste trin, er peptidet frigøres fra harpiksen og sidekædebeskyttende grupper fjernes samtidigt. Mens peptidet bliver syntetiseret, kan alle opløselige reagenser fjernes fra peptidet-faststofunderstøtningsmatrixen ved filtrering og vasket væk i slutningen af hvert koblingstrin. Med et sådant system, kan et stort overskud af reagenser i høj koncentration drive koblingsreaktioner til færdiggørelse og alle de syntese trin kan udføres i samme fartøj uden nogen overførsel af materiale 20.
Selvom SPPS har nogle begrænsninger såsom produktion af ufuldstændige reaktioner, sidereaktioner, urene reagenser, samt vanskeligheder reaktionen blev overvåget 21, har fordelene ved SPPS gjort det "gold standard" for peptidsyntese. Disse fordele indbefatter muligheden for at inkorporere ikke-naturlige aminosyrer, automatisering, let rensning, minimerede fysiske tab, og anvendelsen af overskydende reagenser, hvilket resulterer ihøje udbytter. SPPS har vist sig at være særdeles nyttige i syntesen af vanskelige sekvenser 21,22, fluorescerende modifikationer 23, og peptidbiblioteker 24,25. SPPS er også meget nyttig for andre poly-kæde samlinger såsom oligonukleotider, oligosaccharider 26,27 28,29 og peptidnukleinsyrer 30,31. Interessant nok i nogle tilfælde blev SPPS vist sig at være fordelagtig til at syntetisere små molekyler, der traditionelt fremstillet i opløsning 32,33. SPPS bruges både i lille målestok til forskning og undervisning 34,35 samt stor skala i industrien 36-38.
To syntese strategier, der hovedsagelig anvendes i SPPS metode til syntese af peptider er butyloxycarbonyl (Boc) og 9-fluorenylmethoxycarbonyl (Fmoc). Den oprindelige strategi indført for SPPS blev Boc, som kræver stærke sure betingelser for at fjerne sidekæde-beskyttende grupper og spalte peptidet fra REsin. Fmoc-baserede peptidsyntese, udnytter imidlertid moderate standardbetingelser og er en mildere alternativ til den syrelabile Boc protokol 39. Fmoc strategi udnytter ortogonale t-butyl (tBu) sidekædebeskyttelse, der fjernes i det sidste trin af syntesen, mens spaltning af peptidet fra harpiksen under sure betingelser.
Det generelle princip for peptidsyntese på faste underlag er vist i figur 1. Den oprindelige aminosyre, maskeret af en midlertidig beskyttelsesgruppe på N-α-terminus, er fyldt på harpiksen fra C-terminalen. En semi-permanent beskyttelsesgruppe at maskere sidekæden bruges også om nødvendigt (Figur 1, trin 1). Syntesen af målet peptid samles fra C-terminus til N-terminalen ved gentagne cyklusser af afbeskyttelse af N-α-midlertidige beskyttende gruppe (figur 1, trin 2) og kobling af den næste beskyttede aminosyre (Figur 1 </str ong>, trin 3). Efter den sidste aminosyre er indlæst (figur 1, trin 4), spaltes peptidet fra harpiksen støtte og de semi-permanente beskyttelsesgrupper fjernes (figur 1, trin 5).
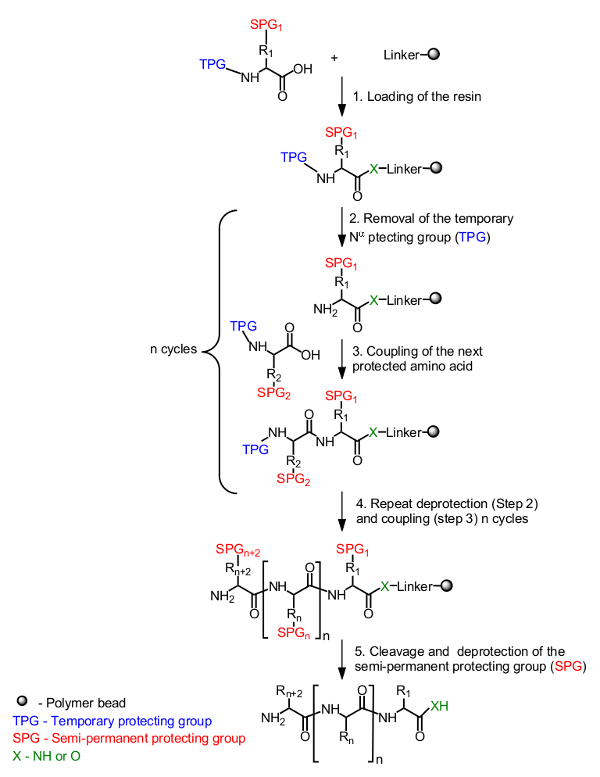
Figur 1. opbygningen af fastfasepeptidsyntese. Er N-α-beskyttede aminosyre forankret ved hjælp carboxylgruppen via en linker til harpiksen (trin 1). Det ønskede peptid samles på en lineær måde fra C-terminus til N-terminalen ved gentagne cyklusser af afbeskyttelse af den midlertidige beskyttelsesgruppe (TPG) fra N-α (trin 2) og aminosyrekobling (trin 3). Efter gennemførelse af syntesen (trin 4), er de halvpermanente beskyttelsesgrupper (SPG) afbeskyttes under peptidspaltning (trin 5).få = "_ blank"> Klik her for at se en større version af dette tal.
Efter montering af det komplette peptidkæden, kan cyclisering opnås ved flere alternativer: (A) hoved til hale ringslutning – det er en nem måde, men begrænset, da det giver kun én mulighed for ringslutning (figur 2A), (B) ringslutning ved hjælp af aminosyrer fra sekvensen af interesse, der indeholder bioaktive funktionelle grupper – dog kan anvendelsen af disse aminosyrer påvirke den biologiske aktivitet (figur 2B), og (C) ringslutning ved tilsætning aminosyrer (eller andre byggeklodser) uden at forstyrre det bioaktive sekvens. Introduktion disse molekyler er udbredt, da den tillader produktion af fokuserede biblioteker uden at ændre sekvensen af interesse (Figur 2C).
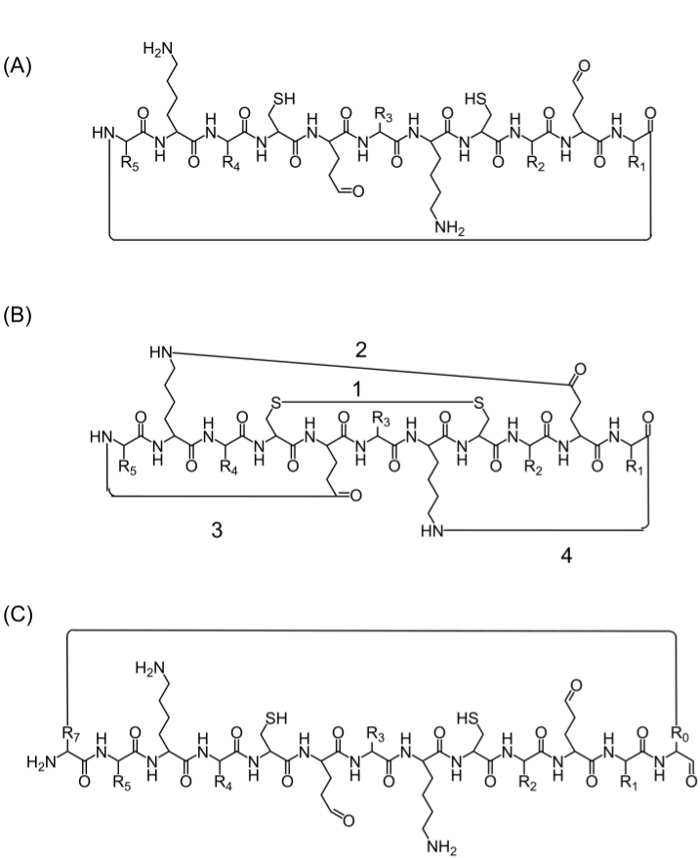
Figur 2. Alternative peptid ringslutningsbetingelser strategier (A) hoved til hale ringslutning via en peptidbinding mellem C-terminalen og N-terminalen.; (B) cyklisering mellem funktionelle grupper, såsom en disulfidbinding mellem resterne cystein (1), eller en amidbinding mellem kæderne af lysin siden til asparaginsyre / glutaminsyre (2), eller sidekæde til N- eller C-terminalen (3 -4); (C) ringslutning ved at tilføje ekstra aminosyrer eller aminosyre derivater eller små molekyler, for eksempel før (R0) og efter (R7) det bioaktive sekvens. Klik her for at se en større version af dette tal.
Mikroovn-assisteret syntese bruger mikrobølge bestråling til varme reaktioner, og dermed fremskynde organisk kemiske omdannelser 40,41. Mikroovn kemi er baseret på evnen af reagenset / opløsningsmiddel at absorberemikrobølge energi og omdanne det til varme 42. Før teknologien blev udbredt, havde store ulemper, som skal overvindes, herunder styrbarhed og reproducerbarhed synteseprotokoller og mangel på tilgængelige systemer til passende temperatur og tryk kontroller 43,44. Den første rapport af mikrobølgeassisteret peptidsyntese blev udført ved anvendelse et køkken mikrobølgeovn at syntetisere flere korte peptider (7-10 aminosyrer) med en betydelig forbedring af koblingseffektivitet og renhed 45. Desuden blev mikrobølgeenergi vist sig at falde kæde aggregering, reducere sidereaktioner, begrænse racemisering og forbedre koblingsmidler rater, som alle er kritiske for vanskelige og lange sekvenser 46-53.
I øjeblikket brug af mikrobølgebestråling til syntese af peptider eller beslægtede forbindelser på et fast underlag er omfattende, herunder (A) syntese i vand i stedet for organisk opløsningsmiddel 54; (B) Syntese af peptider medfælles post-translationelle modifikationer, såsom glycopeptider 55-58 eller 59-61, phosphopeptider hvis syntese er typisk vanskelig på grund af den lave koblingseffektivitet sterisk hindrede aminosyrederivater; (C) syntese af peptider med modifikation i rygraden, såsom azapeptides, som kan dannes ved erstatning af C (α) af en aminosyrerest med et nitrogenatom 62 eller peptoider, hvis sidekæde er forbundet til amidnitrogenet snarere end Ca-atomet 63,64; (D) syntese af cykliske peptider 65-71; og (E) syntese af kombinatoriske biblioteker 51,72. I mange tilfælde, forfatterne rapporterede højere effektivitet og reducerede syntese tid ved hjælp af mikrobølgebestråling sammenlignet med den konventionelle protokol.
Ved hjælp af en rationelt design 73-75, har vi udviklet anti-parasitære peptider, der er afledt af stilladset L eishmania s receptor foR aktiveret C-kinase (LACK). LACK spiller en vigtig rolle i den tidlige fase af Leishmania-infektion 76. Parasitter udtrykker lavere niveauer af LACK undlader at parasitize selv immunsvækkede mus 77, som mangler, er involveret i vigtige parasit signalering processer og proteinsyntese 78. Derfor LACK er et centralt stillads protein 79 og en værdifuld narkotika mål. Fokus på sekvenser i LACK som er konserveret i de parasitter, men ikke i værten pattedyr homolog RACK, identificerede vi et 8 aminosyre peptid (RNGQCQRK), der faldt Leishmania sp. Levedygtighed i kultur.
Her beskriver vi en protokol til syntese af cyklisk skelet peptider afledt fra proteinsekvensen LACK beskrevet ovenfor. Peptiderne blev syntetiseret på et fast underlag ved hjælp af mikrobølgeopvarmning af SPPS metode med Fmoc / tBu-protokollen. Peptider blev konjugeret til et TAT 47-57 (YGRKKRRQRRR) bærerpeptid gennem en amidbinding somdel af SPPS. TAT-baserede transport af en række forskellige ladninger i celler har været brugt i over 15 år og levering af lasten i subcellulære organeller er blevet bekræftet 80. Fire forskellige linkere, ravsyre og glutarsyreanhydrid samt adipinsyre og pimelinsyre, blev anvendt til at udføre ringslutning til generering af carboxylsyregrupper linkere af to til fem carbonatomer. Ringslutning blev udført under anvendelse af mikrobølgeenergi, og de endelige spaltnings- og sidekæde-afbeskyttelsestrin blev udført manuelt uden mikrobølgeenergien. Anvendelsen af en automatiseret synthesizer mikrobølgeovn forbedret produktrenhed, forøgede produktudbytte og reduceret varigheden af syntesen. Denne generelle protokol kan anvendes til andre undersøgelser, der anvender peptider til at forstå vigtige molekylære mekanisme in vitro og in vivo og videreudvikle potentielle lægemidler til humane sygdomme.
Protocol
Representative Results
Discussion
Syntesen af en fokuseret bibliotek af cyklisk skelet peptider afledt fra LACK protein af Leishmania-parasitten ved hjælp af en fuldautomatisk mikrobølgeovn synthesizer beskrives. En fokuseret bibliotek af cykliske peptider blev udviklet med konserverede farmakoforer og forskellige linkere. Tilsætning af forskellige linkere, såsom glutarsyre, ravsyreanhydrid, adipinsyre, pimelinsyre, lysin, ornithin og andre byggeblokke kan anvendes til at øge udbuddet af konformationelle område af cykliske peptider. Synte…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker Lauren Van Wassenhove, Sunhee Hwang, og Daria Mochly-Rosen til nyttige diskussioner. Arbejdet blev støttet af National Institutes of Health Grant NIH RC4 TW008781-01 C-IDEA (SPARK) til NQ De finansieringskilderne havde nogen rolle i studie design, indsamling og analyse af data, beslutning om at offentliggøre, eller forberedelse af manuskriptet.
Materials
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic |
| Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. | |||
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′-tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’- | Sigma | 38370 | Caution Flammable/ Toxic |
| Diisopropylcarbodiimide (DIC) | |||
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Name | Company | Catalog Number | Comments |
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams™ nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials – micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP |
References
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Biochemistry. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Biochemistry. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O’Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using ‘safety catch’ methodology. J Vis Exp. (63), e4112 (2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based ‘building block’ approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O’Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis – A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710 (2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373 (2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).

