Entwicklung eines Backbone zyklische Peptid-Bibliothek als potentielle Antiparasiten Therapeutics unter Mikrowellenbestrahlung
Summary
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
Abstract
Protein-Protein-Wechselwirkungen (PPIs) sind in fast allen biologischen Prozessen eng verbunden und werden in vielen menschlichen Krankheiten in Verbindung gebracht. Daher gibt es eine große Anstrengung, um die PPI in Grundlagenforschung und in der pharmazeutischen Industrie zu zielen. Protein-Protein-Schnittstellen sind in der Regel groß, flach und häufig nicht über Taschen, Verkomplizierung der Entdeckung kleiner Moleküle, die solche Stellen zielen. Alternative Targeting Ansätze unter Verwendung von Antikörpern weisen Beschränkungen aufgrund der schlechten oralen Bioverfügbarkeit, niedriger Zelldurchlässigkeit, und die Produktion Ineffizienz.
Verwendung von Peptiden zur PPI-Schnittstellen Ziel hat mehrere Vorteile. Peptide haben eine höhere Konformations Flexibilität, erhöhte Selektivität und sind in der Regel teuer. Allerdings haben Peptide ihre eigenen Grenzen einschließlich schlechte Stabilität und Ineffizienz Kreuzung Zellmembranen. Um diese Einschränkungen zu überwinden, kann Peptidcyclisierung durchgeführt werden. Zyklisierung wurde gezeigt, dass Peptid-Selektivität zu verbessernMetabolische Stabilität und Bioverfügbarkeit. Die Vorhersage der bioaktiven Konformation eines zyklischen Peptids ist jedoch nicht trivial. Um diese Herausforderung zu meistern, um einen attraktiven Ansatz es Bildschirm eine fokussierte Bibliothek-Bildschirm, in dem alle Backbone zyklischen Peptide haben den gleichen Primärsequenz, unterscheiden sich aber in Parameter, die ihre Konformation beeinflussen, wie zum Beispiel Ring Größe und Position.
Wir beschreiben ein detailliertes Protokoll zur Synthese einer Bibliothek von Backbone zyklischen Peptide auf bestimmte Parasiten EPI. Mit Hilfe eines rationalen Design-Ansatz entwickelten wir Peptide aus dem Gerüstprotein L eishmania Rezeptor für aktivierte C-Kinase (LACK) abgeleitet. Wir vermuten, dass Sequenzen in LACK in Parasiten konserviert sind, aber nicht in den Säugetierwirt homolog kann Interaktionsstellen für Proteine, die kritisch für den Parasiten Lebensfähigkeit darzustellen. Die zyklischen Peptide wurden unter Verwendung von Mikrowellenstrahlung, um die Reaktionszeiten zu reduzieren und die synthetisiertenEffizienz. Die Entwicklung einer Bibliothek von Backbone zyklischer Peptide mit unterschiedlichen Ringgrößen ermöglicht eine systematische Bildschirm für die meisten biologischen aktiven Konformation. Dieses Verfahren stellt eine allgemeine, schnelle und einfache Art und Weise die Synthese cyclischer Peptide.
Introduction
Protein-Protein-Wechselwirkungen (PPIs) spielen eine zentrale Rolle in den meisten biologischen Prozesse, von der intrazellulären Signaltransduktion, Zelltod 1. Daher Targeting PPI ist von grundlegender Bedeutung für die Grundlagenforschung und therapeutische Anwendungen. PPIs durch spezifische und stabile Antikörper reguliert werden, aber Antikörper sind teuer und schwierig herzustellen und haben eine schlechte Bioverfügbarkeit. Alternativ kann PPI durch kleine Moleküle ausgerichtet werden. Kleine Moleküle sind einfacher zu synthetisieren und preiswert im Vergleich zu Antikörpern; jedoch sind sie relativ weniger flexibel und passen besser, kleine Hohlräume als großes Protein-Protein-Grenzflächen 2,3. Diverse Untersuchungen haben gezeigt, dass Peptide, die einfacher und billiger als Antikörper und flexibler als die kleine Moleküle sind, können Protein-Grenzflächen zu binden und zu regulieren PPIs 4,5. Die globale therapeutische Peptidmarkt wurde um 15 Milliarden US-Dollar im Jahr 2013 geschätzt und wächst um 10,5% annually 6. Darüber hinaus gibt es mehr als 50 vertrieben Peptide, etwa 270-Peptide in verschiedenen Phasen der klinischen Prüfung, und etwa 400 Peptide in fortgeschrittenen präklinischen Phasen 7. Obwohl zahlreiche Peptide werden als Arzneimittel verwendet werden, Peptide stellen noch einige Herausforderungen, die ihre weitverbreitete Anwendung, einschließlich schlechte Bioverfügbarkeit und Stabilität, Ineffizienz im Kreuzungs Zellmembranen und Konformationsflexibilität 8,9 zu begrenzen. Eine Alternative, diese Nachteile zu überwinden, ist es, verschiedene Modifikationen wie lokale (D-Aminosäure und N-Alkylierung) oder global (Cyclisierung) 8,10-12 Einschränkungen gelten. Diese Modifikationen auch natürlich vorkommen. Beispielsweise Cyclosporin A, ein Immunsuppressivum cyclischen natürliches Peptid, enthält ein einzelnes D-Aminosäure und erfährt eine N-Alkylierung Modifikationen 13,14.
Modifikation der natürlichen Aminosäuren lokalen Beschränkungen, wie zum Beispiel D- und N-Alkylierung zu induzieren, oft auf die Peptid9; s biologische Aktivität. Jedoch Cyclisierung, bei der die Sequenz von Interesse gleich bleiben kann, wird eher die biologische Aktivität zu bewahren. Cyclisierung ist eine sehr attraktive Möglichkeit, Peptid Konformationsraum durch Verringerung das Gleichgewicht zwischen verschiedenen Konformationen zu beschränken. Sie erhöhen in der Regel der biologischen Aktivität und Selektivität durch die Beschränkung des Peptids an der aktiven Konformation, die nur eine Funktion vermittelt. Cyclisierung verbessert auch die Stabilität der Peptide, indem das Peptid in einer Konformation, die weniger durch abbauende Enzyme erkannt wird. Tatsächlich wurden zyklische Peptide gezeigt, metabolische Stabilität, Bioverfügbarkeit und die Selektivität verbessert werden im Vergleich zu ihren linearen Gegen 15-17 haben.
Jedoch kann die Cyclisierung ein zweischneidiges Schwert, da in einigen Fällen die Einschränkung können die Peptide von der Erreichung eines bioaktiven Konformation verhindern. Um diese Hürde zu überwinden, eine fokussierte Bibliothek, in der alle Peptide haben die gleiche Grund SequencE und demzufolge konstant Pharmakophore synthetisiert werden. Peptide in der Bibliothek unterschiedlich Parameter, deren Struktur zu beeinflussen, wie Ringgröße und der Position, um in der Folge Bildschirm für die meisten bioaktiven Konformation 9,18.
Peptide können in Lösung und durch eine Festphasen-Peptidsynthese (SPPS) Ansatz, der jetzt die häufiger Peptidsyntheseansatz und wird weiter diskutiert werden, synthetisiert werden. SPPS ist ein Prozess, durch den chemischen Umwandlungen sind auf einem festen Träger über einen Linker durchgeführt, um eine breite Palette von synthetischen Verbindungen 19 vorzubereiten. SPPS ermöglicht Zusammenbauen Peptiden durch aufeinanderfolgende Kopplung der Aminosäuren in einer stufenweise vom C-Terminus, die an einen festen Träger gebunden ist, an den N-Terminus. Die N-α-Aminosäure-Seitenketten sind mit Schutzgruppen, die in den während Peptidelongation verwendeten Reaktionsbedingungen stabil sind, die Zugabe einer Aminosäure pro st sicherzustellen maskierendenep. Im letzten Schritt wird das Peptid vom Harz gelöst und die Seitenketten-Schutzgruppen werden gleichzeitig entfernt. Während das Peptid, das synthetisiert wird, können alle löslichen Reagenzien aus dem Peptid-feste Trägermatrix durch Filtration entfernt und weg am Ende jedes Kopplungsschritt gewaschen werden. Mit einem solchen System kann ein großer Überschuß an Reagenzien in hoher Konzentration Kupplungsreaktionen zum Abschluss zu bringen und alle Syntheseschritte können in demselben Behälter ohne Übertragung von Material 20 durchgeführt werden.
Obwohl SPPS hat einige Einschränkungen, wie beispielsweise der Herstellung von unvollständigen Reaktionen, Nebenreaktionen, unreinen Reagenzien, sowie Schwierigkeiten Überwachung der Reaktion 21, haben die Vorteile der SPPS es der "Goldstandard" für die Peptidsynthese hergestellt. Zu diesen Vorteilen gehören die Möglichkeit, nicht-natürliche Aminosäuren, Automatisierung, einfache Reinigung zu integrieren, minimiert physikalische Verluste und die Verwendung von überschüssigen Reagenzien, was zuhohe Erträge. SPPS ist gezeigt worden, sehr nützlich bei der Synthese von schwierigen Sequenzen 21,22 fluoreszierenden Modifikationen 23 und Peptidbibliotheken 24,25 sein. SPPS ist auch sehr nützlich für andere poly-Kettenanordnungen wie Oligonukleotide 26,27, 28,29 Oligosaccharide und Peptidnucleinsäuren 30,31. Interessanterweise ist in einigen Fällen gezeigt wurde SPPS zur Synthese kleiner Moleküle, die traditionell in der Lösung 32,33 bestehen vorteilhaft. SPPS wird sowohl im kleinen Maßstab für Forschung und Lehre 34,35 als auch im großen Maßstab in der Industrie 36-38 verwendet.
Zwei Synthesestrategien, die hauptsächlich in SPPS Methodik für die Synthese von Peptiden verwendet werden, sind Butyloxycarbonyl (Boc) und 9-Fluorenylmethoxycarbonyl (Fmoc). Die für SPPS eingeführt ursprüngliche Strategie war Boc, die stark sauren Bedingungen erfordert, um Seitenketten aus dem R-Schutzgruppen zu entfernen und spalten das PeptidEsin. Fmoc-basierte Peptidsynthese verwendet jedoch mäßige Basiszustand und ist eine mildere Alternative zu dem säurelabilen Boc-Protokoll 39. Die Fmoc-Strategie nutzt orthogonalen t-Butyl (tBu) Seitenkettenschutz, der in der letzten Stufe der Synthese entfernt wird, während Abspaltung des Peptids vom Harz unter sauren Bedingungen.
Das allgemeine Prinzip für die Peptidsynthese am festen Träger ist in Figur 1 dargestellt. Die anfängliche Aminosäure, durch eine temporäre Schutzgruppe an dem N-α-Terminus maskiert wird an das Harz von dem C-Terminus geladen. Eine semi-permanente Schutzgruppe, um die Seitenkette zu maskieren ist auch, falls erforderlich (Figur 1, Schritt 1) verwendet wird. Die Synthese des Zielpeptides aus dem C-Terminus mit dem N-Terminus durch wiederholte Zyklen von Entschützen der N-α-temporären Schutzgruppe (1, Schritt 2) und Kopplung der nächsten geschützten Aminosäure (1 gebaut </str ong>, Schritt 3). Nach der letzten Aminosäure wird geladen (1, Schritt 4), wird das Peptid vom Harzträger abgespalten und die semi-permanente Schutzgruppen entfernt (Abbildung 1, Schritt 5).
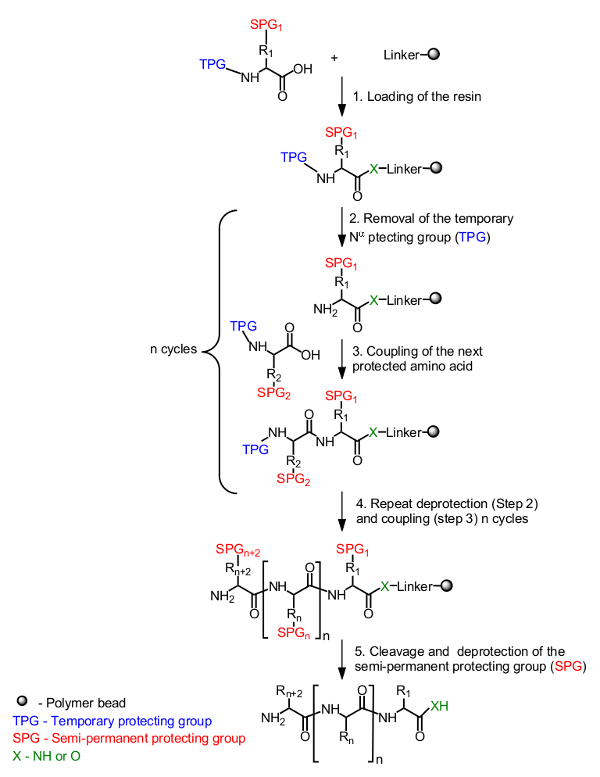
Figur 1. Allgemeines Schema der Festphasenpeptidsynthese. Die N-α-geschützten Aminosäure unter Verwendung der Carboxylgruppe über einen Linker an dem Harz (Schritt 1) verankert ist. Das gewünschte Peptid in einer linearen Weise vom C-Terminus zum N-Terminus durch wiederholte Zyklen von Entschützen der temporären Schutzgruppe (TPG) von dem N-α (Schritt 2) und Aminosäurekupplung (Schritt 3) zusammengesetzt. Nach der Durchführung der Synthese (Schritt 4) werden die semi-permanenten Schutzgruppen (SPG) während der Peptidspaltung (Schritt 5) entschützt.bekommen = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Nach Montage der kompletten Peptidkette kann Cyclisierung durch mehrere Alternativen erreicht werden: (A) Kopf-Schwanz-Cyclisierung – dies ist ein bequemer Weg, aber begrenzt, da es nur eine Option für die Cyclisierung (2A), (B) Cyclisierung bietet Verwendung der Aminosäuren aus der Sequenz von Interesse, die biologisch aktive funktionelle Gruppen enthalten – jedoch die Verwendung dieser Aminosäuren können die biologische Aktivität (2B) und (C) die Cyclisierung durch Zusatz von Aminosäuren (oder anderen Bausteinen) ohne störenden Einfluss das bioaktive Sequenz. Einführung dieser Moleküle ist weit verbreitet, da es ermöglicht die Herstellung von konzentrierten Bibliotheken ohne Änderung der Sequenz von Interesse (2C).
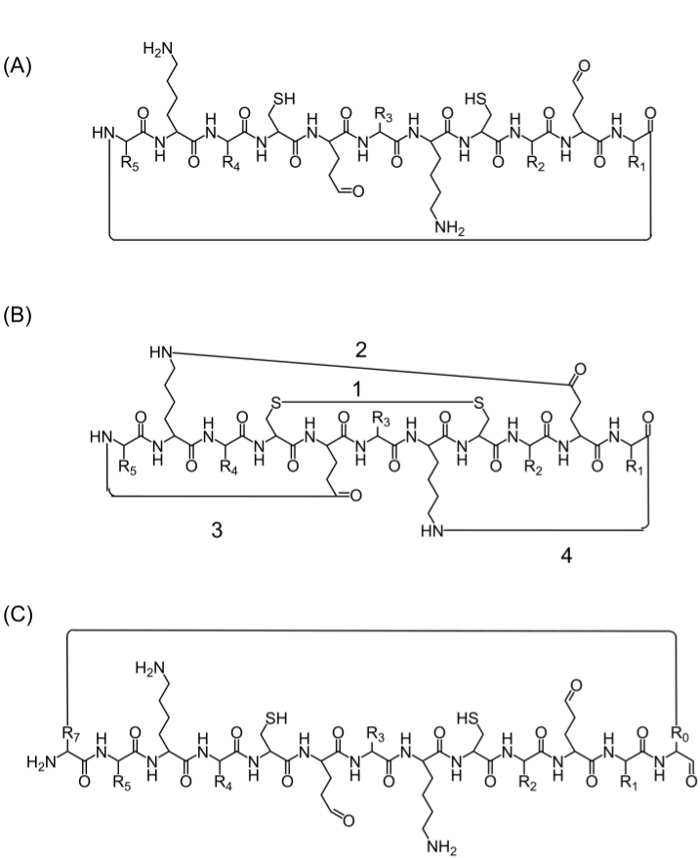
FBBILDUNG 2. Alternative Peptidcyclisierung Strategien (A) Kopf-Schwanz-Cyclisierung, durch eine Peptidbindung zwischen dem C-Terminus und N-Terminus. (B) Cyclisierung zwischen funktionellen Gruppen, wie eine Disulfidbindung zwischen Cysteinresten (1) oder einer Amidbindung zwischen den Seitenketten von Lysin Asparaginsäure / Glutaminsäure (2) oder der Seitenkette in N- oder C-Terminus (3 -4); (C) Cyclisierung durch das Hinzufügen zusätzlicher Aminosäuren oder Aminosäurederivate oder kleine Moleküle, beispielsweise vor (R0) und nach (R7) die bioaktive Sequenz. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Mikrowellen-unterstützte Synthese nutzt Mikrowellenbestrahlung, um Reaktionen zu erwärmen, und beschleunigt so organische chemische Umwandlungen 40,41. Mikrowellenchemie basiert auf der Fähigkeit des Reagens / Lösemittel zum absorbieren basierendMikrowellenenergie und wandeln sie in Wärme um 42. Bevor die Technologie verbreitet wurde, hatte gravierende Nachteile zu überwinden, einschließlich der Steuerbarkeit und Reproduzierbarkeit der Syntheseprotokolle und der Mangel an geeigneter Systeme zur Temperatur- und Drucksteuerungen 43,44. Der erste Bericht über die mikrowellenunterstützte Peptidsynthese wurde unter Verwendung eines Küchenmikrowellen mehrere kurze Peptide zu synthetisieren (7-10 Aminosäuren) mit signifikanten Verbesserung der Kopplungseffizienz und die Reinheit 45 getan. Darüber hinaus wurde gezeigt, dass Mikrowellenenergie Kettenaggregation zu verringern, reduzieren Nebenreaktionen, Racemisierung zu beschränken, und zur Verbesserung der Kopplungsraten, die alle entscheidend für die schwierige und lange Sequenzen von 46 bis 53 sind.
Gegenwärtig ist die Verwendung von Mikrowellenstrahlung für die Synthese von Peptiden oder verwandten Verbindungen auf einem festen Träger ist umfangreich, einschließlich (A) Synthese in Wasser anstelle des organischen Lösungsmittels 54; (B) Synthese von Peptiden mitgemeinsame posttranslationale Modifikationen wie Glycopeptide 55-58 oder 59-61 Phosphopeptide, dessen Synthese ist in der Regel schwierig, aufgrund der geringen Kopplungseffizienz von sterisch gehinderten Aminosäurederivate; (C) Synthese von Peptiden mit einer Modifikation in der Hauptkette, wie Azapeptiden, die durch den Austausch der C (α) eines Aminosäurerests mit einem Stickstoffatom 62 oder Peptoide, dessen Seitenkette ist mit der gebildet werden kann, Amidstickstoff anstelle des C & alpha Atom 63,64; (D) Synthese von cyclischen Peptiden 65-71; und (E) Synthese von kombinatorischen Bibliotheken 51,72. In zahlreichen Fällen die Autoren berichteten höheren Wirkungsgrad und geringere Synthesezeit unter Mikrowellenbestrahlung im Vergleich mit dem herkömmlichen Protokoll.
Mit Hilfe eines rationalen Design 73-75, Anti-Parasiten-Peptide, die vom Gerüst L eishmania des Rezeptors fo abgeleitet wurden, entwickelten wirr aktiviert C-Kinase (LACK). LACK spielt eine wichtige Rolle in der frühen Phase der Infektion mit Leishmanien 76. Parasiten ausdrücken unteren Ebenen der LACK nicht einmal, auch immungeschwächten Mäusen parasitieren 77 als LACK ist in wesentlichen Parasiten Signalprozessen und Proteinsynthese 78 beteiligt. Daher ist LACK ein Schlüsselgerüstprotein 79 und ein wertvolles Medikament Ziel. Sich auf Sequenzen in LACK, die in den Parasiten konserviert sind, aber nicht in der Wirts Säugerhomolog RACK, identifizierten wir eine 8-Aminosäuren-Peptid (RNGQCQRK), welche Leishmania sp. Lebensfähigkeit in Kultur verringert.
Hier beschreiben wir ein Protokoll für die Synthese von cyclischem Gerüst Peptide aus dem oben beschriebenen LACK Proteinsequenz abgeleitet. Die Peptide wurden auf einem festen Träger unter Verwendung von Mikrowellenheizung durch SPPS Methodik mit Fmoc / tBu-Protokolls synthetisiert. Peptide wurden in einen TAT 47-57 (YGRKKRRQRRR) Trägerpeptid über eine Amidbindung als konjugiertesTeil der SPPS. TAT-basierten Transport einer Vielzahl von Ladungen in die Zellen ist seit über 15 Jahren verwendet, und die Lieferung der Ladung in subzellulären Organellen wurde bestätigt, 80. Vier verschiedenen Linkern, Bernstein- und Glutarsäureanhydrid sowie Adipin- und Pimelinsäure, wurden verwendet, um die Cyclisierung durchzuführen, um Carbonsäure-Linker von zwei bis fünf Kohlenstoffatomen zu erzeugen. Zyklisierung wurde unter Verwendung von Mikrowellenenergie durchgeführt, und die abschließende Abspaltung und Seitenketten-Gruppenoperationen manuell ohne Mikrowellenenergie erfolgt. Die Verwendung eines automatischen Mikrowellen-Synthesizer verbessert die Produktreinheit, erhöht die Produktausbeute und verringert die Dauer der Synthese. Dieses allgemeine Protokoll kann zu anderen Studien, die Peptide zu verwenden, um wichtige molekulare Mechanismus in vitro und in vivo zu verstehen und weiterzuentwickeln potentielle Arzneimittel für menschliche Krankheiten verwendet werden.
Protocol
Representative Results
Discussion
Die Synthese einer fokussierten Bibliothek Rückgrat aus dem Mangel Protein der Leishmania-Parasiten mit einem vollständig automatisierten Mikrowellen-Synthesizer abgeleitet cyclische Peptide beschrieben. Ein fokussierter Bibliothek zyklischer Peptide wurde mit konservierten Pharmakophore und verschiedene Linker entwickelt. Zugabe verschiedener Linker wie Glutarsäureanhydrid, Bernsteinsäureanhydrid, Adipinsäure, Pimelinsäure, Lysin, Ornithin und andere Bausteine verwendet werden, um die Vielfalt eine…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken Lauren Van Wassenhove, Sunhee Hwang und Daria Mochly-Rosen für hilfreiche Diskussionen. Die Arbeit wurde von den National Institutes of Health Grants NIH RC4 TW008781-01 C-IDEA (SPARK) unterstützt, um NQ Die Geldgeber hatten keine Rolle in Studiendesign, Datenerhebung und -analyse, Entscheidung zur Veröffentlichung oder Erstellung des Manuskripts.
Materials
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic |
| Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. | |||
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′-tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’- | Sigma | 38370 | Caution Flammable/ Toxic |
| Diisopropylcarbodiimide (DIC) | |||
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Name | Company | Catalog Number | Comments |
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams™ nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials – micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP |
References
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Biochemistry. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Biochemistry. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O’Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using ‘safety catch’ methodology. J Vis Exp. (63), e4112 (2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based ‘building block’ approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O’Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis – A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710 (2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373 (2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).

