Développement d'un Backbone peptide cyclique Bibliothèque en tant que potentiel Antiparasitaires Therapeutics Utilisation irradiation micro-ondes
Summary
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
Abstract
Interactions protéine-protéine (IPP) sont intimement impliqués dans la plupart des processus biologiques et sont liées à de nombreuses maladies humaines. Par conséquent, il ya un effort important de cibler les IPP en recherche fondamentale et dans l'industrie pharmaceutique. Interfaces protéine-protéine sont généralement de grande taille, plat, et manquent souvent des poches, ce qui complique la découverte de petites molécules qui ciblent ces sites. Les approches de ciblage alternatifs utilisant des anticorps ont des limitations dues à la biodisponibilité orale pauvre, faible perméabilité cellulaire, et l'inefficacité de la production.
Utilisation de peptides pour cibler interfaces PPI présente plusieurs avantages. Les peptides ont flexibilité conformationnelle plus élevée, une sélectivité accrue, et sont généralement peu coûteux. Cependant, les peptides ont leurs propres limites, y compris une mauvaise stabilité et l'inefficacité de traverser les membranes cellulaires. Pour surmonter ces limitations, un peptide cyclisation peut être effectuée. Cyclisation a été démontré pour améliorer la sélectivité peptide, La stabilité métabolique et la biodisponibilité. Cependant, la prédiction de la conformation bioactive d'un peptide cyclique est pas trivial. Pour surmonter ce défi, une approche attrayante pour cribler une banque ciblée à l'écran dans lequel tous les peptides cycliques de squelette ont la même séquence primaire, mais diffèrent dans les paramètres qui influent sur leur conformation, tels que la taille et la position de l'anneau.
Nous décrivons un protocole détaillé pour la synthèse d'une bibliothèque de peptides cycliques backbone ciblant IPP de parasites spécifiques. En utilisant une approche de conception rationnelle, nous avons développé des peptides dérivés du récepteur L eishmania de protéines d'échafaudage C-kinase activée (manque). Nous émettons l'hypothèse que les séquences A défaut qui sont conservés dans parasites, mais pas dans l'homologue hôte de mammifère, peuvent représenter des sites d'interaction pour des protéines qui sont essentiels pour la viabilité des parasites. Les peptides cycliques ont été synthétisés par irradiation micro-ondes pour réduire les temps de réaction et d'augmenterEfficacité. Développer une bibliothèque de peptides cycliques backbone avec différentes tailles d'anneaux facilite un écran systématique de la conformation active plus biologique. Cette méthode fournit une manière générale, rapide et facile à synthétiser des peptides cycliques.
Introduction
Interactions protéine-protéine (IPP) jouent un rôle central dans la plupart des processus biologiques, de transduction du signal intracellulaire à la mort cellulaire 1. Par conséquent, en ciblant les IPP est d'une importance fondamentale à la recherche fondamentale et les applications thérapeutiques. IPP peuvent être réglés par des anticorps spécifiques et stables, mais les anticorps sont coûteux et difficiles à fabriquer et ont une faible biodisponibilité. Alternativement, les IPP peuvent être ciblées par de petites molécules. Les petites molécules sont plus faciles à synthétiser et à bon marché par rapport à des anticorps; cependant, ils sont relativement moins flexible et correspondent mieux aux petites et grandes cavités à des interfaces protéine-protéine 2,3. Diverses études ont démontré que les peptides, qui sont plus simples et moins coûteux que des anticorps et plus flexibles que les petites molécules, peuvent se lier à des interfaces de protéine et réguler IPP 4,5. Le marché mondial du peptide thérapeutique a été évalué autour de quinze milliards de dollars en 2013 et est en croissance de 10,5% annually 6. En outre, il ya plus de 50 peptides, commercialisés autour de 270 peptides dans les différentes phases des essais cliniques, et environ 400 peptides en phase préclinique avancé 7. Bien que de nombreux peptides sont utilisés comme médicaments, peptides posent encore plusieurs défis qui limitent leur application généralisée, y compris une faible biodisponibilité et la stabilité, l'inefficacité dans les membranes cellulaires de passage, et la flexibilité conformationnelle 8,9. Une alternative à surmonter ces inconvénients consiste à appliquer différentes modifications telles que (acide D-aminé et N-alkylation) local et global (cyclisation) 8,10-12 contraintes. Ces modifications se produisent aussi naturellement. Par exemple, la cyclosporine A, un peptide cyclique naturel immunosuppresseur, contient un acide D-aminé unique et subit des modifications N-alkylation 13,14.
La modification des acides aminés naturels à induire des contraintes locales, telles que D et N-alkylation, affecte souvent le peptide9, de l'activité biologique. Cependant, la cyclisation, dans laquelle la séquence d'intérêt peut rester le même, est plus susceptible de conserver une activité biologique. Cyclisation est un moyen très attractif pour restreindre l'espace conformationnel peptide en réduisant l'équilibre entre les différentes conformations. Il augmente généralement l'activité biologique et la sélectivité en limitant le peptide de la conformation active qui médie une seule fonction. La cyclisation améliore également la stabilité du peptide en maintenant le peptide dans une conformation qui est moins reconnu par les enzymes de dégradation. En effet, les peptides cycliques se sont avérés avoir une meilleure stabilité métabolique, la biodisponibilité et la sélectivité par rapport à leurs homologues linéaires 15-17.
Cependant, la cyclisation peut être une arme à double tranchant puisque, dans certains cas, la restriction peut empêcher les peptides d'atteindre une conformation bioactive. Pour surmonter cet obstacle, une bibliothèque ciblée dans laquelle tous les peptides ont la même sequenc primairee et par conséquent constants pharmacophores peuvent être synthétisés. Peptides dans la bibliothèque diffèrent des paramètres qui influent sur leur structure, tels que la taille et la position de l'anneau, afin de dépister la suite pour la conformation la plus bioactive 9,18.
Peptides peuvent être synthétisés à la fois en solution et une approche par synthèse peptidique en phase solide (SPPS), qui est maintenant l'approche de la synthèse des peptides plus répandue et seront discutés plus loin. SPPS est un processus par lequel les transformations chimiques sont réalisées sur un support solide par l'intermédiaire d'un lieur pour préparer une large gamme de composés synthétiques 19. SPPS permet d'assemblage peptides par couplage consécutif d'acides aminés par étapes à partir de l'extrémité C-terminale, qui est fixé à un support solide, à l'extrémité N-terminale. Les chaînes latérales d'acide N-a-aminés doivent être masqués par des groupes protecteurs qui sont stables dans les conditions réactionnelles utilisées au cours de l'allongement de peptide pour assurer l'addition d'un acide aminé par rep. Dans l'étape finale, le peptide est libéré de la résine et la chaîne latérale sont des groupes protecteurs de façon concomitante enlevé. Bien que le peptide est synthétisé, tous les réactifs solubles peuvent être éliminés à partir de la matrice de support solide de peptides par filtration et lavés à la fin de chaque étape de couplage. Avec un tel système, un grand excès de réactifs à forte concentration peut conduire les réactions de couplage à l'achèvement et à toutes les étapes de synthèse peuvent être effectuées dans le même récipient sans aucun transfert de matériel 20.
Bien SPPS a quelques limitations telles que la production de réactions incomplètes, des réactions secondaires, des réactifs impurs, ainsi que les difficultés de suivi de la réaction 21, les avantages de la SPPS ont fait le «gold standard» pour la synthèse peptidique. Ces avantages comprennent la possibilité d'incorporer des acides aminés non naturels, l'automatisation, la purification facile, pertes physiques réduites, et l'utilisation de réactifs en excès, résultant endes rendements élevés. SPPS a été montré pour être extrêmement utile dans la synthèse de séquences difficiles 21,22 fluorescents, des modifications 23 et des banques de peptides 24,25. SPPS est également très utile pour d'autres ensembles de poly-chaîne tels que des oligonucleotides, des oligosaccharides 28,29 26,27 et 30,31 acides nucléiques peptidiques. Fait intéressant, dans certains cas, SPPS a été montré qu'il était avantageux pour la synthèse de petites molécules qui sont traditionnellement fabriqués en solution 32,33. SPPS est utilisé à la fois sur une petite échelle pour la recherche et l'enseignement ainsi que 34,35 à grande échelle dans l'industrie 36-38.
Deux stratégies de synthèse qui sont utilisés principalement dans la méthode SPPS pour la synthèse de peptides sont butyloxycarbonyle (Boc) et 9-fluorénylméthoxycarbonyle (Fmoc). La stratégie originale a été introduit pour SPPS Boc, ce qui nécessite des conditions fortement acides pour éliminer la chaîne latérale et les groupes protecteurs de cliver le peptide de la resin. La synthèse des peptides à base de Fmoc, cependant, utilise des conditions modérées de base et est une alternative plus doux au protocole Boc labile en milieu acide 39. La stratégie Fmoc utilise de t-butyle (tBu) la protection de la chaîne latérale orthogonale qui est enlevée lors de la dernière étape de la synthèse tandis que le clivage du peptide de la résine dans des conditions acides.
Le principe général pour la synthèse peptidique sur support solide est présentée dans la figure 1. L'acide aminé initial, masqué par un groupe protecteur temporaire sur le N-α-terminale, est chargé sur la résine à partir de l'extrémité C-terminale. Un groupe protecteur semi-permanent pour masquer la chaîne latérale est également utilisé le cas échéant (figure 1, étape 1). La synthèse du peptide cible est assemblée à partir de l'extrémité C-terminale à l'extrémité N-terminale par des cycles répétitifs de déprotection du groupe protecteur N-α-temporaire (figure 1, étape 2) et de couplage du prochain acide aminé protégé (Figure 1 </str ong>, étape 3). Après le dernier acide aminé est chargé (Figure 1, étape 4), le peptide est clivé à partir du support de résine et les groupes protecteurs semi-permanentes sont enlevés (figure 1, étape 5).
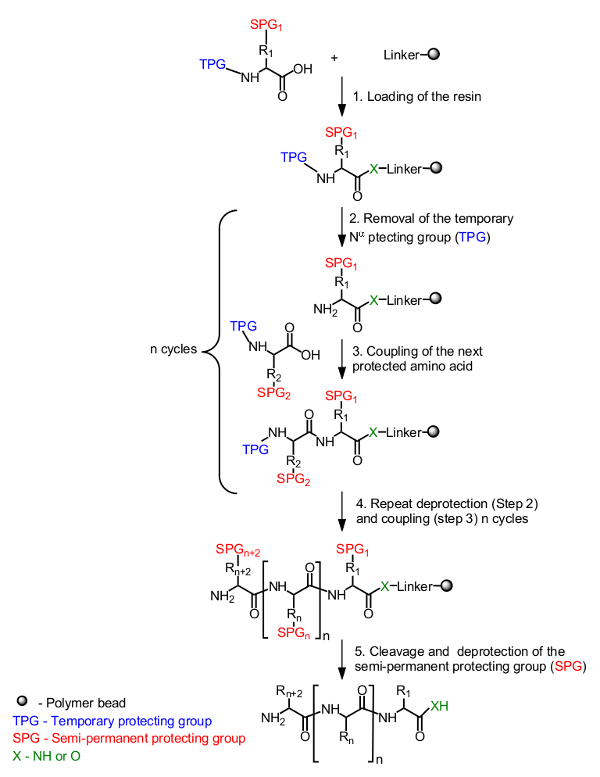
Figure 1. Schéma général de synthèse de peptides en phase solide. L'acide aminé N-α-protégé est ancrée à l'aide du groupe carboxyle par l'intermédiaire d'un lieur à la résine (étape 1). Le peptide souhaité est assemblé de manière linéaire à partir de l'extrémité C-terminale à l'extrémité N-terminale par des cycles répétitifs de déprotection du groupe temporaire de protection (TPG) à partir du N-α (étape 2) et le couplage d'acides aminés (étape 3). Après l'accomplissement de la synthèse (étape 4), les groupes protecteurs semi-permanents (SPG) sont déprotégés pendant clivage du peptide (étape 5).obtenir = "_ blank"> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Après assemblage de la chaîne peptidique complète, cyclisation peut être réalisé en plusieurs alternatives: (A) en tête-à-queue cyclisation – ce qui est un moyen pratique, mais limité, car il donne une seule option pour la cyclisation (figure 2A), (B) cyclisation en utilisant les acides aminés provenant de la séquence d'intérêt qui contiennent des groupes fonctionnels bioactifs – cependant, l'utilisation de ces acides aminés peut influer sur l'activité biologique (figure 2B), et (C) la cyclisation par addition d'acides aminés (ou d'autres éléments de base) sans perturber la séquence bioactive. L'introduction de ces molécules est très répandue car elle permet la production des banques focalisées sans modifier la séquence d'intérêt (figure 2C).
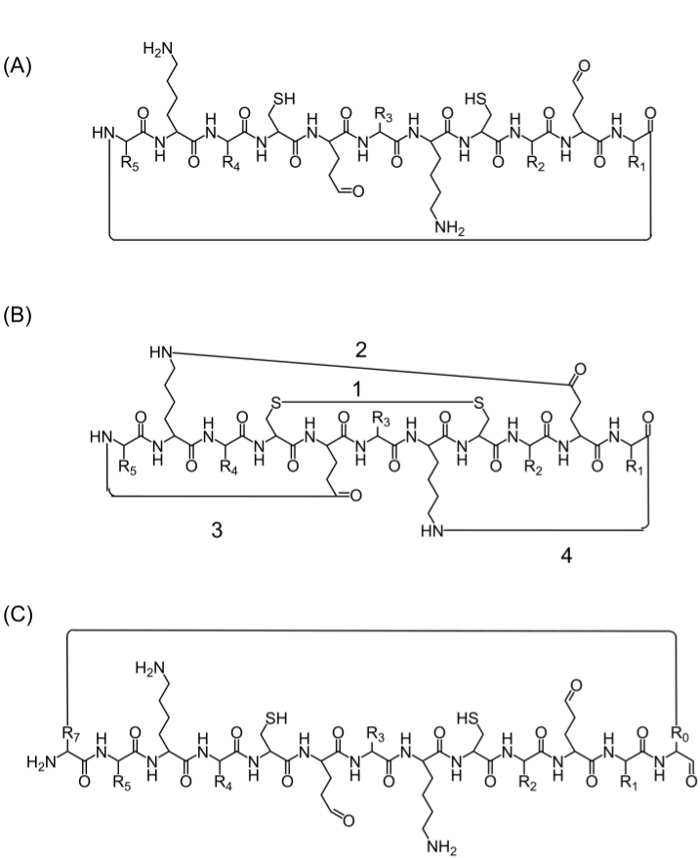
Figure 2. stratégies peptide alternatif de cyclisation (A) de tête à la queue cyclisation, par le biais d'une liaison peptidique entre l'extrémité C-terminale et N-terminale.; (B) la cyclisation entre les groupes fonctionnels comme une liaison disulfure entre les résidus de cysteine (1), ou une liaison amide entre les chaînes latérales de la lysine à aspartique / acide glutamique (2), ou une chaîne latérale d'extrémité N- ou C-terminale (3 -4); (C) cyclisation en ajoutant des acides aminés supplémentaires ou des dérivés d'acides aminés ou de petites molécules, par exemple avant (R0) et après (R7), la séquence bioactif. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Synthèse utilise irradiation micro-ondes pour chauffer réactions, accélérant ainsi chimique organique assistée par micro-ondes transformations 40,41. Chimie des micro-ondes est fondé sur la capacité du réactif / solvant pour absorber lemicro-ondes de l'énergie et le convertir en chaleur 42. Avant la technologie est répandue, des inconvénients majeurs ont dû être surmontés, y compris la contrôlabilité et la reproductibilité des protocoles de synthèse et le manque de systèmes disponibles pour température et de pression des contrôles adéquats 43,44. Le premier rapport de synthèse peptidique assistée par micro-ondes a été effectué en utilisant un four micro-ondes de cuisine pour synthétiser plusieurs peptides courts (7-10 acides aminés) avec une amélioration significative de l'efficacité de couplage et la pureté 45. De plus, l'énergie de micro-ondes a été montré pour diminuer l'agrégation de chaîne, de réduire les réactions secondaires, limiter la racémisation, et améliorer le taux de couplage, qui sont tous essentiels pour les séquences difficiles et longues 46-53.
Actuellement, l'utilisation de l'irradiation de micro-ondes pour la synthèse de peptides ou de composés apparentés sur un support solide est très étendue, y compris: (A) synthèse dans l'eau au lieu de 54 solvant organique; (B) synthèse de peptides avecmodifications post-traductionnelles communs, tels que les glycopeptides ou les phosphopeptides 59-61 55-58, dont la synthèse est typiquement difficile en raison de la faible efficacité de couplage de dérivés d'acides aminés à encombrement stérique; (C) la synthèse de peptides à modification dans le squelette, tels que azapeptides, qui peuvent être formés par le remplacement de la C (α) d'un résidu d'acide aminé par un atome d'azote 62, ou peptoïdes, dont la chaîne latérale est reliée à la amide de l'azote plutôt que l'atome Ca 63,64; (D) la synthèse de peptides cycliques 65-71; et (E) synthèse de bibliothèques combinatoires 51,72. Dans de nombreux cas, les auteurs ont rapporté une plus grande efficacité et une réduction du temps de synthèse en utilisant irradiation micro-ondes par rapport au protocole classique.
En utilisant une conception rationnelle 73-75, nous avons développé des peptides anti-parasitaires qui ont été tirées de la récepteurs de l'échafaud L eishmania for activé C-kinase (manque). MANQUE joue un rôle important dans la phase précoce de l'infection Leishmania 76. Les parasites exprimant des niveaux inférieurs de l'absence ne parviennent pas à parasiter les souris immunodéprimées même 77 que le manque est impliqué dans les processus de signalisation de parasites essentiels et la synthèse des protéines 78. Par conséquent, MANQUE est une protéine d'échafaudage clé 79 et une cible de médicament précieux. En se concentrant sur des séquences en manque qui sont conservés dans les parasites, mais pas chez l'hôte mammifère homologue RACK, nous avons identifié un peptide de 8 acides aminés (RNGQCQRK) que la diminution de Leishmania sp. Viabilité dans la culture.
Ici, nous décrivons un protocole pour la synthèse du squelette cyclique des peptides dérivés de la séquence de la protéine LACK décrit ci-dessus. Les peptides ont été synthétisés sur un support solide en utilisant un chauffage par micro-ondes par la méthode SPPS Fmoc avec protocole / tBu. Les peptides ont été conjugués à un TAT 47-57 (YGRKKRRQRRR) transporteur peptide par une liaison amide commepartie de la SPPS. Le transport d'une variété de cargaisons dans des cellules à base de TAT a été utilisé pendant plus de 15 ans et la livraison de la cargaison dans des organites intracellulaires a été confirmée 80. Quatre groupes de liaison différents, succinique et l'anhydride glutarique adipique, ainsi que et l'acide pimélique, ont été utilisés pour effectuer la cyclisation pour produire des lieurs d'acides carboxyliques de deux à cinq atomes de carbone. La cyclisation a été effectuée en utilisant une énergie hyperfréquence, et le clivage de la chaîne latérale et les dernières étapes de déprotection a été effectuée manuellement sans énergie micro-ondes. L'utilisation d'un synthétiseur automatisé de micro-ondes a amélioré la pureté du produit, a augmenté le rendement en produit, et de réduire la durée de la synthèse. Ce protocole général peut être appliqué à d'autres études qui utilisent des peptides de comprendre le mécanisme moléculaire important dans vitro et in vivo et de développer des médicaments potentiels pour des maladies humaines.
Protocol
Representative Results
Discussion
La synthèse d'une bibliothèque focalisée du squelette des peptides cycliques dérivés de la protéine LACK du parasite Leishmania utilisant un synthétiseur à micro-ondes est décrit entièrement automatisé. Une bibliothèque de peptides cycliques ciblée a été développé avec pharmacophores conservées et divers linkers. L'addition de divers agents de liaison tels que l'anhydride glutarique, l'anhydride succinique, l'acide adipique, l'acide pimélique, la lysine, l'ornithin…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous remercions Lauren Van Wassenhove, Sunhee Hwang, et Daria Mochly-Rosen pour des discussions utiles. Le travail a été soutenu par les Instituts nationaux de la santé NIH Grant RC4 TW008781-01 C-IDEA (SPARK) pour NQ Les bailleurs de fonds ne jouaient aucun rôle dans la conception de l'étude, la collecte et l'analyse des données, la décision de publier, ou de la préparation du manuscrit.
Materials
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic |
| Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. | |||
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′-tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’- | Sigma | 38370 | Caution Flammable/ Toxic |
| Diisopropylcarbodiimide (DIC) | |||
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Name | Company | Catalog Number | Comments |
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams™ nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials – micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP |
References
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Biochemistry. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Biochemistry. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O’Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using ‘safety catch’ methodology. J Vis Exp. (63), e4112 (2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based ‘building block’ approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O’Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis – A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710 (2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373 (2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).

