Utvikling av en Backbone Cyclic Peptide Library som Potential antiparasittisk Therapeutics Bruke Mikrobølgeovn Bestråling
Summary
A simple and general method for the synthesis of cyclic peptides using microwave irradiation is outlined. This procedure enables the synthesis of backbone cyclic peptides with a collection of different conformations while retaining the side chains and the pharmacophoric moieties., and therefore, allows to screen for the bioactive conformation.
Abstract
Protein-protein interaksjoner (PPI) er nært involvert i nesten alle biologiske prosesser, og er knyttet til mange menneskelige sykdommer. Derfor er det en stor innsats for å målrette PPIs i grunnforskning og i den farmasøytiske industrien. Protein-protein grensesnitt er vanligvis stor, flat, og mangler ofte lommer, kompliserer oppdagelsen av små molekyler som er rettet mot slike nettsteder. Alternative målretting tilnærminger som bruker antistoffer har begrensninger på grunn av dårlig oral biotilgjengelighet, lav celle permeabilitet, og produksjon ineffektivitet.
Ved hjelp av peptider for å målrette PPI grensesnitt har flere fordeler. Peptider har høyere konformasjonell fleksibilitet, øket selektivitet, og er generelt billig. Imidlertid peptider har sine egne begrensninger, inkludert dårlig stabilitet og ineffektivitet krysse cellemembraner. For å overvinne disse begrensningene, kan peptidet cyklisering utføres. Syklisering har vist seg å forbedre selektiviteten peptid, Metabolsk stabilitet og biotilgjengelighet. Imidlertid forutsi den bioaktive konformasjon av et cyklisk peptid er ikke trivielt. For å overvinne denne utfordringen, til en attraktiv tilnærming det screene en fokusert bibliotek til skjermen hvor alle ryggrad sykliske peptider ha samme primærsekvens, men varierer i parametere som påvirker deres konformasjon, for eksempel ringstørrelse og posisjon.
Vi beskriver en detaljert protokoll for å syntetisere et bibliotek med ryggrad sykliske peptider rettet mot spesifikke parasitt PPIer. Ved hjelp av en rasjonell design tilnærming, har vi utviklet peptider som stammer fra scaffoldprotein L eishmania reseptor for aktivert C-kinase (mangel). Vi antok at sekvenser i MANGEL som er bevart i parasitter, men ikke i pattedyrverts homolog, kan representere interaksjons nettsteder for proteiner som er avgjørende for parasittene 'levedyktighet. De cykliske peptider ble syntetisert ved anvendelse av mikrobølgebestråling for å redusere reaksjonstiden og økeeffektivitet. Utvikle et bibliotek av ryggraden sykliske peptider med forskjellige ringstørrelser letter et systematisk skjerm for de mest biologisk aktive konformasjon. Denne metoden gir en generell, rask og lettvint måte å syntetisere cykliske peptider.
Introduction
Protein-protein interaksjoner (PPI) spiller en sentral rolle i de biologiske prosesser, fra intracellulær signaltransduksjon til celledød 1. Derfor målretting PPIs er av fundamental betydning for grunnleggende forskning og terapeutiske anvendelser. PPIer kan reguleres ved spesifikke antistoffer og stabile, men antistoffer som er dyre og vanskelige å fremstille og har dårlig biotilgjengelighet. Alternativt kan PPIs bli målrettet av små molekyler. Små molekyler som er lettere å syntetisere og billig i forhold til antistoffer; men de er forholdsvis mindre fleksibelt og passer bedre til små hulrom enn i store protein-protein-grensesnitt 2,3. Ulike studier har demonstrert at peptider, som er enklere og billigere enn antistoffene og mer fleksible enn små molekyler, kan binde proteingrenseflater og regulere PPIer 4,5. Den globale terapeutisk peptid markedet ble verdsatt rundt femten milliarder dollar i 2013 og vokser 10,5% annually 6. Videre er det mer enn 50 markeds peptider, rundt 270 peptider i ulike faser av klinisk testing, og ca 400 peptider i avanserte prekliniske faser 7. Selv om mange peptider blir brukt som narkotika, peptider fortsatt utgjøre flere utfordringer som begrenser deres utbredt program blant annet dårlig biotilgjengelighet og stabilitet, ineffektivitet i krysset cellemembraner, og conformational fleksibilitet 8,9. Et alternativ til å overvinne disse ulemper, er å bruke forskjellige modifikasjoner som lokal (D-aminosyren og N-alkylering) og global (cyklisering) begrensninger 8,10-12. Disse endringene forekommer også naturlig. For eksempel cyklosporin A, en immunosuppressant cyklisk naturlig peptid, inneholder en enkelt D-aminosyre og gjennomgår N-alkylerings modifikasjoner 13,14.
Modifikasjon av naturlige aminosyrer for å fremkalle lokale begrensninger, slik som D- og N-alkylering, ofte påvirker peptid9; s biologisk aktivitet. Men ringslutning, karakterisert ved at sekvensen av interesse kan være den samme, er det mer sannsynlig å bevare biologisk aktivitet. Ringslutning er en meget attraktiv måte å begrense peptid konformasjonell plass ved å redusere likevekt mellom forskjellige konformasjoner. Det øker vanligvis biologisk aktivitet og selektivitet ved å begrense peptidet til den aktive konformasjon som formidler bare en funksjon. Syklisering forbedrer også stabiliteten peptid ved å holde peptidet i en konformasjon som er mindre kjennes av nedbrytende enzymer. Faktisk ble sykliske peptider vist å ha forbedret metabolsk stabilitet, biotilgjengelighet, og selektivitet i forhold til sine lineære kolleger 15-17.
Imidlertid kan ringslutning være et tveegget sverd fordi det i noen tilfeller begrensningen kan hindre peptidene fra å oppnå et bioaktivt konformasjon. For å overvinne dette hinderet, et fokusert bibliotek hvor alle peptider som har samme primær-sekvensene og dermed konstant pharmacophores kan syntetiseres. Peptider i biblioteket forskjellig parametre som påvirker strukturen, slik som ring størrelse og posisjon, for deretter å screene for de bioaktive konformasjon 9,18.
Peptider kan syntetiseres både i oppløsning og ved en fast-fase peptidsyntese (SPPS) tilnærming, som nå er mer utbredt peptidsyntesen tilnærming og vil bli nærmere omtalt. SPPS er en prosess der kjemiske omdannelser utføres på en fast bærer via en linker for å fremstille et bredt spekter av 19 syntetiske forbindelser. SPPS muliggjør montering av peptider ved suksessiv kobling av aminosyrer på en trinnvis måte fra den C-terminale ende, som er festet til en fast bærer, til den N-terminale ende. De N-a-aminosyre-sidekjeder må være maskert med beskyttelsesgrupper som er stabile i de reaksjonsbetingelser som anvendes under peptid forlengelse for å sikre at tilsetning av en aminosyre pr step. I det siste trinnet blir peptidet frigjort fra harpiksen og sidekjedebeskyttende grupper samtidig fjernes. Mens peptidet blir syntetisert, kan alle oppløselige reagenser fjernes fra peptid-faststoffbærermassen ved filtrering og vasket bort ved slutten av hvert koblingstrinn. Med et slikt system kan et stort overskudd av reagenser ved høy konsentrasjon drive koblingsreaksjoner til ferdigstillelse og alle de syntesetrinn kan utføres i samme kar uten noen overføring av materiale 20.
Selv SPPS har noen begrensninger som for eksempel produksjon av ufullstendige reaksjoner, sidereaksjoner, urene reagenser, samt vanskeligheter med å overvåke reaksjons 21, har fordelene av SPPS gjort det "gullstandard" for peptidsyntese. Disse fordeler innbefatter muligheten til å inkorporere ikke-naturlige aminosyrer, automasjon, lett rensing, minimeres fysiske tap, og bruken av overskudd av reagenser, noe som resulterer ihøye utbytter. SPPS har vist seg å være svært nyttig i syntesen av vanskelige sekvenser 21,22, fluorescerende modifiseringer 23, og peptid bibliotek 24,25. SPPS er også svært nyttig for andre poly-kjeden forsamlinger som oligonukleotider 26,27, oligosakkarider 28,29 og peptid nukleinsyrer 30,31. Interessant, i noen tilfeller, ble SPPS vist seg å være fordelaktig for syntese av små molekyler som er tradisjonelt laget i oppløsning 32,33. SPPS brukes både i liten skala for forskning og undervisning 34,35 samt stor skala i bransjen 36-38.
To syntese strategier som brukes hovedsakelig i SPPS metodikk for syntese av peptider er butyloxycarbonyl (Boc) og 9-fluorenylmetoksykarbonyl (Fmoc). Den opprinnelige strategi innført SPPS var Boc, noe som krever sterke sure betingelser for å fjerne sidekjedebeskyttende grupper, og spalter peptidet fra rEsin. Fmoc-baserte peptidsyntese, men anvender moderate betingelser for base, og er en mildere alternativ til syrelabile Boc-protokollen 39. Fmoc-strategien anvender ortogonale t-butyl (tBu) side-kjedebeskyttelse som er fjernet i det siste trinnet av syntesen, mens spalte peptidet fra harpiksen under sure betingelser.
Det generelle prinsipp for peptidsyntese i fast bærer er presentert i figur 1. Den første aminosyre, maskert av en midlertidig beskyttende gruppe på N-α-terminus, er satt inn på harpiksen fra C-terminus. En semi-permanent beskyttende gruppe for å maskere sidekjeden brukes også om nødvendig (figur 1, trinn 1). Syntesen av mål-peptidet er satt sammen fra den C-terminale enden til den N-terminale ende ved gjentatte sykluser av avbeskyttelse av N-α-midlertidig beskyttelsesgruppen (figur 1, trinn 2) og kobling av den neste beskyttede aminosyre (figur 1 </str ong>, trinn 3). Etter at den siste aminosyren er lastet inn (figur 1, trinn 4), blir peptidet spaltet fra harpiksbæreren og de semi-permanente beskyttende grupper er fjernet (figur 1, trinn 5).
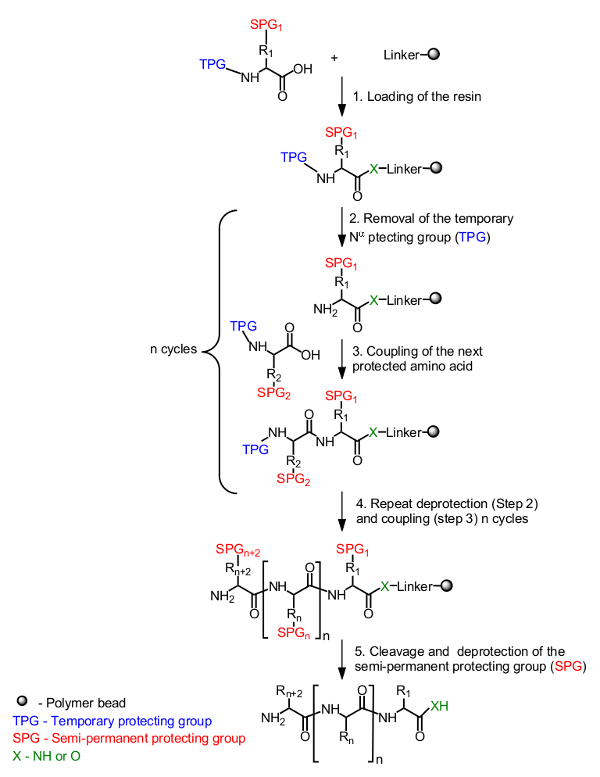
Figur 1. Generell ordningen fastfasepeptidsyntese. Er N-α-beskyttet aminosyre forankret ved hjelp av karboksylgruppen via en linker til harpiksen (trinn 1). Det ønskede peptid er montert på en lineær måte fra den C-terminale enden til den N-terminale ende ved gjentatte sykluser av avbeskyttelse av den midlertidige beskyttelsesgruppen (TPG) fra N-α (trinn 2) og aminosyresekvensen kopling (trinn 3). Etter oppnåelse av syntesen (trinn 4), blir de semi-permanente beskyttende grupper (SPG) avbeskyttes under spalting peptid (trinn 5).få = "_ blank"> Klikk her for å se en større versjon av dette tallet.
Etter montering av komplett peptidkjeden kan cykliseringen oppnås ved flere alternativer: (a) head-to-tail syklisering – Dette er en praktisk måte, men begrenset, siden det gir bare ett alternativ for cykliseringen (Figur 2A), (B) syklisering ved hjelp av aminosyrene fra sekvensen av interesse som inneholder bioaktive funksjonelle grupper – men bruken av disse aminosyrer kan påvirke den biologiske aktivitet (figur 2B), og (C) cyklisering ved tilsetning av aminosyrer (eller andre byggeklosser) uten å forstyrre det bioaktive sekvens. Vi presenterer disse molekylene er utbredt som det tillater produksjon av fokusert biblioteker uten å endre rekkefølgen av interesse (figur 2C).
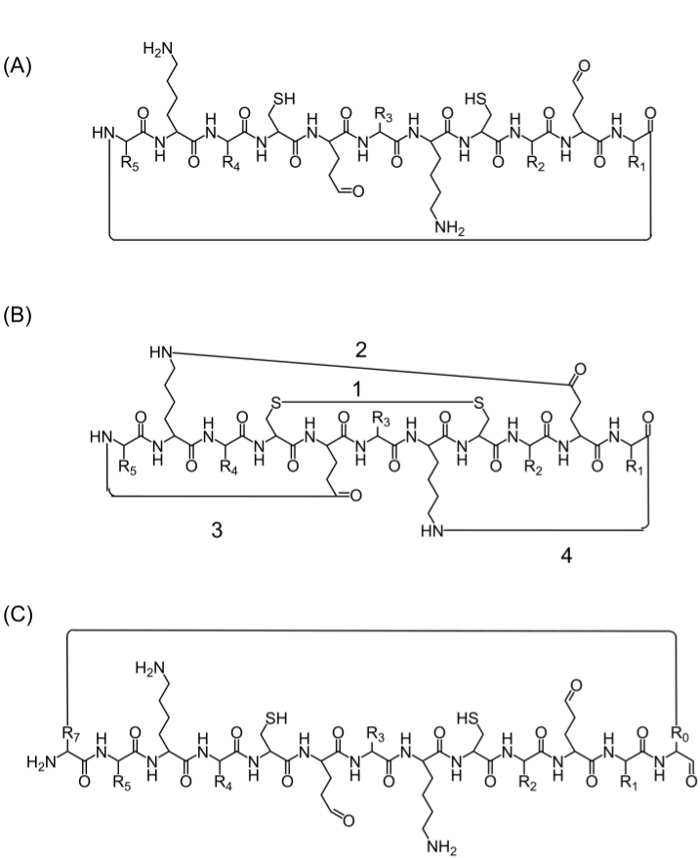
Figur 2. Alternative strategier cykle peptid (A) hode til hale ringslutning, via en peptid-binding mellom C-terminalen og N-terminalen.; (B) cyklisering mellom funksjonelle grupper som for eksempel en disulfidbinding mellom cystein-rester (1), eller en amidbinding mellom sidekjedene av lysin til asparaginsyre / glutaminsyre (2) eller sidekjeden til N- eller C-terminale ende (3 -4); (C) syklisering ved å legge ekstra aminosyrer eller aminosyrederivater eller små molekyler, for eksempel før (R0) og etter (R7) den bioaktive sekvens. Klikk her for å se en større versjon av dette tallet.
Mikrobølgeassistert syntese benytter mikrobølgestråling til å varme reaksjoner, og dermed akselerere organiske kjemiske transformasjoner 40,41. Mikrobølgekjemi er basert på evnen av reagenset / løsningsmiddel for å absorberemikrobølgeenergi og konvertere den til å varme 42. Før teknologien ble utbredt, store ulemper måtte overvinnes, herunder kontrollerbarhet og reproduserbarheten av synteseprotokoller og mangel på tilgjengelige systemer for tilstrekkelig temperatur og trykk kontroller 43,44. Den første rapporten om mikrobølgeassistert peptidsyntese ble utført ved anvendelse av en kjøkken mikrobølgeovn for å syntetisere flere korte peptider (7-10 aminosyrer) med betydelig forbedring av koblingsgraden og renheten 45. Dessuten, ble mikrobølgeenergi vist å redusere kjede aggregering, redusere sidereaksjoner, begrenser racemisering, og forbedrer koblingsrater, som alle er kritiske for vanskelige og lange sekvenser 46-53.
Dag ved bruk av mikrobølgebestråling for syntese av peptider eller beslektede forbindelser på en fast bærer er omfattende, blant (A) syntese i vann i stedet for organiske oppløsningsmiddel 54; (B) syntese av peptider medvanlig post-translasjonelle modifikasjoner, så som 55-58 glykopeptider eller fosfor 59-61, hvis syntese er vanligvis vanskelig på grunn av den lave koblingsgrad på sterisk hindrede aminosyrederivater; (C) Syntese av peptider med endring i ryggraden, slik som azapeptides, som kan dannes ved erstatning av C (α) for en aminosyrerest med et nitrogenatom 62 eller peptoids, hvis sidekjede er forbundet med amidnitrogenet snarere enn Cα atom 63,64; (D) Syntese av sykliske peptider 65-71; og (E) Syntese av kombinatoriske bibliotek 51,72. I mange tilfeller forfatterne rapporterte høyere effektivitet og redusert syntese tid ved hjelp av mikrobølgebestråling i forhold til den konvensjonelle protokollen.
Ved hjelp av en rasjonell design 73-75, har vi utviklet anti-parasittiske peptider som ble avledet fra stillaset L eishmania sin reseptor for aktivert C-kinase (mangel). MANGEL spiller en viktig rolle i den tidlige fasen av Leishmania infeksjon 76. Parasitter uttrykker lavere nivåer av MANGEL klarer å parasitize selv med svekket immunforsvar mus 77 som mangler er involvert i viktige parasittsignale prosesser og proteinsyntese 78. Derfor er MANGEL en nøkkel scaffoldprotein 79 og et verdifullt stoff målet. Fokusering på sekvenser i MANGEL som er bevart i parasittene, men ikke i verts pattedyr homolog RACK, identifiserte vi en 8 aminosyrepeptid (RNGQCQRK) at redusert Leishmania sp. Levedyktighet i kultur.
Her beskriver vi en protokoll for syntese av ryggraden sykliske peptider avledet fra mangelen proteinsekvensen som er beskrevet ovenfor. Peptidene ble syntetisert på en fast bærer ved hjelp av mikrobølgeoppvarming ved SPPS metodikk med Fmoc / tBu-protokollen. Peptider ble konjugert til en TAT 47-57 (YGRKKRRQRRR) bærerpeptid gjennom en amidbinding sådel av SPPS. TAT-baserte transport av en rekke av last inn i celler har vært brukt i over 15 år, og levering av lasten til subcellulære organeller har blitt bekreftet 80. Fire forskjellige linkere, ravsyre og glutarsyreanhydrid, samt adipinsyre og pimelinsyre, ble brukt til å utføre ringslutningen for å generere karboksylsyre-linkere på to til fem karbonatomer. Ringslutning ble gjort ved hjelp av mikrobølgeenergi, og de endelige cleavage og sidekjede-avbeskyttelsestrinn var gjort manuelt uten mikrobølgeenergi. Bruk av en automatisert syntetisator mikrobølge forbedret produktrenhet, økt produktutbytte, og redusert varighet av syntesen. Denne generelle protokoll kan anvendes for andre studier som anvender peptider for å forstå viktige molekylære mekanismen in vitro og in vivo og videreutvikle potensielle legemidler for sykdommer hos mennesker.
Protocol
Representative Results
Discussion
Syntesen av et fokusert bibliotek av ryggraden sykliske peptider avledet fra mangel protein av Leishmania parasitten ved hjelp av en helautomatisk mikrobølgeovn syntetisator er beskrevet. En fokusert bibliotek av sykliske peptider ble utviklet med konserverte pharmacophores og ulike forbindelsesledd. Tilsetning av forskjellige linkere som glutarsyreanhydrid, ravsyreanhydrid, adipinsyre, pimelinsyre, lysin, ornitin, og andre byggeklosser kan anvendes for å øke variasjonen av den konformasjonelle plass av de s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker Lauren Van Wassenhove, Sunhee Hwang, og Daria Mochly-Rosen for nyttige diskusjoner. Arbeidet ble støttet av National Institutes of Health Grant NIH RC4 TW008781-01 C-IDEA (SPARK) til NQ De organer hadde ingen rolle i studiedesign, datainnsamling og analyse, beslutning om å publisere, eller utarbeidelse av manuskriptet.
Materials
| REAGENTS | |||
| Solid support, Rink Amide AM resin ML | CBL | BR-1330 | loading: 0.49 mmol/g |
| Fmoc-Ala-OH | Advanced Chemtech | FA2100 | |
| Fmoc-Arg(Pbf)-OH | Advanced Chemtech | FR2136 | |
| Fmoc-Asn(Trt)-OH | Advanced Chemtech | FN2152 | |
| Fmoc-Asp(OBut)-OH | Advanced Chemtech | FD2192 | |
| Fmoc-Cys(Trt)-OH | Advanced Chemtech | FC2214 | |
| Fmoc-Gln(Trt)-OH | Advanced Chemtech | FQ2251 | |
| Fmoc-Glu(OtBu)-OH | Advanced Chemtech | FE2237 | |
| Fmoc-Gly-OH | Advanced Chemtech | FG2275 | |
| Fmoc-His(Trt)-OH | Advanced Chemtech | FH2316 | |
| Fmoc-Ile-OH | Advanced Chemtech | FI2326 | |
| Fmoc-Leu-OH | Advanced Chemtech | FL2350 | |
| Fmoc-Lys(Boc)-OH | Advanced Chemtech | FK2390 | |
| Fmoc-Met-OH | Advanced Chemtech | FM2400 | |
| Fmoc-Phe-OH | Advanced Chemtech | FF2425 | |
| Fmoc-Pro-OH | Advanced Chemtech | FP2450 | |
| Fmoc-Ser-(tBu)-OH | Advanced Chemtech | FS2476 | |
| Fmoc-Thr(tBu)-OH | Advanced Chemtech | FT2518 | |
| Fmoc-Trp(Boc)-OH | Advanced Chemtech | FW2527 | |
| Fmoc-Tyr(But)-OH | Advanced Chemtech | FY2563 | |
| Fmoc-Val-OH | Advanced Chemtech | FV2575 | |
| 1-Methyl-2-pyrrolidinone (NMP) | Sigma | 328634 | Caution Toxic/Highly flammable/Irritant. |
| N,N-Dimethylformamide (DMF) | Alfa Aesar | 43465 | Caution Toxic |
| Use high quality DMF to eliminate side reactions such as Fmoc removal as a result of the dimethylamine traces from DMF decomposition. | |||
| Dichloromethane (DCM) | Sigma | D65100 | Caution Harmful |
| Dibromomethane (DBM) | Sigma | D41868 | Caution Harmful |
| Trifluoroacetic acid (TFA) | Sigma | T62200 | Caution Corrosive/Toxic |
| Trifluoroacetic acid, HPLC grade (TFA) | Sigma | 91707 | Caution Corrosive/Toxic |
| Diethylether | Sigma | 31690 | Caution Highly flammable/Harmful |
| Triisopropylsilane (TIS) | Sigma | 233781 | Caution Irritant/Flammable |
| Water, HPLC grade | Sigma | 270733 | |
| Acetonitroile, HPLC grade (ACN) | Fisher Scientific | A998-4 | Caution Flammable/Irritant/Harmful |
| N,N-Diisopropylethylamine (DIEA) | Sigma | 3440 | Caution Corrosive/Highly flammable |
| Piperidine | Sigma | W290807 | Caution Toxic/Highly flammable |
| Pyridine | Sigma | 270970 | Caution Highly flammable/Harmful |
| Ethanol (EtOH) | Sigma | 459844 | Caution Highly flammable/Irritant |
| 1-Hydroxybenzotriazole hydrate (HOBt) | Sigma | 157260 | Caution Highly flammable/Irritant/Harmful |
| O-(Benzotriazol-1-yl)-N,N,N′,N′-tetramethyluronium hexafluorophosphate (HBTU) | Sigma | 12804 | Caution Irritant/Harmful |
| Benzotriazole-1-ly-oxy-tris-pyrrolidinophosphonium hexafluorphosphate (PyBOP) | Advanced Chemtech | RC8602 | Caution Irritant |
| Ninhydrin | Sigma | 454044 | Caution Harmful |
| Phenol | Sigma | P3653 | Caution Corrosive/Toxic |
| Potassium cyanide (KCN) | Sigma | 11813 | Caution Very Toxic |
| Potassium hydroxide (KOH) | Sigma | 221473 | Caution Toxic |
| N,N’- | Sigma | 38370 | Caution Flammable/ Toxic |
| Diisopropylcarbodiimide (DIC) | |||
| 4-Dimethylaminopyridine (DMAP) | Sigma | 522805 | Caution Toxic/Irritant |
| Glutaric anhydride | Sigma | G3806 | Caution Flammable/Irritant/Harmful |
| Succinic anhydride | Sigma | 239690 | Caution Irritant/Harmful |
| Adipic acid | Sigma | A26357 | Caution Toxic/Irritant |
| Pimelic acid | Sigma | P45001 | Caution Toxic/Irritant |
| Chloranil | Sigma | 23290 | Caution Toxic/Irritant |
| Acetaldehyde | Sigma | 402788 | Caution Flammable/ Toxic |
| EQUIPMENT | |||
| Name | Company | Catalog Number | Comments |
| Centrifuge | Beckman Coulter | Allegra 6R centrifuge | |
| Lyophilizer | Labconco | freezone 4.5 | |
| Vacuum pump | Franklin Electric | model 1101101416 with 3/4 HP | Alcatel pump with Franklin Motor |
| Polypropylene cartridge 12 ml | Applied Separation | 2419 | |
| Cap plug for 12 ml polypropylene cartridge | Applied Separation | 8157 | |
| Polypropylene cartridge 3 ml | Applied Separation | 2413 | |
| Cap plug for 3 ml polypropylene cartridge | Applied Separation | 8054 | |
| Stop cocks PTFE | Applied Separation | 2406 | |
| Tubes flat, 50 ml | VWR | 21008-240 | |
| Extraction manifold, 20 pos, 16 x 100 mm tubes | Waters | WAT200609 | |
| Shaker, BD adams™ nutator mixer | Fisher scientific | 22363152 | |
| Nalgene HDPE narrow mouth IP2 bottles, 125 ml | Fisher scientific | 03-312-8 | |
| Erlenmeyer flask | Fisher Scientific | FB-501, 500 ml | |
| Heating block | Thermolyne | 1760 dri bath | |
| Disposable borosilicate glass tubes with plain end | Fisher Scientific | 14-961-25 | |
| Micropipettes and tips Finnpipette | Thermo | 20–200 and 100–1,000 μl | |
| HPLC vials – micro vl pp 400 µl PK100 | VWR | 69400-124 | |
| HPLC vial- Blue Snap-It Cap | VWR | 66030-600 | |
| Analytical HPLC column | Peeke Scientific | U1-5C18Q-JJ | ultro 120 5 µm C18Q, 4.6 mm ID 150 mm |
| Prep HPLC column, XBridge | Waters | OBD C18 5 µm column | 19 mm × 150 mm |
| Mass spectrometer | Applied Biosystems | Voyager DE-RP |
References
- Wells, J. A., McClendon, C. L. Reaching for high-hanging fruit in drug discovery at protein-protein interfaces. Nature. 450 (7172), 1001-1009 (2007).
- Arkin, M. R., Wells, J. A. Small-molecule inhibitors of protein-protein interactions: progressing towards the dream. Nat Rev Drug Discov. (4), 301-317 (2004).
- Mandell, D. J., Kortemme, T. Computer-aided design of functional protein interactions. Nat. Chem. Biol. 5 (11), 797-807 (2009).
- Friedler, A., et al. Backbone cyclic peptide, which mimics the nuclear localization signal of human immunodeficiency virus type 1 matrix protein, inhibits nuclear import and virus production in nondividing cells. Biochemistry. 37 (16), 5616-5622 (1998).
- Brandman, R., Disatnik, M. H., Churchill, E., Mochly-Rosen, D. Peptides derived from the C2 domain of protein kinase C epsilon (epsilon PKC) modulate epsilon PKC activity and identify potential protein-protein interaction surfaces. J. Biol. Chem. 282 (6), 4113-4123 (2007).
- Vlieghe, P., Lisowski, V., Martinez, J., Khrestchatisky, M. Synthetic therapeutic peptides: science and market. Drug discov today. 15 (1-2), 40-56 (2010).
- Marx, V. Watching Peptide Drugs Grow Up. Chemical & Engineering News. 83, 17-24 (2005).
- Denicourt, C., Dowdy, S. F. Medicine. Targeting apoptotic pathways in cancer cells. Science. 305 (5689), 1411-1413 (2004).
- Qvit, N., et al. Synthesis of a novel macrocyclic library: discovery of an IGF-1R inhibitor. J Comb Chem. 10 (2), 256-266 (2008).
- Patch, J. A., Barron, A. E. Mimicry of bioactive peptides via non-natural, sequence-specific peptidomimetic oligomers. Curr. Opin. Chem. Biol. 6 (6), 872-877 (2002).
- Kessler, H. Peptide Conformations .19. Conformation and Biological-Activity of Cyclic-Peptides. Angew. Chem. Int. Ed. Engl. 21 (7), 512-523 (1982).
- Gazal, S., Gelerman, G., Gilon, C. Novel Gly building units for backbone cyclization: synthesis and incorporation into model peptides. Peptides. 24 (12), 1847-1852 (2003).
- Fesik, S. W., et al. NMR studies of [U-13C]cyclosporin A bound to cyclophilin: bound conformation and portions of cyclosporin involved in binding. Biochemistry. 30 (26), 6574-6583 (1991).
- Kornfeld, O. S., et al. Mitochondrial Reactive Oxygen Species at the Heart of the Matter: New Therapeutic Approaches for Cardiovascular Diseases. Circ. Res. 116 (11), 1783-1799 (2015).
- Boguslavsky, V., Hruby, V. J., O’Brien, D. F., Misicka, A., Lipkowski, A. W. Effect of peptide conformation on membrane permeability. J. Pept. Res. 61 (6), 287-297 (2003).
- Eguchi, M., et al. Solid-phase synthesis and structural analysis of bicyclic beta-turn mimetics incorporating functionality at the i to i+3 positions. J. Am. Chem. Soc. 121 (51), 12204-12205 (1999).
- Altstein, M., et al. Backbone cyclic peptide antagonists, derived from the insect pheromone biosynthesis activating neuropeptide, inhibit sex pheromone biosynthesis in moths. J. Biol. Chem. 274 (25), 17573-17579 (1999).
- Cheng, M. F., Fang, J. M. Liquid-phase combinatorial synthesis of 1,4-benzodiazepine-2,5-diones as the candidates of endothelin receptor antagonism. J. Comb. Chem. 6 (1), 99-104 (2004).
- Merrifield, R. B. Solid Phase Peptide Synthesis I. the Synthesis of a Tetrapeptide. J. Am. Chem. Soc. 85, 2149-2154 (1963).
- Pfeiffer, C. T., Schafmeister, C. E. Solid phase synthesis of a functionalized bis-peptide using ‘safety catch’ methodology. J Vis Exp. (63), e4112 (2012).
- Coin, I., Beyermann, M., Bienert, M. Solid-phase peptide synthesis: from standard procedures to the synthesis of difficult sequences. Nat. Protoc. 2 (12), 3247-3256 (2007).
- Qvit, N., et al. Design and synthesis of backbone cyclic phosphorylated peptides: the IκB model. Biopolymers. 91 (2), 157-168 (2009).
- Sainlos, M., Imperiali, B. Tools for investigating peptide-protein interactions: peptide incorporation of environment-sensitive fluorophores through SPPS-based ‘building block’ approach. Nat. Protoc. 2 (12), 3210-3218 (2007).
- Hilpert, K., Winkler, D. F., Hancock, R. E. Peptide arrays on cellulose support: SPOT synthesis, a time and cost efficient method for synthesis of large numbers of peptides in a parallel and addressable fashion. Nat. Protoc. 2 (6), 1333-1349 (2007).
- Qi, X., Qvit, N., Su, Y. C., Mochly-Rosen, D. A novel Drp1 inhibitor diminishes aberrant mitochondrial fission and neurotoxicity. J. Cell Sci. 126 (Pt 3), 789-802 (2013).
- Beaucage, S. L. Solid-phase synthesis of siRNA oligonucleotides. Curr. Opin. Drug Discovery Dev. 11 (2), 203-216 (2008).
- Dhanawat, M., Shrivastava, S. K. Solid-Phase Synthesis of Oligosaccharide Drugs: A Review. Mini Rev Med Chem. 9 (2), 169-185 (2009).
- Seeberger, P. H., Werz, D. B. Synthesis and medical applications of oligosaccharides. Nature. 446 (7139), 1046-1051 (2007).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid-phase synthesis of oligosaccharides. Science. 291 (5508), 1523-1527 (2001).
- Komiyama, M., Aiba, Y., Ishizuka, T., Sumaoka, J. Solid-phase synthesis of pseudo-complementary peptide nucleic acids. Nat. Protoc. 3 (4), 646-654 (2008).
- Christensen, L., et al. Solid-Phase synthesis of peptide nucleic acids. J. Pept. Sci. 1 (3), 175-183 (1995).
- Qvit, N., et al. Development of bifunctional photoactivatable benzophenone probes and their application to glycoside substrates. Biopolymers. 90 (4), 526-536 (2008).
- O’Neill, J. C., Blackwell, H. E. Solid-phase and microwave-assisted syntheses of 2,5-diketopiperazines: small molecules with great potential. Comb Chem High Throughput Screen. 10 (10), 857-876 (2007).
- Qvit, N., Barda, Y., Shalev, D., Gilon, C. A Laboratory Preparation of Aspartame Analogs Using Simultaneous Multiple Parallel Synthesis Methodology. J. Chem. Educ. 84 (12), 1988-1991 (2007).
- Truran, G. A., Aiken, K. S., Fleming, T. R., Webb, P. J., Markgraf, J. H. Solid phase organic synthesis and combinatorial chemistry: A laboratory preparation of oligopeptides. J. Chem. Educ. 79 (1), 85-86 (2002).
- Verlander, M. Industrial applications of solid-phase peptide synthesis – A status report. Int. J. Pept. Res. Ther. 13 (1-2), 75-82 (2007).
- Bray, B. L. Large-scale manufacture of peptide therapeutics by chemical synthesis. Nature reviews. Drug discovery. 2 (7), 587-593 (2003).
- Qvit, N. Development and therapeutic applications of oligonucleotides and peptides. chimica Oggi / CHEMISTRY today. 29 (2), 4-7 (2011).
- Carpino, L. A., Han, G. Y. 9-Fluorenylmethoxycarbonyl Amino-Protecting Group. J. Org. Chem. 37 (22), 3404-3409 (1972).
- Gedye, R., et al. The use of microwave ovens for rapid organic synthesis. Tetrahedron Lett. 27 (3), 279-282 (1986).
- Giguere, R. J., Bray, T. L., Duncan, S. M., Majetich, G. Application of commercial microwave ovens to organic synthesis. Tetrahedron Lett. 27 (41), 4945-4948 (1986).
- Kappe, C. O., Dallinger, D. The impact of microwave synthesis on drug discovery. Nature reviews. Drug discovery. 5 (1), 51-63 (2006).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angew. Chem. Int. Ed. Engl. 43 (46), 6250-6284 (2004).
- de la Hoz, A., Diaz-Ortiz, A., Moreno, A. Microwaves in organic synthesis. Thermal and non-thermal microwave effects. Chem. Soc. Rev. 34 (2), 164-178 (2005).
- Yu, H. M., Chen, S. T., Wang, K. T. Enhanced coupling efficiency in solid-phase peptide synthesis by microwave irradiation. J. Org. Chem. 57 (18), 4781-4784 (1992).
- Mingos, D. M. P., Baghurst, D. R. Tilden Lecture. Applications of microwave dielectric heating effects to synthetic problems in chemistry. Chem. Soc. Rev. 20 (1), 1-47 (1991).
- Gabriel, C., Gabriel, S., Grant, E. H., Halstead, B. S. J., Mingos, D. M. P. Dielectric parameters relevant to microwave dielectric heating. Chem. Soc. Rev. 27 (3), 213-224 (1998).
- Sabatino, G., Papini, A. M. Advances in automatic, manual and microwave-assisted solid-phase peptide synthesis. Curr. Opin. Drug Discovery Dev. 11 (6), 762-770 (2008).
- Banerjee, J., Hanson, A. J., Muhonen, W. W., Shabb, J. B., Mallik, S. Microwave-assisted synthesis of triple-helical, collagen-mimetic lipopeptides. Nat. Protoc. 5 (1), 39-50 (2010).
- Bacsa, B., Kappe, C. O. Rapid solid-phase synthesis of a calmodulin-binding peptide using controlled microwave irradiation. Nat. Protoc. 2 (9), 2222-2227 (2007).
- Murray, J. K., Gellman, S. H. Parallel synthesis of peptide libraries using microwave irradiation. Nat. Protoc. 2 (3), 624-631 (2007).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. J Pept Sci. 13 (3), 143-148 (2007).
- Murray, J. K., Aral, J., Miranda, L. P. Solid-Phase Peptide Synthesis Using Microwave Irradiation. Methods Mol. Biol. 716, 73-88 (2011).
- Galanis, A. S., Albericio, F., Grotli, M. Solid-Phase Peptide Synthesis in Water Using Microwave-Assisted Heating. Organic Letters. 11 (20), 4488-4491 (2009).
- Rizzolo, F., Sabatino, G., Chelli, M., Rovero, P., Papini, A. M. A convenient microwave-enhanced solid-phase synthesis of difficult peptide sequences: Case study of Gramicidin A and CSF114(Glc). Int. J. Pept. Res. Ther. 13 (1-2), 203-208 (2007).
- Matsushita, T., Hinou, H., Kurogochi, M., Shimizu, H., Nishimura, S. Rapid microwave-assisted solid-phase glycopeptide synthesis. Org Lett. 7 (5), 877-880 (2005).
- Nagaike, F., et al. Efficient microwave-assisted tandem N- to S-acyl transfer and thioester exchange for the preparation of a glycosylated peptide thioester. Org Lett. 8 (20), 4465-4468 (2006).
- Naruchi, K., et al. Construction and structural characterization of versatile lactosaminoglycan-related compound library for the synthesis of complex glycopeptides and glycosphingolipids. J. Org. Chem. 71 (26), 9609-9621 (2006).
- Brandt, M., Gammeltoft, S., Jensen, K. J. Microwave heating for solid-phase peptide synthesis: General evaluation and application to 15-mer phosphopeptides. Int. J. Pept. Res. Ther. 12 (4), 349-357 (2006).
- Harris, P. W. R., Williams, G. M., Shepherd, P., Brimble, M. A. The Synthesis of Phosphopeptides Using Microwave-assisted Solid Phase Peptide Synthesis. Int. J. Pept. Res. Ther. 14 (4), 387-392 (2008).
- Qvit, N. Microwave-assisted Synthesis of Cyclic Phosphopeptide on Solid Support. Chem. Biol. Drug Des. 85 (3), 300-305 (2014).
- Kato, D., Verhelst, S. H., Sexton, K. B., Bogyo, M. A general solid phase method for the preparation of diverse azapeptide probes directed against cysteine proteases. Org Lett. 7 (25), 5649-5652 (2005).
- Olivos, H. J., Alluri, P. G., Reddy, M. M., Salony, D., Kodadek, T. Microwave-assisted solid-phase synthesis of peptoids. Org Lett. 4 (23), 4057-4059 (2002).
- Gorske, B. C., Jewell, S. A., Guerard, E. J., Blackwell, H. E. Expedient synthesis and design strategies for new peptoid construction. Org Lett. 7 (8), 1521-1524 (2005).
- Grieco, P., et al. Design and microwave-assisted synthesis of novel macrocyclic peptides active at melanocortin receptors: discovery of potent and selective hMC5R receptor antagonists. J. Med. Chem. 51 (9), 2701-2707 (2008).
- Boutard, N., Jamieson, A. G., Ong, H., Lubell, W. D. Structure-Activity Analysis of the Growth Hormone Secretagogue GHRP-6 by alpha- and beta-Amino gamma-Lactam Positional Scanning. Chem. Biol. Drug Des. 75 (1), 40-50 (2010).
- Jamieson, A. G., et al. Positional scanning for peptide secondary structure by systematic solid-phase synthesis of amino lactam peptides. J. Am. Chem. Soc. 131 (22), 7917-7927 (2009).
- Hossain, M. A., Bathgate, R. A. D., Tregear, G., Wade, J. D. De Novo Design and Synthesis of Cyclic and Linear Peptides to Mimic the Binding Cassette of Human Relaxin. Annals of the New York Academy of Sciences. 1160, 16-19 (2009).
- Fowler, S. A., Stacy, D. M., Blackwell, H. E. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus. Org Lett. 10 (12), 2329-2332 (2008).
- Cemazar, M., Craik, D. J. Microwave-assisted Boc-solid phase peptide synthesis of cyclic cysteine-rich peptides. J Pept Sci. 14 (6), 683-689 (2008).
- Miles, S. M., Leatherbarrow, R. J., Marsden, S. P., Coates, W. J. Synthesis and bio-assay of RCM-derived Bowman-Birk inhibitor analogues. Org Biomol Chem. 2 (3), 281-283 (2004).
- Murray, J. K., et al. Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. J. Am. Chem. Soc. 127 (38), 13271-13280 (2005).
- Churchill, E. N., Qvit, N., Mochly-Rosen, D. Rationally designed peptide regulators of protein kinase. C. Trends Endocrinol. Metab. 20 (1), 25-33 (2009).
- Mochly-Rosen, D., Qvit, N. Peptide inhibitors of protein-protein interactions. chimica Oggi / CHEMISTRY today. 28 (1), 14-16 (2010).
- Qvit, N., Mochly-Rosen, D. Highly specific modulators of protein kinase C localization: applications to heart failure. Drug Discov. Today Dis. Mech. 7 (2), e87-e93 (2010).
- Mougneau, E., et al. Expression cloning of a protective Leishmania antigen. Science. 268 (5210), 563-566 (1995).
- Kelly, B. L., Stetson, D. B., Locksley, R. M. Leishmania major LACK antigen is required for efficient vertebrate parasitization. J. Exp. Med. 198 (11), 1689-1698 (2003).
- Choudhury, K., et al. Trypanosomatid RACK1 orthologs show functional differences associated with translation despite similar roles in Leishmania pathogenesis. PLoS One. 6 (6), e20710 (2011).
- Gonzalez-Aseguinolaza, G., Taladriz, S., Marquet, A., Larraga, V. Molecular cloning, cell localization and binding affinity to DNA replication proteins of the p36/LACK protective antigen from Leishmania infantum. Eur. J. Biochem. 259 (3), 909-916 (1999).
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol. Med. 13 (10), 443-448 (2007).
- Aletras, A., Barlos, K., Gatos, D., Koutsogianni, S., Mamos, P. Preparation of the very acid-sensitive Fmoc-Lys(Mtt)-OH. Application in the synthesis of side-chain to side-chain cyclic peptides and oligolysine cores suitable for the solid-phase assembly of MAPs and TASPs. Int. J. Pept. Protein Res. 45 (5), 488-496 (1995).
- Li, D., Elbert, D. L. The kinetics of the removal of the N-methyltrityl (Mtt) group during the synthesis of branched peptides. J. Pept. Res. 60 (5), 300-303 (2002).
- Bourel, L., Carion, O., Gras-Masse, H., Melnyk, O. The deprotection of Lys(Mtt) revisited. J Pept Sci. 6 (6), 264-270 (2000).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase submonomer synthesis of peptoid polymers and their self-assembly into highly-ordered nanosheets. J Vis Exp. (57), e3373 (2011).
- Kaiser, E., Colescot, R. L., Bossinge, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34 (2), 595-598 (1970).
- Christensen, T. Qualitative Test for Monitoring Coupling Completeness in Solid-Phase Peptide-Synthesis Using Chloranil. Acta Chem. Scand. Ser.B-Org. Chem. Biochem. 33 (10), 763-766 (1979).
- Qvit, N., Crapster, J. A. Peptides that Target Protein-Protein Interactions as an Anti-Parasite Strategy. chimica Oggi / CHEMISTRY today. 32 (6), 62-66 (2014).
- Byk, G., et al. Synthesis and biological activity of NK-1 selective, N-backbone cyclic analogs of the C-terminal hexapeptide of substance P. J. Med. Chem. 39 (16), 3174-3178 (1996).
- King, D. S., Fields, C. G., Fields, G. B. A cleavage method which minimizes side reactions following Fmoc solid phase peptide synthesis. Int. J. Pept. Protein Res. 36 (3), 255-266 (1990).
- Pedersen, S. L., Tofteng, A. P., Malik, L., Jensen, K. J. Microwave heating in solid-phase peptide synthesis. Chemical Society Reviews. 41 (5), 1826-1844 (2012).
- Colangelo, A. M., et al. A new nerve growth factor-mimetic peptide active on neuropathic pain in rats. J. Neurosci. 28 (11), 2698-2709 (2008).
- Mesfin, F. B., Andersen, T. T., Jacobson, H. I., Zhu, S., Bennett, J. A. Development of a synthetic cyclized peptide derived from alpha-fetoprotein that prevents the growth of human breast cancer. J. Pept. Res. 58 (3), 246-256 (2001).
- Mizejewski, G. J., Muehlemann, M., Dauphinee, M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 52 (2), 83-90 (2006).

