Fluorescence anisotropie comme outil pour étudier les interactions protéine-protéine
Summary
Les interactions protéiques sont au cœur de la fonction d'une cellule. techniques calorimétriques et spectroscopiques sont couramment utilisés pour les caractériser. Nous décrivons ici anisotropie de fluorescence comme un outil pour étudier l'interaction entre la protéine mutée dans le syndrome de Shwachman-Diamond (SBDS) et le facteur Allongement-like 1 GTPase (EFL1).
Abstract
interactions protéine-protéine jouent un rôle essentiel dans le fonctionnement d'un organisme vivant. Une fois que l'interaction a été identifié et validé, il est nécessaire de caractériser au niveau structurel et mécaniste. Plusieurs méthodes biochimiques et biophysiques existent à cette fin. Parmi eux, l'anisotropie de fluorescence est une technique puissante utilisée notamment lorsque l'intensité de la fluorescence d'une protéine marqué par un fluorophore reste constant lors d'une interaction protéine-protéine. Dans cette technique, une protéine marqué par un fluorophore est excité avec une lumière polarisée verticalement, d'une longueur d'onde appropriée qui excite sélectivement un sous-ensemble des fluorophores en fonction de leur orientation par rapport au faisceau entrant. L'émission résultant a également une directivité dont la relation dans les plans verticaux et horizontaux définit anisotropie (r) comme suit: r = (I VV -I VH) / (I VV + 2I VH), où je VV et je <sub> VH sont les intensités de fluorescence des composantes verticales et horizontales, respectivement. L'anisotropie de fluorescence est sensible à la diffusion d'un fluorophore, à savoir la taille moléculaire apparente d'un fluorophore attaché à une protéine, qui est modifiée lors de l'interaction protéine-protéine de rotation. Dans le présent texte, l'utilisation de l'anisotropie de fluorescence comme un outil pour étudier les interactions protéine-protéine a été illustrée pour traiter la liaison entre la protéine mutée dans le syndrome de Shwachman-Diamond (SBDS) et le facteur de Allongement like-1 GTPase (EFL1). De façon classique, le marquage d'une protéine avec un fluorophore est réalisée sur les groupes thiol (cystéine) ou dans les groupes amino (extrémité N-terminale amine ou lysine) de la protéine. Cependant, SBDS possède plusieurs cysteines et lysines qui ne permettent pas le site d'étiquetage dirigé de celui-ci. Comme alternative, le colorant 4 ', 5'-bis (1,3,2 dithioarsolan-2-yl) fluorescéine a été utilisé pour marquer spécifiquement un motif tétracystéine, Cys-Cys-Pro-Gly-Cys-Cys modifié par génie génétique dans l'extrémité C-terminale de la protéine recombinante SBDS. Montage des données expérimentales ont fourni des informations quantitatives et mécaniste sur le mode de liaison entre ces protéines.
Introduction
Les cellules contiennent une multitude de macromolécules biologiques qui interagissent en permanence les uns avec les autres. Cette association donne naissance à des complexes qui participent aux mécanismes cellulaires responsables de leur fonctionnement dans la transduction du signal, la régulation de l'expression génique et la migration cellulaire, entre autres. Toutes les interactions protéine-protéine qui se produisent dans une cellule comprennent un réseau connu sous le nom intéractome. Dans Saccharomyces cerevisiae plus de 70% de ses protéines se sont révélées avoir des partenaires qui interagissent 1. Comprendre l'interactome d'une cellule et leurs fonctions de fournir des informations pertinentes sur la complexité et la diversité des organismes vivants. Plusieurs méthodes ont été décrites pour identifier et caractériser les interactions protéine-protéine. Différent haute grâce à des méthodes telles que mettre deux hybrides de levure 2, protéine fragment complémentation essais 3, la purification par affinité 4 couplée à la spectrométrie de masse et de protéines microarrays sont utilisés pour identifier une interaction 5,6. Une fois identifié, il est nécessaire de le valider et cela peut varier au cas par cas. En règle générale, ces essais impliquent perturber l'interaction elle – même au niveau des membres individuels de la paire d'interaction, par exemple par délétion du gène ou de la surexpression d'une des protéines, puis la recherche de changements dans les propriétés ou la fonction de l'autre élément à la niveau cellulaire. Par la suite, des techniques biophysiques 7 sont utilisées pour caractériser les interactions protéine-protéine au niveau moléculaire. A cet effet, la structure des complexes de protéines sont déterminées par cristallographie aux rayons X, la résonance magnétique nucléaire et de cryo-microscopie électronique tandis que la calorimétrie et la spectroscopie de fluorescence sont utilisés pour décrire quantitativement et mécaniquement entre eux.
Dans ce travail, l'anisotropie de fluorescence a été utilisé comme une technique pour caractériser l'interaction entre la GTPase EFL1 et le SBDprotéine S. Ces protéines participent à la synthèse des ribosomes en favorisant la libération du facteur d'initiation eucaryote 6 à partir de la surface de la sous – unité 60S du ribosome 8. La protéine SBDS est muté dans la maladie connue sous le nom maladie de shwachman 9 et agit comme un facteur d'échange de nucléotide guanine pour EFL1 diminuant son affinité pour le guanosine diphosphate 10,11. mutations de la maladie dans SBDS abolissent l'interaction avec EFL1 et empêchent ainsi son activation.
L'anisotropie de fluorescence est couramment utilisé dans des applications biologiques pour étudier les interactions protéine-acide nucléique-protéine ou un peptide. Elle est basée sur le principe selon lequel un fluorophore excité avec les résultats de la lumière polarisée dans une émission polarisée partiellement. L'anisotropie de fluorescence est définie par l'équation 1:
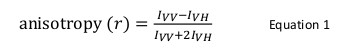
où je VV et je VH sont laintensités de fluorescence de la verticale (VV) et horizontalement (VH) polarisés émission lorsque l'échantillon est excité par la lumière polarisée verticalement 12. L'anisotropie de fluorescence est sensible à des facteurs qui affectent la vitesse de diffusion du fluorophore de rotation et dépend de la température, la viscosité de la solution et la taille moléculaire apparent du fluorophore ainsi. La taille apparente d'une protéine contenant un fluorophore augmente quand il interagit avec une autre protéine et un tel changement peut alors être évalué en tant que changement dans l'anisotropie. Plus précisément, un fluorophore qui tourne lentement dans la solution par rapport à sa durée de vie de fluorescence aura une grande valeur I VV et une petite valeur I VH et ne seront donc présenter une anisotropie relativement importante. Pour fluorophores qui dégringolent rapidement par rapport à leur durée de vie de fluorescence, je VV et je VH serai semblable et leur valeur d'anisotropie sera faible 12 </sup> (Figure 1). En outre, pour un bon signal d'anisotropie à la mesure du bruit, il est nécessaire d'avoir un fluorophore avec une durée de vie de fluorescence similaire au temps de corrélation de rotation de la molécule d'intérêt. Dans le cas contraire, il est impossible d'enregistrer avec précision la différence entre l'anisotropie de la protéine libre et que, dans le complexe. Par exemple, l'anisotropie d'une sonde fluorescente à une durée de vie proche de 4 nsec tels que la fluorescéine ou la rhodamine attachés à un composé de faible masse moléculaire de 100 Da est de 0,05. La liaison à une molécule de 160 kDa va augmenter sa valeur d'anisotropie à 0,29; une différence qui peut être mesuré avec précision. En revanche, la même sonde fluorescente impliquée dans une réaction de liaison dont l'augmentation de la taille moléculaire varie de 65 à 1000 kDa ne permettra d'obtenir un changement d'anisotropie de 0,28 à 0,3, ce qui est trop faible pour être mesurée avec précision. Dans ce scénario, une sonde avec une durée de vie de 400 nanosecondes serait plus approprié 12.
<pclass = "jove_content">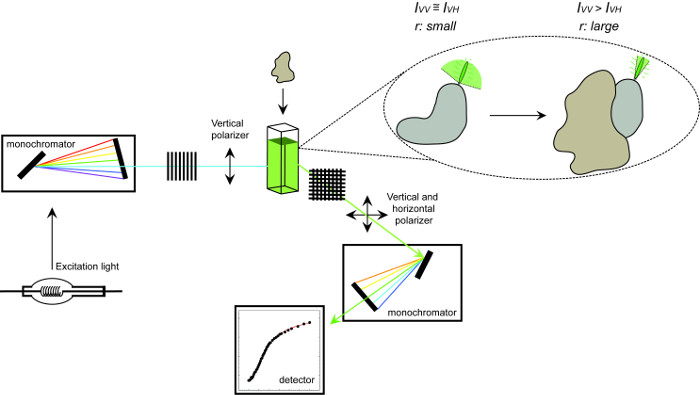
Figure 1. Représentation schématique de l'équipement utilisé pour mesurer l' anisotropie de fluorescence et de la procédure. Représentation schématique de l'équipement utilisé pour effectuer une anisotropie de fluorescence expérience d'interaction protéine-protéine de mesure. Fluorophores qui dégringolent rapide petit écran anisotropie qui augmente lors de la liaison à un partenaire d'interaction. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
les applications de fluorescence nécessitent la présence d'un fluorophore dans une quelconque des molécules étudiées. Pour étudier les interactions protéine-protéine, il existe trois types de fluorophores: 1) les résidus tryptophane présents dans les protéines, 2) des fluorophores attachés chimiquement et 3) les partenaires de fusion fluorescentes telles que la protéine fluorescente verte (GFP) et ses derivatives. La plupart des protéines ont des résidus de tryptophane dans sa structure, donc la meilleure façon de mesurer l'interaction est en surveillant les changements dans les spectres de fluorescence correspondants ou par la surveillance des changements dans l'intensité de fluorescence des résidus tryptophane. Cependant, les résidus tryptophane peuvent être présents dans les deux protéines qui compliquent l'analyse. D'autre part, pour un fluorophore pour modifier ses propriétés de fluorescence due à une interaction dont il a besoin d'être situé sur ou à proximité du site de liaison et il pourrait interférer avec l'interaction elle-même. Cela nécessite une attention particulière lors de l'utilisation de fluorophores volumineux tels que la GFP. Si aucune de ces fluorophores peut être utilisé pour des études de liaison, il est donc nécessaire d'introduire des fluorophores extrinsèques à l'une des protéines impliquées. De nombreux fluorophores synthétisés chimiquement existent et peuvent être fixés de manière covalente à des protéines par l'intermédiaire de leurs groupes réactifs tels que les groupes amine (chaîne latérale de résidus lysine ou N-terminale) et les groupes thiol dans la cystéine. Fles dérivés de luorophore avec de l' isothiocyanate et des esters de succinimidyle réagissent avec des groupes amide tandis que l' iodoacétamide et le maléimide sont des groupes thiol réactifs 13. Les colorants les plus courants utilisés dans les applications de fluorescence sont des dérivés de la fluorescéine et les colorants verts rhodamine, les coumarines, les fluorophores BODIPY et colorants Alexa Fluor. Une liste détaillée des fluorophores disponibles dans le commerce et leur utilisation peut être trouvé dans les références 14,15. Pour le marquage avec succès, le groupe réactif doit être exposée sur la surface de la protéine, mais en raison du grand nombre de groupes fonctionnels réactifs présents dans les polypeptides en général, il est très difficile d'obtenir une modification spécifique d'un site. La protéine d'intérêt dans cette étude, SBDS, contient 5 cysteines libres et 33 lysines qui peuvent résulter dans l'étiquetage des sites multiples. étiquetage non uniforme peut affecter la liaison et va compliquer l'analyse des données différentes molécules fluorophores peuvent provoquer différents signaux d'intensité fluorescente lors de la liaison. Pour overcome ce problème, nous avons utilisé le fluorophore FlAsH, 4 ', 5'-bis (1,3,2 dithioarsolan-2-yl) fluorescéine à l'étiquette du site directement la protéine SBDS. Ceci est un colorant arsenoxide avec une forte affinité pour les quatre cysteines espacées dans un motif connu sous Flash tag comprenant le CCXXCC de séquence où X est un acide aminé autre que la cystéine 16,17. Ce motif tétracystéine est ajouté à l'extrémité N- ou C-terminale de la protéine par génie génétique conjointement avec un agent de liaison approprié pour empêcher la rupture du pli général de la protéine. La paire composée de FlAsH colorant et FlAsH-tag a été initialement conçu pour les protéines d'étiquettes spécifiques au site dans les cellules 17 vivant , mais il peut aussi être utilisé pour marquer des protéines purifiées in vitro comme il est illustré ici. En outre, les stratégies enzymatiques ont également été mis au point pour permettre la fonctionnalisation spécifique au site des protéines 18.
Dans ce manuscrit, nous décrivons l'utilité de l'anisotropie de fluorescence d'unoutil sa pour étudier les interactions protéine-protéine. Reliure peut être évaluée par une simple inspection de la forme de liaison de la courbe tandis que l'information quantitative peut être obtenue à partir de l'ajustement des données expérimentales.
Protocol
Representative Results
Discussion
La plupart des expériences biochimiques avec les protéines ne nécessitent pas de protéine pure, mais aussi de grandes quantités d'entre eux, quelle que soit la technique utilisée. Pour cette raison, les protéines utilisées pour ce type d'expériences sont obtenues par expression hétérologue, comme ce fut le cas présenté ici. La spectroscopie de fluorescence nécessite la présence d'un fluorophore dans la molécule étudiée. des résidus aromatiques constituent les fluorophores intrinsèques d&#…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Authors acknowledge the financial support from CONACyT project numbers 167359 and 177138, and from DGAPA-UNAM project number IN201615.
Materials
| 0.5 mm Glass beads | Biospec Products | 11079105 | |
| Tris Base | Formedium | TRIS01 | Ultra pure |
| Glycerol | Sigma-Aldrich | G5516 | |
| dye 4’, 5’-bis(1,3,2 dithioarsolan-2-yl) fluorescein | ThermoFischer Scientific | LC6090 | This kit contains the dye to label a FlAsH tag |
| Ampiciline | IBI Shelton Scientific, Inc | IB02040 | |
| D(+)-Glucose Anhydrous | Formedium | GLU03 | |
| D(+)-Galactose | Formedium | GAL03 | |
| L-Leucine | Formedium | DOC0157 | |
| L-Tryptofan | Formedium | DOC0189 | |
| Bezamidine hydrochloride | Sigma-Aldrich | B6506-5G | |
| PMSF | Gold Biotechnology, Inc | P-470-25 | Phenylmethylsulfonyl fluoride |
| NaCl | Formedium | NAC02 | Sodium Chloride |
| Glycerol | Tecsiquim, S.A. de C.V. | GT1980-6 | |
| MgCl2 | Merck Millipore Corporation | 1725711000 | Magnesium Chloride |
| Imidazole | Sigma-Aldrich | I2399-500G | |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250-100ML | |
| K2HPO4 | Sigma-Aldrich | P3786-500G | Potassium phosphate dibasic |
| NaH2PO4 | Sigma-Aldrich | S3139-500G | Sodium phosphate monobasic |
| Yeast nitrogen base without amino acids | Formedium | CYN0410 | |
| Yeast extract | Formedium | YEM03 | Micro Granulated |
| L-Tyroisne | Formedium | DOC0193 | |
| Adenine sulphate | Formedium | DOC0230 | |
| Casamino acids | Formedium | CAS03 | |
| Tryptone | IBI Shelton Scientific, Inc | IB49182 | |
| IPTG | Formedium | IPTG025 | |
| Name of Material | Company | Catalog Number | Comments/Description |
| Filtration units | Merck Millipore Corporation | UFC901096 | Amicon Ultra-15, membrana PLGC Ultracel-PL, 10 kDa |
| Membrane Filter | Merck Millipore Corporation | GSWP04700 | Membrane Filter, mixed cellulose esters, Hydrophilic, 0.22 µm, 47 mm, white, plain |
| Ni2+ affinity column | QIAGEN | 30760 | Cartridge pre-filled with 5 ml Ni-NTA Superflow |
| Strong Sulfopropyl cation exchanger column | GE Healthcare Life Science | 17-5157-01 | HiTrap SP Sepharose FF 5 ml |
| Size Exclusion column | GE Healthcare Life Science | 28989335 | HiLoad 16/600 Superdex 200 PG |
| Fluorescence cell | Hellma Analytics | 111-057-40 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Spectrophotometer | Agilent Technologies | G6860AA | Cary 60 UV-Vis |
| Shaker | ThermoFischer Scientific | SHKA4000-7 | MaxQ 4000 Benchtop temperature range Ambient-15° to 60°C |
| Centrifuge | ThermoFischer Scientific | 75004271 | Heraeus Megafuge 16R |
| FPLC | Pharmacia Biotech | Discontinued | FPLC system conductivity UV-MM II monitor P500 pump fraction |
| Spectrofluorometer | Olis | No applicable | Olis DM 45 with Polarization Toolbox |
References
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440 (7084), 637-643 (2006).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Michnick, S. W., Hien Ear, P., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods in Enzymology. 470, 336-366 (2010).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Dwane, S., Kiely, P. A. Tools used to study how protein complexes are assembled in signaling cascades. Bioeng Bugs. 2 (5), 247-259 (2011).
- Snider, J., et al. Fundamentals of protein interaction network mapping. Mol Syst Biol. 11 (12), 848 (2015).
- Fersht, A., Baldwin, R. L. . Structure and mechanism in protein science: a guide to enzyme catalysis and protein folding. , 191-214 (2002).
- Menne, T. F., et al. The Shwachman-Bodian-Diamond syndrome protein mediates translational activation of ribosomes in yeast. Nat Genet. 39 (4), 486-495 (2007).
- Boocock, G. R., et al. Mutations in SBDS are associated with Shwachman-Diamond syndrome. Nat Genet. 33 (1), 97-101 (2003).
- Garcia-Marquez, A., Gijsbers, A., de la Mora, E., Sanchez-Puig, N. Defective Guanine Nucleotide Exchange in the Elongation Factor-like 1 (EFL1) GTPase by Mutations in the Shwachman-Diamond Syndrome Protein. J Biol Chem. 290 (29), 17669-17678 (2015).
- Gijsbers, A., Garcia-Marquez, A., Luviano, A., Sanchez-Puig, N. Guanine nucleotide exchange in the ribosomal GTPase EFL1 is modulated by the protein mutated in the Shwachman-Diamond syndrome. Biochem Biophys Res Commun. 437 (3), 349-354 (2013).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2010).
- Nishigaki, T., Treviño, C. L., Gòmez, I. . Tools to understand protein-protein interactions. 37, 1-14 (2012).
- Johnson, I. . The Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies. , (2010).
- Sabnis, R. W. . Handbook of Fluorescent Dyes and Probes. , (2015).
- Adams, S. R., et al. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: synthesis and biological applications. J Am Chem Soc. 124 (21), 6063-6076 (2002).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281 (5374), 269-272 (1998).
- Rashidian, M., Dozier, J. K., Distefano, M. D. Enzymatic labeling of proteins: techniques and approaches. Bioconjug Chem. 24 (8), 1277-1294 (2013).
- Maniatis, T., Fritsch, E. F., Sambrook, J. . Molecular cloning: A laboratory manual. , (2001).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- West, R. W., Chen, S. M., Putz, H., Butler, G., Banerjee, M. GAL1-GAL10 divergent promoter region of Saccharomyces cerevisiae contains negative control elements in addition to functionally separate and possibly overlapping upstream activating sequences. Genes Dev. 1 (10), 1118-1131 (1987).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J Bacteriol. 153 (1), 163-168 (1983).
- Eftink, M. R. Fluorescence methods for studying equilibrium macromolecule-ligand interactions. Methods Enzymol. 278, 221-257 (1997).
- Han, H., et al. Binding of Substrates to the Central Pore of the Vps4 ATPase Is Autoinhibited by the Microtubule Interacting and Trafficking (MIT) Domain and Activated by MIT Interacting Motifs (MIMs). J Biol Chem. 290 (21), 13490-13499 (2015).
- Sanchez-Puig, N., Veprintsev, D. B., Fersht, A. R. Binding of natively unfolded HIF-1alpha ODD domain to p53. Mol Cell. 17 (1), 11-21 (2005).
- Trusch, F., et al. The N-terminal Region of the Ubiquitin Regulatory X (UBX) Domain-containing Protein 1 (UBXD1) Modulates Interdomain Communication within the Valosin-containing Protein p97. J Biol Chem. 290 (49), 29414-29427 (2015).
- Kamp, F., Beyer, K. Binding of alpha-synuclein affects the lipid packing in bilayers of small vesicles. The Journal of Biological Chemsitry. 281, 9251-9259 (2006).
- Bujalowski, W. M., Jezewska, M. J. Fluorescence Intensity, Anisotropy, and Transient Dynamic Quenching Stopped-Flow Kinetics. Spectroscopic Methods of Analysis. 875, 105-133 (2012).
- Asano, N., et al. Direct interaction between EFL1 and SBDS is mediated by an intrinsically disordered insertion domain. Biochem Biophys Res Commun. 443 (4), 1251-1256 (2014).

