Summary
Kutane svulster blir ofte kastet etter Mohs mikrografisk kirurgi. En protokoll er beskrevet her som gjør det mulig for klinisk hjelpepersonell å effektivt behandle og lagre kutan tumor ( f.eks. Squamous cell carcinoma, basal cell carcinoma og melanoma) prøver for nedstrøms laboratorieapplikasjoner uten å forstyrre klinisk operasjon.
Abstract
Forekomsten av hudkreft ( f. Eks. Squamisk cellekarcinom, basalcellekarcinom og melanom) har økt de siste årene. Det forventes at det vil være en parallell etterspørsel etter kutane tumorprøver for biomedisinsk forskning. Vevtilgjengelighet er imidlertid begrenset på grunn av kostnaden ved å etablere en biorepository og mangelen på protokoller tilgjengelig for å oppnå kliniske prøver som ikke forstyrrer klinisk operasjon. En protokoll ble opprettet for å samle og behandle kutan tumor og tilhørende blod- og spyttprøver som har minimal innvirkning på rutinemessige kliniske prosedyrer på datoen for en Mohs-kirurgi. Tumorprøver oppsamles og behandles fra pasienter som gjennomgår Mohs-histoteknologens første lag med Mohs-kirurgi for biopsi-beprøvde kutane maligniteter. Tilstøtende normalt vev oppsamles ved kirurgisk lukning. Ytterligere prøver som kan samles er helblod og buccal swabs. Ved å bruke vevsprøver som normalt kasseres, ble det utviklet en biorepository som tilbyr flere viktige fordeler ved å være basert i klinikken versus laboratorieinnstillingen. Disse inkluderer et bredt spekter av innsamlede prøver; Tilgang til deidentifiserte pasientopptegnelser, inkludert patologiske rapporter; Og, for den typiske giveren, tilgang til ytterligere prøver under oppfølgingsbesøk.
Introduction
Kreft- og biomarkørforskning er avhengig av forsyning av humane vevsprøver av høy kvalitet, og begrenset tilgang har hindret forskningen 1 , 2 . Mange dermatologiske studier er begrenset av utilstrekkelig tilførsel, variabel kvalitet og kostnader forbundet med bruk av humant vev. Kostnaden ved å etablere en stor, dedikert biobank har blitt anslått til om lag to millioner dollar 3 , og disse kostnadene legger bruken av menneskelig vev utenfor rekkevidde av mange forskere. Videre utgjør prosessen med å generere og lagre forskningsprøver risikoen for å påvirke klinisk operasjon og forsinke pasientomsorgen dersom den ikke utføres forsiktig. En kostnadseffektiv klinisk-basert biorepository er etablert som fokuserer på hudkreftprøver etter anbefalte beste praksis og prøvevalidering 4 , 5 , 6 .
<pClass = "jove_content"> Denne protokollen er utviklet i en dermatologi klinikk som utfører et stort antall Mohs mikrographic operasjoner for å fjerne squamous cell carcinoma (SCC), basal celle karsinom (BCC) og melanom hudkreft. Frivillige givere kan rekrutteres fra denne pasientpopulasjonen. Det er viktig å etablere biorepository på innsamlingsstedet for raskt å fange vev og blod fra samtykkede pasienter uten forsinkelse av behandlingen. Å samle prøver fra samme klinikk minimerer variasjoner i innsamlingsteknikker og minimerer variasjoner i kvaliteten på prøvene, noe som kan være problematisk for nedstrømsapplikasjoner 7 , 8 .Målet med Mohs mikrografisk kirurgi teknikk er å sikre at alt kreftvev blir fjernet, samtidig som det opprettholder så mye sunt vev som mulig. Prosedyren innebærer progressiv fjerning av tynne lag av tumorvev. Hvert påfølgende lag er hansTologisk undersøkt (etter kryoseksjonering av tumorvevet og utførelse av H & E-farging) av en hudlege for å avgjøre om alt kreftvev har blitt fjernet. Excisionen og undersøkelsen av påfølgende lag av vev utføres mens pasienten forblir på kontoret. Denne teknikken anses som det beste behandlingsalternativet for SCC 9 . På dette tidspunktet er såret lukket, og for å forbedre helbredelse og kosmetisk utseende, blir nærliggende normalt vev (ANT) ofte skåret ut. Dermed er denne kirurgiske prosedyren for å fjerne en svulst ideell til å samle histologisk karakterisert vev for fremtidige studier.
Anskaffelsesprosedyren for å skaffe svulstvev, tilstøtende normalt vev, spytt og blodprøver, er utformet for å få minimal innvirkning på vanlige ansatteoppgaver ( figur 1 ). Medisinske assistenter utfører bloddragene mens du forbereder pasienten for prosedyren. Etter fullføring av Mohs-prosedyren, M Åh histoteknologen forbereder ytterligere histologiske lysbilder av prøven og overfører vevet til biorepositoryet. Kostnader knyttet til etablering av biorepository inkluderer kjøp av kryopreserveringsfrysere, opprettelse av beskjedent klinisk laboratorierom og utvikling av et oppfølgingssporingsprogram.
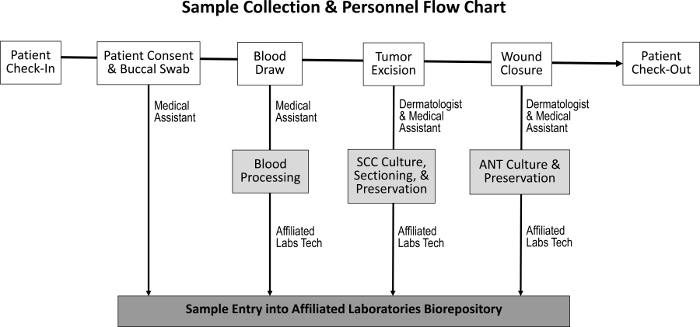
Figur 1: Sekvens av prøveinnsamling og ansvarlig personale. Ved pasientens innsjekking og oppnåelse av pasientens samtykke samler den medisinske assistenten en bukkalpinne og utfører en blodtrekk. Dermatologen og den medisinske assistenten beskytter deretter svulsten og lukker såret, i løpet av hvilken tid SCC og ANT prøver samles, henholdsvis. En dedikert laboratorie tekniker behandler blodet og deler SCC og ANT prøver for vevskultur, bevaring og inngang i biorepository.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Vennligst klikk her for å se en større versjon av denne figuren.
Mangfoldet av samlede prøver muliggjør en rekke eksperimentelle tilnærminger ( figur 2 ). Prøver oppsamlet fra pasienten er buccal swabs (spytt kan også samles om nødvendig), helblod og skåret vev. Buccal swabs og en prøve fra hele blodet blir lagret, uten behandling, for genotyping og vevsmatching. Hele blodet separeres i hvite blodlegemer (WBC) og plasmafraksjoner for fremtidige analyser. Etter Mohs-prosessering, plasseres den frosne svulsten direkte i flytende nitrogen og overføres til en -80 ° C fryser. Friskt, levedyktig tumorvev og ANT-prøver dyrkes ved å bruke modifikasjoner av tidligere teknikker 10 , 11 og deretter kryokonservert. Under samlingen registreres nummeret på hver prøvetype på et regneark før inngangen til Inventar sporing programmet for å lette nøyaktig bearbeiding ( tabell 1 ).
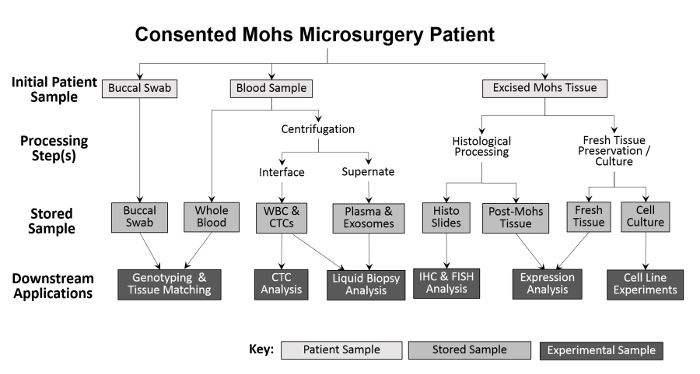
Figur 2: Oversikt over klinikkbasert biorepositorprøveinnsamling og -behandling. En bukkalpinne og blodprøve oppsamles fra pasienten og lagres for nedstrøms genotyping og vevsmatching. Hele blodet blir videre behandlet for isolering av hvite blodlegemer og CTC-analyser, samt for plasmainnsamling og væskebiopsianalyse. Vev utskåret under Mohs prosedyren er histologisk behandlet for diagnostiske formål, hvoretter de histologiske lysbildene kan brukes eksperimentelt for ytterligere immunhistokemiske analyser. Forutsatt at den utskårne vevsprøven er stor nok, fjernes en del av ferskt vev og deles for protein- og RNA-isolasjon og for etablering av dyrkede cellelinjer.55583 / 55583fig1large.jpg "target =" _ blank "> Vennligst klikk her for å se en større versjon av denne figuren.
| Samlingsdato: | |||||
| Pasient 1 | Pasient 2 | Pasient 3 | Pasient 4 | Pasient 5 | |
| Initialer og fødselsdato | |||||
| Øyenfarge | |||||
| Eksempel Type | |||||
| Eksempelplassering | |||||
| Spytt | |||||
| WHull blod | |||||
| Plasma | |||||
| Tumor levedyktig | |||||
| Vev Normal Levende | |||||
| Tumor Mohs Flytende nitrogen | |||||
| Vev Normal Flytende Kväve | |||||
| lysbilder |
Tabell 1: Sjekkliste for å registrere samlinger. Data spores og registreres med hver samplet samling inkluderer pasientens initialer, fødselsdato og øyenfarge (for hudtyping), så vel som lokaliseringenPå prøvefjerning. Antall spyttprøver, blodoppsamlingsvolumer og antall levedyktige og konserverte vevsprøver samlet inn registreres også som referanser for tildelinger til senere bruk. Vennligst klikk her for å laste ned denne filen.
For å validere prøveinnsamlingsprosedyrer, har hver prøvetype blitt testet i nedstrømsapplikasjoner. Ved bruk av modifikasjoner av tidligere teknikker 12 har tumor og ANT blitt vellykket brukt i protein- og RNA-isolasjon og kan potensielt brukes til DNA-isolasjon. Levende eksplanter som er etablert fra vevseksjonene, er blitt evaluert ved mikroskopi, mens lagrede histologiske lysbilder har blitt brukt til immunhistokjemi og immunfluorescens.
Ved å følge protokollen beskrevet her, er det mulig å utvide denne modellen til andre dermatologiklinikker, andre svulstetyper (som melanom), Og andre kirurgiske spesialiteter og praksiser for å gi humane vevsprøver for mangfoldig forskning i humane kreftformer. Små modifikasjoner av denne protokollen vil trolig være nødvendig for annen praksis, men i prinsippet er denne protokollen gjeldende for enhver kirurgisk praksis som rutinemessig sletter pasientprøver samlet i løpet av pasientbehandling.
Protocol
Representative Results
Discussion
Forfatterens kunnskap er denne protokollen den første i sitt slag som fokuserer på klinisk anskaffelse av kutane vevsprøver i både en kostnadseffektiv og rask tilnærming. Pasienter som gjennomgår Mohs-mikrokirurgi er typisk planlagt i bestemte tidsblokker, og samlingen er begrenset til disse periodene. Eksempelsamling innebærer innsats fra den medisinske assistenten som er involvert i pasientbehandling, Mohs histoteknologen som behandler svulstprøver, og et utpekt laboratoriemedarbeider som håndterer prøveinng…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av midler fra Midwestern University College of Health Sciences Research Facilitation Grant, tildelt EEH, og Midwestern University Office of Research og sponsede programmer Intramural Grant, tildelt KJL. Ytterligere støtte ble gitt av tilknyttede laboratorier og tilknyttet dermatologi. Vi takker Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel og Ali Zaidi for teknisk hjelp.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

