Inrättande av ett klinikbaserat biorepository
Summary
Kutana tumörer kasseras ofta efter Mohs mikrografisk kirurgi. Ett protokoll beskrivs här som gör det möjligt för klinisk supportpersonal att effektivt bearbeta och lagra kutan tumör ( t.ex. pladecells carcinom, basalcellkarcinom och melanom) prover för nedströms laboratorieapplikationer utan att störa kliniska operationer.
Abstract
Förekomsten av hudcancer ( t.ex. plavocellkarcinom, basalcellkarcinom och melanom) har ökat under de senaste åren. Det förväntas att det kommer att finnas en parallell efterfrågan på kutana tumörprover för biomedicinska forskningsstudier. Tissue tillgänglighet är dock begränsad på grund av kostnaden för att etablera ett biorepository och avsaknaden av protokoll som är tillgängliga för att erhålla kliniska prover som inte stör klinisk verksamhet. Ett protokoll upprättades för att samla och bearbeta kutan tumör och associerade blod- och salivprover som har minimal inverkan på rutinmässiga kliniska förfaranden vid datumet för en Mohs-operation. Tumörprover samlas in och behandlas från patienter som genomgår Mohs-histoteknologins första lager av Mohs-kirurgi för biopsi-beprövade kutana maligniteter. Intilliggande normal vävnad uppsamlas vid kirurgisk tillslutning. Ytterligare prov som kan samlas är helblod och buccal swabs. Genom att använda vävnadsprover som normalt kasseras, genererades en biorepository som erbjuder flera viktiga fördelar genom att vara baserad i kliniken jämfört med laboratorieinställningen. Dessa inkluderar ett brett spektrum av samlade prover; Tillgång till identifierade patientjournaler, inklusive patologiska rapporter Och för den typiska givaren tillgång till ytterligare prover under uppföljningsbesök.
Introduction
Cancer- och biomarkörsforskning bygger på en leverans av mänskliga vävnadsprover av hög kvalitet, och begränsat utbud har hindrat forskning 1 , 2 . Många dermatologiska studier är begränsade av otillräcklig tillgång, variabel kvalitet och kostnader i samband med användningen av mänsklig vävnad. Kostnaden för att skapa en stor, dedikerad biobank har uppskattats till cirka två miljoner dollar 3 , och dessa kostnader gör användningen av mänsklig vävnad utom räckhåll för många forskare. Vidare utgör processen för att generera och lagra forskningsprover risken för att påverka klinisk verksamhet och fördröja patientvården om den inte genomförs noggrant. En kostnadseffektiv klinikbaserad biorepository har etablerats som fokuserar på hudcancerprover efter rekommenderad bästa praxis och provvalidering 4 , 5 , 6 .
<pClass = "jove_content"> Detta protokoll har utvecklats i en dermatologiklinik som utför en stor mängd Mohs mikrographic kirurgi för att avlägsna pladecellscancer (SCC), basalcellkarcinom (BCC) och melanom hudcancer. Frivilliga givare kan rekryteras från denna patientpopulation. Det är viktigt att etablera biorepository på insamlingsstället för att snabbt fånga vävnad och blod från samtyckta patienter utan dröjsmål. Att samla prover från samma klinik minimerar variationer i insamlingstekniker och minimerar variationer i provkvaliteten, vilket kan vara problematiskt för nedströmsapplikationer 7 , 8 .Målet med Mohs mikrografiska kirurgiska tekniken är att säkerställa att all cancervävnad avlägsnas samtidigt som så mycket hälsosam vävnad bevaras som möjligt. Förfarandet innefattar progressiv avlägsnande av tunna skikt av tumörvävnad. Varje på varandra följande skikt är hansTologiskt undersökt (efter kryosektion av tumörvävnaden och utförande av H & E-färgning) av en hudläkare för att bestämma om all cancervävnad har avlägsnats. Undersökningen och undersökningen av efterföljande skikt av vävnader utförs medan patienten förblir på kontoret. Denna teknik anses vara det bästa behandlingsalternativet för SCC 9 . Vid denna tidpunkt är såret stängt och för att förbättra läkning och kosmetisk utseende skärs ofta intilliggande normal vävnad (ANT) ofta ut. Således är detta kirurgiska förfarande för att avlägsna en tumör lämpligt lämpad för att samla histologiskt karakteriserad vävnad för framtida studier.
Upphandlingsförfarandet för att erhålla tumörvävnad, intill normal vävnad, saliv och blodprover har utformats för att få minimal inverkan på normala personaluppgifter ( Figur 1 ). Medicinska assistenter utför bloddragningarna medan patienten förbereds för proceduren. Efter avslutad Mohs-procedur, M Ohs histoteknologen förbereder ytterligare histologiska bilder av provet och överför vävnaden till biorepository. Kostnaderna i samband med upprättandet av biorepository inkluderar inköp av kryopreserveringsfrysare, skapandet av blygsamt kliniskt laboratoriumutrymme och utvecklingen av ett inventeringsspårningsprogram.
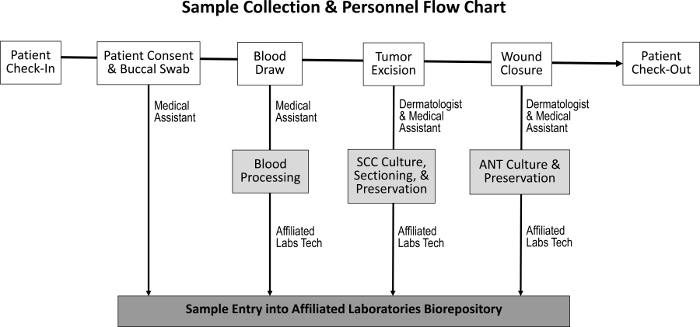
Figur 1: Sekvens av provinsamling och ansvarig personal. Vid patientinsamling och uppnående av patientens samtycke samlar den medicinska assistenten en buccal swab och utför en bloddragning. Dermatologen och den medicinska assistenten tar sedan bort tumören och stänger såret, under vilken tid SCC och ANT-prov uppsamlas. En särskild laboratorie tekniker behandlar blodet och delar SCC- och ANT-proverna för vävnadsodling, bevarande och inträde i biorepository.Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> Vänligen klicka här för att se en större version av denna figur.
Mångfalden av samlade prov möjliggör en rad olika experimentella tillvägagångssätt ( Figur 2 ). Prov som samlas in från patienten är buccala swabs (saliv kan också samlas vid behov), helblod och skärad vävnad. Buccal swabs och ett prov från hela blodet sparas, utan behandling, för genotypning och vävnadsmatchning. Hela blodet separeras i vita blodkroppar (WBC) och plasmafraktioner för framtida analyser. Efter Mohs-bearbetning placeras den frusna tumören direkt i flytande kväve och överförs till en -80 ° C frys. Friska, livskraftiga tumörvävnader och ANT-prover odlas med användning av modifikationer av tidigare tekniker 10 , 11 och sedan kryokonserverade. Under samlingen registreras numret på varje provtyp i ett kalkylblad före inmatning i Inventeringsspårningsprogrammet för att underlätta korrekt bearbetning ( tabell 1 ).
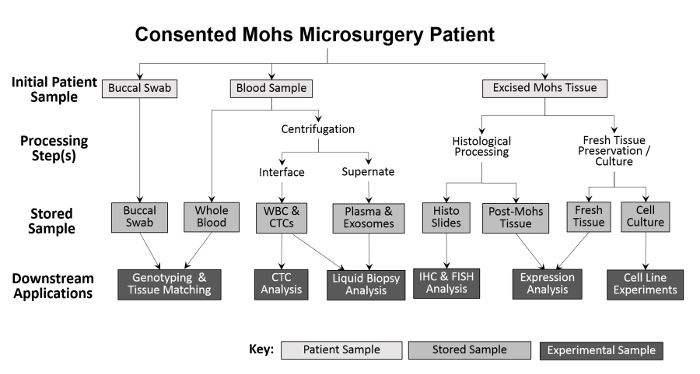
Figur 2: Översikt av klinisk baserad biorepository samling och behandling av prov. En buccal swab och blodprov samlas från patienten och lagras för nedströms genotyping och vävnadsmatchning. Hela blodet bearbetas vidare för isolering av vita blodkroppar (WBC) och CTC, samt för plasmainsamling och flytande biopsianalys. Vävnad som skäras under Mohs-proceduren behandlas histologiskt för diagnostiska ändamål, varefter de histologiska glidbanorna kan användas experimentellt för ytterligare immunohistokemiska analyser. Under förutsättning att det skurna vävnadsprovet är stort nog, avlägsnas en del av färsk vävnad och sektioneras för protein- och RNA-isolering och för etablering av odlade cellinjer.55583 / 55583fig1large.jpg "target =" _ blank "> Vänligen klicka här för att se en större version av denna figur.
| Insamlingsdatum: | |||||
| Patient 1 | Patient 2 | Patient 3 | Patient 4 | Patient 5 | |
| Initialer och födelsedatum | |||||
| Ögonfärg | |||||
| Provtyp | |||||
| Provplats | |||||
| Saliv | |||||
| WHålblod | |||||
| Plasma | |||||
| Tumörlivbar | |||||
| Vävnad Normal Livskraftig | |||||
| Tumor Mohs flytande kväve | |||||
| Vävnad Normal flytande kväve | |||||
| slides |
Tabell 1: Checklista för att spela in samplingar. Uppgifter som spåras och spelas in med varje prov som samlats in inkluderar patientinitialer, födelsedatum och ögonfärg (för hudtyp) samt lokaliseringPå avlägsnandet av provet. Antalet salivprover, bloduppsamlingsvolymer och antalet insamlade livsdugliga och konserverade vävnadsprover upptecknas också som referenser för tilldelningar till senare användning. Vänligen klicka här för att ladda ner den här filen.
För att validera provinsamlingsprocedurer har varje provtyp testats i applikationer nedströms. Med användning av modifikationer av tidigare tekniker 12 har tumör och ANT framgångsrikt använts i protein- och RNA-isolering och kan potentiellt användas för DNA-isolering. Livskraftiga explanter som är etablerade från vävnadssektionerna har utvärderats av mikroskopi, medan lagrade histologiska diabilder har använts för immunhistokemi och immunofluorescens.
Genom att följa protokollet som beskrivs här är det möjligt att förlänga denna modell till andra dermatologikliniker, andra tumortyper (som melanom), Och andra kirurgiska specialiteter och praxis för att tillhandahålla mänskliga vävnadsprover för mångfacetterad forskning kring humankanker. Små modifikationer av detta protokoll är sannolikt nödvändiga för andra metoder, men i princip är detta protokoll tillämpligt på alla kirurgiska metoder som rutinmässigt kasserar patientprover som samlats under patientbehandling.
Protocol
Representative Results
Discussion
Författarens vetskap är detta protokoll det första i sitt slag som fokuserar på klinisk upphandling av kutana vävnadsprover både i ett kostnadseffektivt och snabbt angreppssätt. Patienter som genomgår Mohs-mikrokirurgi planeras typiskt under specifika tidsintervaller, och insamlingen är begränsad till dessa perioder. Provuppsamling innebär ansträngning från den medicinska assistenten som är inblandad i patientvård, Mohs-histoteknologen som behandlar tumörproverna och en utsedd laboratoriepersonal som han…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av medel från Midwestern University College of Health Sciences Research Facilitation Grant, tilldelat EEH, och Midwestern University Office of Research och sponsrade program Intramural Grant, tilldelat KJL. Ytterligare stöd tillhandahölls av Affiliated Laboratories and Affiliate Dermatology. Vi tackar Sarah Potekhen, Jamie Barto, Stefani Fawks, Cody Jording, Stacie Schimke, Heather Kissel och Ali Zaidi för deras tekniska hjälp.
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

