Samtidig måling af HDAC1 og HDAC6 aktivitet i HeLa celler ved hjælp af UHPLC-MS
Summary
Den nuværende metode tjener til at identificere isoform-specifikke hæmmere af Histon deacetyltransferase (HDAC) i HeLa celler af UHPLC-MS analysen af flere substrater. Dette er et antistof-fri metode udviklet for at afspejle HDAC1 og HDAC6 aktivitet i levende celle miljø, i modsætning til single-isoform celle-fri assays.
Abstract
Søgning efter nye Histon deacetylase (HDAC) hæmmere er af stigende interesse for drug discovery. Isoform selektivitet har været i søgelyset siden vedtagelsen af romidepsin, en klasse jeg HDAC inhibitor for kræftbehandling, og den kliniske undersøgelse af HDAC6-specifikke hæmmere for myelomatose. Den nuværende metode bruges til at bestemme den hæmmende aktivitet test tinforbindelser på HDAC1 og HDAC6 i celler. Isoform aktivitet måles ved hjælp af ultra-high-performance væskekromatografi-massespektrometri (UHPLC-MS) analyse af specifikke substrater inkuberes med behandlede og ubehandlede HeLa celler. Metoden har fordelen, afspejler den endogene HDAC aktivitet inden for celle-miljøet i modsætning til celle-fri biokemiske analyser udført på isolerede isoformer. Endvidere, fordi den er baseret på kvantitativ bestemmelse af syntetiske substrater, metoden kræver ikke antistof anerkendelse af endogene acetyleret proteiner. Det er let at tilpasse til flere cellelinjer og en automatiseret proces. Metoden har allerede vist sig nyttige i at finde HDAC6-selektiv forbindelser i neuroblasts. Repræsentative resultater er vist her med standard HDAC-hæmmere trichostatin en (ikke-specifik), MS275 (HDAC1-specifik), og tubastatin en (HDAC6-specifik) ved hjælp af HeLa celler.
Introduction
HDAC’er tilhører en familie af enzymer, at deacetylate histoner kromatin struktur. De også har andre protein substrater i cytosol og er placeret i forskellige celle rum. Ialt 18 HDAC isoformer er konstateret indtil nu og har været relateret til flere celle mekanismer, herunder regulering af transkriptionsfaktorer og Gen-ekspression, samt celle signalering og transportere1,2,3,4,5,6,7. Katalytisk HDAC-hæmmere er dukket op som potentielle terapeutiske lægemidler for kræftbehandling. De fleste HDAC-hæmmere i øjeblikket godkendt af FDA er til behandling af T-celle lymfom og myelomatose, og uspecifikke HDAC-hæmmere, såsom vorinostat (SAHA), belinostat og panobinostat8,9. Imidlertid en række bivirkninger er blevet forbundet med pan-hæmmere, og Søg efter isoform-specifikke små molekyler er et varmt emne i medicinsk kemi og drug discovery. Derfor, klassen jeg (HDAC1-3 og HDAC8) selektive hæmmer romidepsin er et allerede godkendt lægemiddel10, mens HDAC6-specifikke hæmmere er i øjeblikket under kliniske forsøg, med øget terapeutiske potentiale i myelomatose11,12,13,14,15.
Screening assays for at karakterisere HDAC er hæmmere baseret på dyrkning af en HDAC bærematerialet med en enzymatisk kilde (enkelt isoform, nukleare ekstrakt eller celle lysate). Underlaget er normalt en lille peptid sekvens indeholdende en acetyl lysin rest koblet til en cleavable fluorophore (fx cumarin), såsom N-(4-methyl-7-aminocoumarinyl)-Nα-(t-butoxycarbonyl)-Nω-acetyllysineamide (MAL)16. For at skelne mellem isoform-specifikke aktiviteter, separat celle-fri assays involverer hver isoform er nødvendigt og kan ikke afspejle den reelle isoform aktivitet i levende celler. Isoform-specifikke substrater er kommercielt tilgængelige, såsom benzyl (S)-[1-(4-methyl-2-oxo-2H-chromen-7-ylcarbamoyl)-5-propionylaminopentyl]carbamate (MOCPAC, HDAC1 særlige substrat) og (S)-[5-acetylamino-1-(2-oxo-4-trifluoromethyl-2H-chromen-7-ylcarbamoyl)pentyl]carbamic syre tert-butyl ester (BATCP, HDAC6 særlige substrat) (figur 1B). Dog vil en multi substrat blanding indeholdende MAL, MOCPAC og BATCP givet til levende celler ikke tillade påvisning af de enkelte deacetylated produkter ved fluorometriske måling, eftersom at de er forsynet med den samme cleavable fluorophore.
Metoden beskrevet her giver mulighed for påvisning og relative kvantificering af hver substrat og dens deacetylated produkt i HeLa celler ved hjælp af en multi substrat assay efterfulgt af UHPLC-ESI-MS/MS analyse17. En HDAC assay er udført på HeLa celler at aktivere direkte identifikation af HDAC hæmmende aktivitet og specificitet test tinforbindelser på endogene HDAC’er. Der er fokus på HDAC1 og HDAC6, som evalueres samtidig. For at opnå disse enzymatisk målinger i et enkelt inkubation assay, tilføjes en blanding af uspecifikke og specifikke HDAC substrater behandlede og ubehandlede HeLa celler belagt på en 96-brønd plade. Efter en inkubation trin mængden celler til at frigive substraterne og deres respektive reaktionsprodukter, som er adskilt og påvises ved hjælp af en UHPLC-MS metoden (figur 1 c). De deacetylated produkter MAL, MOCPAC og BATCP underlag er deacetylated MAL (dMAL), deacetylated MOCPAC (dMOCPAC) og deacetylated BATCP (dBATCP), henholdsvis. Dosis-respons-kurver kan bygges med aktive forbindelser.
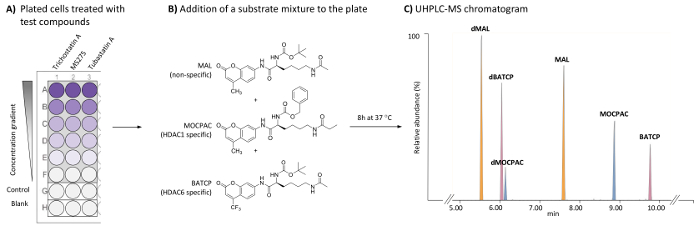
Figur 1: generel ordning for celle-baserede HDAC analysen til at identificere HDAC1 og HDAC6 specifikke hæmmere af UHPLC-MS analyse af flere substrater. (A) ordning af en typisk 96-brønd plade der indeholder behandlet (test forbindelser) og ubehandlet (kontrol) HeLa celler samt celle-fri blanks. (B) kemiske struktur af substrater tilføjet som en blanding (21 µM) til at være deacetylated af endogene HDAC’er. (C) typisk UHPLC-MS kromatogrammet viser toppene af de tilføjede substrater (MAL, MOCPAC og BATCP) og deres deacetylated produkter (dMAL, dMOCPAC, og dBACTP, henholdsvis). Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
HDAC-hæmning er et varmt emne i drug discovery, med aktuelle fokus på HDAC6-selektiv hæmmere for kræft terapi21. HDAC selektivitet vurderes normalt af en serie af høj overførselshastighed, celle-gratis assays, som har til hensigt at fastslå de hæmmende potens mod individuelle HDAC isoformer21. Dog af en inhibitor selektivitet skal desuden bekræftes i levende celler ved at evaluere acetylation status af endogene protein substrater, såsom histoner (for klasse I HDAC…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne anerkender COST Action CM1406 (epigenetiske kemisk biologi). Forskning rapporteret i denne publikation blev støttet af instituttets Pierre Mercier.
Materials
| BATCP | Sigma-Aldrich | B4061 | |
| MAL | Sigma-Aldrich | SCP0168 | Synonym: BOC-Ac-Lys-AMC |
| MOCPAC | Sigma-Aldrich | M2195 | |
| MS275 | Sigma-Aldrich | EPS002 | |
| Trichostatin A | Sigma-Aldrich | T8552 | |
| Tubastatin A | Sigma-Aldrich | SML0044 | |
| Acetonitrile, HPLC grade | Fisher Scientific | 10660131 | |
| Formic acid, LC/MS grade | Fisher Scientific | 10596814 | |
| H2O, HPLC grade | distilled H2O filtered through a Milli-Q purification system | ||
| HeLa cells | ATCC | ATCC CRM-CCL-2 | |
| Cell dissociation reagent TrypLE Express | ThermoFisher Scientific | 12604013 | |
| DMSO, cell culture grade | Applichem | 146463 | |
| DPBS | ThermoFisher Scientific | 14190144 | |
| Fetal bovine serum | Biowest | S1810 | |
| MEM | ThermoFisher Scientific | 22561021 | |
| Penicillin-Streptomycin | Bioconcept | 4-01F00-H | |
| 10X RIPA buffer | Abcam | ab156034 | |
| SigmaFast protease inhibitor tablets | Sigma-Aldrich | S8820 | |
| 96-well plates, sterile, flat-bottom, tissue culture treated Corning | VWR | 29442-058 | |
| 96-well plates, non-sterile, V-bottom Corning | VWR | 29442-404 | used in the centrifugation step |
| 96-well plate, conical bottom, Nunc | ThermoFisher Scientific | 249944 | compatible with the Acquity UHPLC system |
| T75 cell culture flasks Corning | Sigma-Aldrich | CLS430641 | |
| Peelable heat sealing foil | Waters | 186002789 | |
| Acquity UPLC system | Waters | ||
| Eppendorf Centrifuge 5810 R | Fisher Scientific | 05-413-323 | |
| Integration software: MassLynx V4.1 | Waters | Catalog number not available | |
| Combi thermo-sealer SP-0669/240 | Waters | Catalog number not available | |
| Quattro micro API Tandem Quadrupole System | Waters | Catalog number not available |
References
- Arrowsmith, C. H., Bountra, C., Fish, P. V., Lee, K., Schapira, M. Epigenetic protein families: a new frontier for drug discovery. Nat Rev Drug Discov. 11 (5), 384-400 (2012).
- Henikoff, S., Greally, J. M. Epigenetics, cellular memory and gene regulation. Curr Biol. 26 (14), R644-R648 (2016).
- Kim, C., et al. HDAC6 inhibitor blocks amyloid beta-induced impairment of mitochondrial transport in hippocampal neurons. PLoS One. 7 (8), (2012).
- Kawaguchi, Y., et al. The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress. Cell. 115 (6), 727-738 (2003).
- Zhao, Y., et al. Acetylation of p53 at lysine 373/382 by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1). Mol Cell Biol. 26 (7), 2782-2790 (2006).
- Berger, S. L. Histone modifications in transcriptional regulation. Curr Opin Genet Dev. 12 (2), 142-148 (2002).
- Simões-Pires, C., et al. HDAC6 as a target for neurodegenerative diseases: what makes it different from the other HDACs?. Mol Neurodegener. 8 (7), 1-16 (2013).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone deacetylase inhibitors in clinical studies as templates for new anticancer agents. Molecules. 20 (3), 3898-3941 (2015).
- Manal, M., Chandrasekar, M. J., Gomathi Priya, J., Nanjan, M. J. Inhibitors of histone deacetylase as antitumor agents: A critical review. Bioorg Chem. 67, 18-42 (2016).
- Mack, G. S. To selectivity and beyond. Nat Biotech. 28 (12), 1259-1266 (2010).
- . Study of ACY-1215 alone and in combination with bortezomib and dexamethasone in multiple myeloma (ACY-1215) Available from: https://clinicaltrials.gov/ct2/show/NCT01323751 (1211)
- . Study of ACY-1215 in combination with lenalidomide, and dexamethasone in multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT01583283 (2012)
- . 13ACY-1215 (ricolinostat) in combination with pomalidomide and low-dose dex in relapsed-and-refractory multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT01997840 (2013)
- . Study of ACY-241 alone and in combination with pomalidomide and dexamethasone in multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT02400242 (2015)
- Yee, A. J., et al. Ricolinostat plus lenalidomide, and dexamethasone in relapsed or refractory multiple myeloma: a multicentre phase 1b trial. Lancet Oncol. 17 (11), 1569-1578 (2016).
- Jung, M. Homogenous non-isotopic assays for histone deacetylase activity. Expert Opin Ther Pat. 13 (6), 935 (2003).
- Zwick, V., Simões-Pires, C., Cuendet, M. Cell-based multi-substrate assay coupled to UHPLC-ESI-MS/MS for a quick identification of class-specific HDAC inhibitors. J Enzyme Inhibi Med Chem. 31 (1), 209-214 (2016).
- Khan, N., et al. Determination of the class and isoform selectivity of small-molecule histone deacetylase inhibitors. Biochem J. 409 (2), 581-589 (2008).
- Glaser, K. B., et al. Differential protein acetylation induced by novel histone deacetylase inhibitors. Biochem Biophys Res Commun. 325 (3), 683-690 (2004).
- Butler, K. V., et al. Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A. J Am Chem Soc. 132 (31), 10842-10846 (2010).
- Jung, M., Yong, K. -. J., Velena, A., Lee, S., Sippl, W., Jung, M. Cell-Based Assays for HDAC Inhibitor Hit Validation. Epigenetic Targets in Drug Discovery. , (2010).
- Milli, A., et al. Proteomic analysis of cellular response to novel proapoptotic agents related to atypical retinoids in human IGROV-1 ovarian carcinoma cells. J Proteome Res. 10 (3), 1191-1207 (2011).
- Zwick, V., et al. Synthesis of a selective HDAC6 inhibitor active in neuroblasts. Bioorg Med Chem Lett. 26 (20), 4955-4959 (2016).
- Ciossek, T., Julius, H., Wieland, H., Maier, T., Beckers, T. A homogeneous cellular histone deacetylase assay suitable for compound profiling and robotic screening. Anal Biochem. 372 (1), 72-81 (2008).
- Heltweg, B., Dequiedt, F., Marshall, B. L., Brauch, C., Yoshida, M., et al. Subtype selective substrates for histone deacetylases. J Med Chem. 47 (21), 5235-5243 (2004).
- Copeland, R. A. . Evaluation of enzyme inhibitors in drug discovery. , (2005).

