Medición simultánea de HDAC1 y HDAC6 actividad en HeLa células usando UHPLC-MS
Summary
El presente método sirve para identificar inhibidores de la isoforma específica de histona deacetilasas (HDAC) en células HeLa por el análisis UHPLC-MS de múltiples sustratos. Este es un método libre de anticuerpos desarrollado para reflejar actividad HDAC1 y HDAC6 en la vida del ambiente celular, en contraste con solo isoform análisis sin células.
Abstract
La búsqueda de nuevos inhibidores de histona deacetilasa (HDAC) es de creciente interés en el descubrimiento de medicamentos. Isoforma selectividad ha sido el centro de atención desde la aprobación de la romidepsina, una clase que las HDACS inhibidor para el tratamiento del cáncer y la investigación clínica de los inhibidores de la HDAC6 específico para el mieloma múltiple. El presente método permite determinar la actividad inhibitoria de los compuestos de prueba en HDAC1 y HDAC6 en las células. La actividad de la isoforma se mide utilizando la cromatografía líquida de ultra alto rendimiento-análisis de espectrometría de masas (UHPLC-MS) de sustratos específicos que se incubaron con células HeLa tratadas y no tratadas. El método tiene la ventaja de reflejar la actividad HDAC endógena dentro del entorno de la célula, en contraste con ensayos bioquímicos sin células en isoformas aislado. Por otra parte, porque se basa en la cuantificación de sustratos sintéticos, el método no requiere el reconocimiento de anticuerpos de proteínas endógenas acetilados. Es fácilmente adaptable a varias líneas celulares y un proceso automatizado. El método ya ha demostrado ser útil en la búsqueda de compuestos HDAC6 selectivo en neuroblastos. Aquí se muestran resultados representativos con el estándar HDAC inhibidores tricostatina A (no específica), MS275 (HDAC1-específica), y tubastatin (HDAC6-específico) con células HeLa.
Introduction
Las HDACs pertenecen a una familia de enzimas capaces de deacetylate histonas dentro de la estructura de la cromatina. También tienen otros substratos de la proteína en el citosol y se encuentran en diferentes compartimentos celulares. Un total de 18 HDAC isoformas se han identificado hasta ahora y se han relacionado con varios mecanismos de la célula, incluyendo la regulación de factores de transcripción y expresión génica, así como la señalización celular y transporte1,2,3,4,5,6,7. Inhibidores de la HDAC catalíticos han surgido como potenciales medicamentos para terapia del cáncer. Más inhibidores de las HDACS actualmente aprobados por la FDA para el tratamiento del linfoma del T-cell y el mieloma múltiple y son inhibidores de las HDACS no específicos, tales como vorinostat (SAHA), belinostat y panobinostat8,9. Sin embargo, una serie de efectos secundarios se han asociado con inhibidores de la cacerola, y la búsqueda de moléculas pequeñas de la isoforma específica es un tema candente en descubrimiento de química y drogas medicinal. En consecuencia, la clase me romidepsina inhibidor selectivo (HDAC1-3 y HDAC8) es un medicamento ya aprobado10, mientras que los inhibidores específicos de la HDAC6 son actualmente bajo ensayos clínicos, con mayor potencial terapéutico en el mieloma múltiple11,12,13,14,15.
Selección de ensayos para caracterizar las HDACS inhibidores están basados en la incubación de un sustrato HDAC con una fuente enzimática (isoforma sola, extracto nuclear o lisado de célula). El sustrato es generalmente una secuencia de péptido pequeño que contiene un residuo de lisina de acetilo acoplado a un fluoróforo divisible (por ejemplo, cumarina), como N-(4-methyl-7-aminocoumarinyl)-Nα-(t-butoxycarbonyl)-Nω-acetyllysineamide (MAL)16. Para distinguir entre las actividades de la isoforma específica, análisis sin células separados que implica cada isoforma son necesarios y podrían no reflejar la actividad de la isoforma real en las células vivas. Específica de isoforma sustratos están comercialmente disponibles, como bencílico (S)-[1-(4-methyl-2-oxo-2H-chromen-7-ylcarbamoyl)-5-propionylaminopentyl]carbamate (MOCPAC, HDAC1 sustrato específico) y (éster terc-butílico ácido de S)-[5-acetylamino-1-(2-oxo-4-trifluoromethyl-2H-chromen-7-ylcarbamoyl)pentyl]carbamic (BATCP, sustrato específico HDAC6) (figura 1B). Sin embargo, una mezcla de varios sustrato que contiene MAL, MOCPAC y BATCP a las células vivas no permitirá la detección de los productos desacetilados de medición fluorométrica, dado que llevan el mismo fluoróforo escindibles.
El método aquí descrito permite la detección y cuantificación relativa de cada sustrato y su producto desacetilado en células HeLa, usando un análisis de múltiples sustrato seguido de UHPLC-ESI-MS/MS análisis17. Un análisis de las HDACS se lleva a cabo en las células HeLa que permitan la identificación directa de la actividad inhibitoria de las HDACS y de la especificidad de la prueba de compuestos sobre las HDACs endógenas. Hay un enfoque en HDAC1 y HDAC6, que son evaluados al mismo tiempo. Para lograr estas mediciones enzimáticas en un ensayo de incubación única, una mezcla de sustratos HDAC no específicos y específicos se agrega a las células HeLa tratadas y no tratadas sobre una placa de 96 pocillos. Tras un paso de incubación, las células son sometidas a lisis para liberar a los sustratos y sus productos de la reacción respectiva, que se separan y detectan utilizando un método de UHPLC-MS (figura 1). Los productos desacetilados de los sustratos MAL MOCPAC y BATCP son el MAL desacetilado (dMAL) MOCPAC desacetilado (dMOCPAC) y BATCP desacetilado (dBATCP), respectivamente. Curvas de dosis-respuesta se pueden construir con compuestos activos.
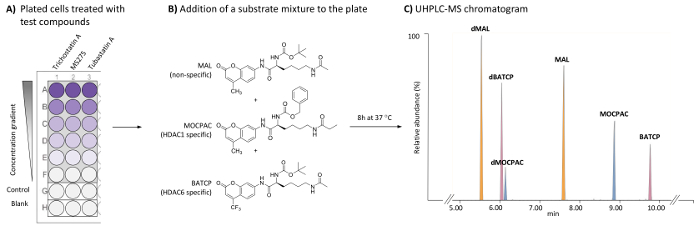
Figura 1: esquema General para el análisis de las HDACS basadas en células identificar inhibidores específicos de HDAC1 y HDAC6 por el análisis UHPLC-MS de múltiples sustratos. (A) esquema de una típica placa de 96 pocillos que contienen tratados (compuestos de prueba) y las células HeLa sin tratamiento (control), así como espacios libres de células. (B) estructura química de sustratos ha añadido como una mezcla (21 μm) a desacetilado de HDACs endógenas. (C) cromatograma típico UHPLC-MS que muestra los picos de los sustratos agregados (MAL MOCPAC y BATCP) y sus productos desacetilados (dMAL, dMOCPAC y dBACTP, respectivamente). Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Inhibición de la HDAC es un tema candente en el descubrimiento de medicamentos, con un enfoque actual en HDAC6 selectivo inhibidores de cáncer terapia21. Selectividad HDAC es evaluado generalmente por una serie de ensayos de alto rendimiento, libres de células, que pretenden determinar la potencia inhibitoria hacia individuales HDAC isoformas21. Sin embargo, la selectividad de un inhibidor debe ser además confirmada en las células vivas por evaluar el estado de acetila…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores reconocen costo acción CM1406 (epigenéticos Biología química). Investigación en esta publicación fue apoyada por la Fundación Pierre Mercier.
Materials
| BATCP | Sigma-Aldrich | B4061 | |
| MAL | Sigma-Aldrich | SCP0168 | Synonym: BOC-Ac-Lys-AMC |
| MOCPAC | Sigma-Aldrich | M2195 | |
| MS275 | Sigma-Aldrich | EPS002 | |
| Trichostatin A | Sigma-Aldrich | T8552 | |
| Tubastatin A | Sigma-Aldrich | SML0044 | |
| Acetonitrile, HPLC grade | Fisher Scientific | 10660131 | |
| Formic acid, LC/MS grade | Fisher Scientific | 10596814 | |
| H2O, HPLC grade | distilled H2O filtered through a Milli-Q purification system | ||
| HeLa cells | ATCC | ATCC CRM-CCL-2 | |
| Cell dissociation reagent TrypLE Express | ThermoFisher Scientific | 12604013 | |
| DMSO, cell culture grade | Applichem | 146463 | |
| DPBS | ThermoFisher Scientific | 14190144 | |
| Fetal bovine serum | Biowest | S1810 | |
| MEM | ThermoFisher Scientific | 22561021 | |
| Penicillin-Streptomycin | Bioconcept | 4-01F00-H | |
| 10X RIPA buffer | Abcam | ab156034 | |
| SigmaFast protease inhibitor tablets | Sigma-Aldrich | S8820 | |
| 96-well plates, sterile, flat-bottom, tissue culture treated Corning | VWR | 29442-058 | |
| 96-well plates, non-sterile, V-bottom Corning | VWR | 29442-404 | used in the centrifugation step |
| 96-well plate, conical bottom, Nunc | ThermoFisher Scientific | 249944 | compatible with the Acquity UHPLC system |
| T75 cell culture flasks Corning | Sigma-Aldrich | CLS430641 | |
| Peelable heat sealing foil | Waters | 186002789 | |
| Acquity UPLC system | Waters | ||
| Eppendorf Centrifuge 5810 R | Fisher Scientific | 05-413-323 | |
| Integration software: MassLynx V4.1 | Waters | Catalog number not available | |
| Combi thermo-sealer SP-0669/240 | Waters | Catalog number not available | |
| Quattro micro API Tandem Quadrupole System | Waters | Catalog number not available |
References
- Arrowsmith, C. H., Bountra, C., Fish, P. V., Lee, K., Schapira, M. Epigenetic protein families: a new frontier for drug discovery. Nat Rev Drug Discov. 11 (5), 384-400 (2012).
- Henikoff, S., Greally, J. M. Epigenetics, cellular memory and gene regulation. Curr Biol. 26 (14), R644-R648 (2016).
- Kim, C., et al. HDAC6 inhibitor blocks amyloid beta-induced impairment of mitochondrial transport in hippocampal neurons. PLoS One. 7 (8), (2012).
- Kawaguchi, Y., et al. The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress. Cell. 115 (6), 727-738 (2003).
- Zhao, Y., et al. Acetylation of p53 at lysine 373/382 by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1). Mol Cell Biol. 26 (7), 2782-2790 (2006).
- Berger, S. L. Histone modifications in transcriptional regulation. Curr Opin Genet Dev. 12 (2), 142-148 (2002).
- Simões-Pires, C., et al. HDAC6 as a target for neurodegenerative diseases: what makes it different from the other HDACs?. Mol Neurodegener. 8 (7), 1-16 (2013).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone deacetylase inhibitors in clinical studies as templates for new anticancer agents. Molecules. 20 (3), 3898-3941 (2015).
- Manal, M., Chandrasekar, M. J., Gomathi Priya, J., Nanjan, M. J. Inhibitors of histone deacetylase as antitumor agents: A critical review. Bioorg Chem. 67, 18-42 (2016).
- Mack, G. S. To selectivity and beyond. Nat Biotech. 28 (12), 1259-1266 (2010).
- . Study of ACY-1215 alone and in combination with bortezomib and dexamethasone in multiple myeloma (ACY-1215) Available from: https://clinicaltrials.gov/ct2/show/NCT01323751 (1211)
- . Study of ACY-1215 in combination with lenalidomide, and dexamethasone in multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT01583283 (2012)
- . 13ACY-1215 (ricolinostat) in combination with pomalidomide and low-dose dex in relapsed-and-refractory multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT01997840 (2013)
- . Study of ACY-241 alone and in combination with pomalidomide and dexamethasone in multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT02400242 (2015)
- Yee, A. J., et al. Ricolinostat plus lenalidomide, and dexamethasone in relapsed or refractory multiple myeloma: a multicentre phase 1b trial. Lancet Oncol. 17 (11), 1569-1578 (2016).
- Jung, M. Homogenous non-isotopic assays for histone deacetylase activity. Expert Opin Ther Pat. 13 (6), 935 (2003).
- Zwick, V., Simões-Pires, C., Cuendet, M. Cell-based multi-substrate assay coupled to UHPLC-ESI-MS/MS for a quick identification of class-specific HDAC inhibitors. J Enzyme Inhibi Med Chem. 31 (1), 209-214 (2016).
- Khan, N., et al. Determination of the class and isoform selectivity of small-molecule histone deacetylase inhibitors. Biochem J. 409 (2), 581-589 (2008).
- Glaser, K. B., et al. Differential protein acetylation induced by novel histone deacetylase inhibitors. Biochem Biophys Res Commun. 325 (3), 683-690 (2004).
- Butler, K. V., et al. Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A. J Am Chem Soc. 132 (31), 10842-10846 (2010).
- Jung, M., Yong, K. -. J., Velena, A., Lee, S., Sippl, W., Jung, M. Cell-Based Assays for HDAC Inhibitor Hit Validation. Epigenetic Targets in Drug Discovery. , (2010).
- Milli, A., et al. Proteomic analysis of cellular response to novel proapoptotic agents related to atypical retinoids in human IGROV-1 ovarian carcinoma cells. J Proteome Res. 10 (3), 1191-1207 (2011).
- Zwick, V., et al. Synthesis of a selective HDAC6 inhibitor active in neuroblasts. Bioorg Med Chem Lett. 26 (20), 4955-4959 (2016).
- Ciossek, T., Julius, H., Wieland, H., Maier, T., Beckers, T. A homogeneous cellular histone deacetylase assay suitable for compound profiling and robotic screening. Anal Biochem. 372 (1), 72-81 (2008).
- Heltweg, B., Dequiedt, F., Marshall, B. L., Brauch, C., Yoshida, M., et al. Subtype selective substrates for histone deacetylases. J Med Chem. 47 (21), 5235-5243 (2004).
- Copeland, R. A. . Evaluation of enzyme inhibitors in drug discovery. , (2005).

