Dissezione multiproteici segnalazione di purificazione di affinità di complementazione bimolecolare (BiCAP)
Summary
Questo manoscritto descrive il protocollo per purificazione di affinità complementazione bimolecolare (BiCAP). Questo metodo novello facilita l’isolamento specifico e caratterizzazione proteomica a valle di qualsiasi due proteine interagenti, mentre escluse ONU-complessato singole proteine, nonché complessi formati con concorrenti partner di legame.
Abstract
L’assemblaggio dei complessi della proteina è un meccanismo centrale sottostante la regolazione di molte vie di segnalazione delle cellule. Degli obiettivi principali della ricerca biomedica è decifrare come questi complessi proteici dinamica agiscono per integrare i segnali provenienti da più origini per dirigere una specifica risposta biologica, e come questo diventa deregolamentato in molte impostazioni di malattia. Nonostante l’importanza di questo meccanismo biochimico chiave, c’è una mancanza di tecniche sperimentali che possono facilitare la deconvoluzione specifico e sensibile di questi complessi di segnalazione multi-molecolari.
Qui questa lacuna viene risolto mediante la combinazione di un’analisi di complementazione della proteina con un nanobody conformazione-specifici, che abbiamo chiamato purificazione di affinità complementazione bimolecolare (BiCAP). Questa tecnica novella facilita l’isolamento specifico e caratterizzazione proteomica a valle di qualsiasi coppia di proteine interagenti, ad esclusione di ONU-complessato singole proteine e complessi formati con concorrenti partner di legame.
La tecnica di BiCAP è adattabile a una vasta gamma di analisi sperimentale a valle, e l’alto grado di specificità offerto da questa tecnica permette più sfumate indagini nelle meccaniche di assiemi complessi della proteina che è attualmente possibile utilizzando tecniche di purificazione di affinità standard.
Introduction
Assiemi complessi della proteina sono un processo chiave nel mantenimento della specificità spatiotemporal di molti segnalazione vie1,2. Mentre la natura critica di questo ruolo normativo è ampiamente riconosciuta, c’è una mancanza di tecniche sperimentali disponibili a scrutare questi complessi. Maggior parte degli studi interattomica concentrarsi sulle interazioni con singole proteine, o l’arricchimento sequenza dei singoli componenti complessi. Qui presentiamo una tecnica per l’isolamento di un dimero di proteina specifica mentre escluse le moiety individuali di proteine componente, nonché complessi formati con associazione partner3in competizione. Abbiamo chiamato questa tecnica di purificazione di affinità complementazione bimolecolare (BiCAP), come esso è una combinazione di una precedentemente esistenti analisi di complementazione frammento della proteina, bimolecolare fluorescenza complementazione (BiFC), con l’uso novello di un nanobody ricombinante conformazione-specifici verso GFP e suoi derivati (vedere tabella materiali).
Un’analisi di complementazione del frammento proteico tipico si basa sull’espressione di proteine “esca” e “preda” fusa per dividere frammenti di giornalisti come luciferase4, β-galattosidasi5o la proteina fluorescente verde (GFP)6 ( Figura 1A). Attraverso l’interazione delle proteine esca e preda, i domini di reporter di Spalato sono incoraggiati a ripiegare in una struttura funzionale, consentendo l’interazione dell’esca e preda di proteine per essere visualizzati o quantificato. BiCAP è stato adattato da una versione di questa tecnica che ha fatto uso di frammenti della variante GFP Venus. Analisi di complementazione di proteina fluorescente sono un metodo popolare per la visualizzazione di interazioni proteina-proteina in una cellula viva, ma fino ad ora sono state limitate a questo una funzione7. BiCAP rappresenta un progresso significativo a questo proposito, come questa tecnica consente non solo per la visualizzazione, ma anche l’isolamento e interrogatori dell’interazione proteina-proteina risultante.
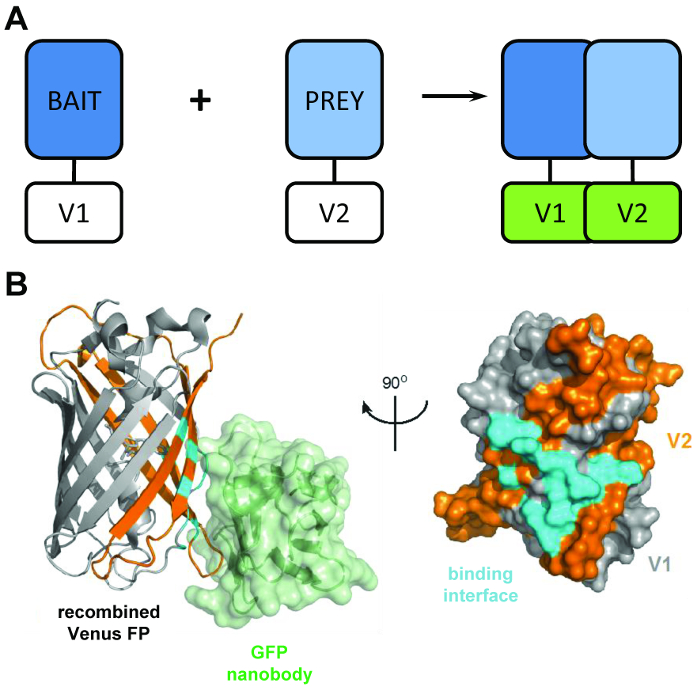
Figura 1: lo strutturale principale dietro la tecnica BiCAP. (A) uno schema che illustra il principale dietro mostrando complementazione bimolecolare fluorescenza le proteine ‘esca’ e ‘preda’ contrassegnati con il N-terminale V1 o V2 del C-terminale frammenti della proteina Venus full-length. (B) analisi strutturale di (ciano) l’interfaccia di interazione tra la GFP nanobody (verde) e Venere ricombinata, indicante la posizione delle V1 (grigio) e V2 (arancione) frammenti (PDB adesione 3OGO). Questa figura è ripubblicato fromCroucher et al.3 ristampato con il permesso di AAAS. Clicca qui per visualizzare una versione più grande di questa figura.
BiCAP tecnica fa uso di due frammenti non fluorescente di Venere (denominato V1 e V2) che associano un basso grado di affinità, a meno che non si verifica un’interazione tra i loro soci di fusione. In questo caso, i domini di due split ripiegare nella struttura funzionale del β-barilotto del fluoroforo (Figura 1B)6. L’innovazione chiave di BiCAP deriva dall’introduzione del ricombinante nanobody GFP, che riconosce un epitopo tridimensionale sul β-barilotto di GFP (e varianti come Venus) che è presente il fluoroforo correttamente ricombinato e piegato ( solo Figura 1B)8. Fondamentalmente, il nanobody GFP non viene associato a uno dei singoli frammenti di Venus. Questo facilita l’isolamento dei dimeri della proteina solo dopo che le due proteine hanno formato un complesso di loro spontanea volontà, portando a risultati più rappresentativi che quelle acquisite da metodi che fanno uso di interazioni chimicamente indotto, forzato9.
BiCAP è una tecnica potente che si concentra in particolare sui complessi della multi-proteina, che potenzialmente possono essere combinati con un numero di applicazioni a valle per migliorare il livello di dettaglio della nostra comprensione del ruolo che questi complessi svolgere nella trasduzione del segnale . Esso comprende anche la caratteristica importante di permettendo visualizzazione di proteine interazioni in situ. Ad oggi, BiCAP è stata dimostrata come un efficace metodo di analizzare Interactoma dei recettori tirosina chinasi (RTK) dimeri3, ma l’adattabilità di questo metodo significa che possa essere adottata in qualsiasi contesto di interazione della proteina.
Protocol
Representative Results
Discussion
BiCAP è un potente metodo per isolare i dimeri di proteina specifica escludendo i singoli componenti e loro concorrenti associazione partner3. BiCAP si basa sull’adattamento di un’analisi di complementazione di fluorescenza della proteina chiamata BiFC6. I metodi esistenti, tra cui saggi di legatura BiFC e vicinanza, sono stati ampiamente utilizzati per visualizzare e quantificare le interazioni della proteina in cellule vive7, ma non hanno fornito …
Disclosures
The authors have nothing to disclose.
Acknowledgements
RDC è un Cancer Institute NSW Fellow e D.N.S era precedentemente un Cancer Institute NSW Fellow. I risultati di ricerca presentati in questo manoscritto sono stati finanziati da Cancer Institute NSW (13/FRL/1-02 e 09/CDF/2-39), NHMRC (progetto Grant GNT1052963), Science Foundation Ireland (11/SIRG/B2157), NSW Office of Science e ricerca medica, famiglia ospite Fellowship e Mostyn Family Foundation. J.f.h. e R.S. sono stati destinatari di un australiano premio post-laurea.
Materials
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid – Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) – 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
References
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).

