पहचान और Oligopotent और वंश की अलगाव-प्रतिबद्ध माइलॉयड Progenitors से माउस अस्थि मज्जा
Summary
हम कैसे पहचान करने के लिए और murine अस्थि मज्जा से माइलॉयड progenitors के 6 सबसेट चुंबकीय और प्रतिदीप्ति छंटाई (एमएसीएस और FACS) का एक संयोजन का उपयोग कर अलग करने के लिए प्रदर्शित करता है । इस प्रोटोकॉल के लिए इन विट्रो संस्कृति परख (methylcellulose या तरल संस्कृतियों) में इस्तेमाल किया जा सकता है, vivo adoption हस्तांतरण प्रयोगों में , और आरएनए/
Abstract
माइलॉयड progenitors कि उपज न्यूट्रोफिल, monocytes और वृक्ष कोशिकाओं (dc) में पहचाना जा सकता है और रक्त और प्रतिरक्षा विश्लेषण के लिए चूहों की अस्थि मज्जा से अलग । उदाहरण के लिए, सेलुलर और माइलॉयड जनक आबादी की आणविक संपत्तियों के अध्ययन ल्यूकेमिया से प्रभावित परिवर्तन, या प्रदर्शन कैसे प्रतिरक्षा प्रणाली रोगजनक जोखिम का जवाब देने के लिए अंतर्निहित तंत्र प्रकट कर सकते हैं । पहले वर्णित माइलॉयड जनक पहचान के लिए प्रवाह cytometry रणनीतियों कई क्षेत्रों में महत्वपूर्ण प्रगति सक्षम है, लेकिन अंशों वे की पहचान बहुत विषम हैं । सबसे अधिक इस्तेमाल किया गेटिंग रणनीतियों अस्थि मज्जा भिन्न है कि वांछित आबादी के लिए समृद्ध कर रहे हैं को परिभाषित, लेकिन यह भी “दूषित” progenitors की बड़ी संख्या में होते हैं. हमारे हाल के अध्ययनों से इस विविधता का ज्यादा हल किया है, और प्रोटोकॉल हम यहां मौजूद oligopotent और वंश की 6 उपआबादी के अलगाव की अनुमति-2 से प्रतिबद्ध माइलॉयड progenitors पहले अस्थि मज्जा भिंन वर्णित है । प्रोटोकॉल 3 चरणों का वर्णन करता है: 1) अस्थि मज्जा कोशिकाओं के अलगाव, 2) टेम progenitors के लिए संवर्धन चुंबकीय द्वारा सक्रिय कोशिका छँटाई (एमएसीएस द्वारा वंश कमी), और 3) (सहित) प्रवाह cytometry द्वारा माइलॉयड जनक उपसमुच्चय की पहचान प्रतिदीप्ति-सक्रिय कक्ष छँटाई, FACS, यदि वांछित). इस दृष्टिकोण जनक ठहराव और अलगाव की एक किस्म के लिए इन विट्रो और vivo अनुप्रयोगों में अनुमति देता है, और पहले से ही रास्ते और न्युट्रोफिल, monocyte, और डीसी भेदभाव के तंत्र में उपंयास अंतर्दृष्टि झुकेंगे ।
Introduction
Monocytes, न्यूट्रोफिल, और वृक्ष कोशिकाओं (dc) माइलॉयड कोशिकाओं है कि टेम progenitors से पैदा होते हैं, मुख्य रूप से अस्थि मज्जा में, एक प्रक्रिया द्वारा myelopoiesis बुलाया । आम माइलॉयड progenitors (CMPs) माइलॉयड कोशिकाओं का उत्पादन करने की क्षमता है, साथ ही megakaryocytes और एरिथ्रोसाइट्स, लेकिन नहीं लसीकावत् कोशिकाओं । Granulocyte-monocyte progenitors (GMPs), जो CMPs से प्राप्त होते हैं, granulocytes और monocytes का उत्पादन करते हैं, लेकिन megakaryocyte और एरिथ्रोसाइट क्षमता खो चुके हैं. Monocytes और शास्त्रीय और plasmacytoid dc (cDCs/पीडीसी) भी progenitors द्वारा उत्पादित कर रहे हैं, जो आम monocyte से उत्पन्न करने के लिए सोचा-डीसी progenitors (MDPs), CMPs के रूप में जाना जाता है । वंश क्षमता के क्रमिक प्रतिबंध अंततः वंश में परिणाम प्रतिबद्ध progenitors: granulocyte progenitors, monocyte progenitors, और वृक्ष सेल progenitors (figure 1).
Weissman और सहकर्मियों ने बताया कि CMPs में पाए जाते हैं कि लिन– सी-किट+ Sca-1– (LKS–) CD34+ FcγRलो अंश माउस की अस्थि मज्जा, जबकि GMPs में समाहित हैं LKS– CD34+ FcγR हाय अंश1। हालांकि, इन “सीएमपी” और “जीएमपी” भिन्न बहुत विषम हैं. उदाहरण के लिए, “जीएमपी” अंश में वंश-कमिट granulocyte progenitors और monocyte progenitors1,2भी शामिल हैं । MDPs को CX3CR1+ Flt3+ CD115+ progenitors होने की सूचना अलग से दी गई थी जो CD34 और FcγR3,4को भी व्यक्त करती है । MDPs सीडीसी/pDC-उत्पादन आम डीसी progenitors (CDPs), जो सी-किट (CD117) के निचले स्तर व्यक्त करने के लिए सूचित किया गया है और LKS– अंश5में शामिल नहीं है दे ।
यह पहले से ही माना जाता था कि monocytes एक मार्ग (सीएमपी-जीएमपी-एचडीपी-monocyte) के माध्यम से उठता है । इस मॉडल के अनुरूप, monocyte प्रतिबद्ध progenitors द्वारा उत्पादित GMPs (नामित monocyte progenitors, एमपीएस)2 और MDPs (नामांकित कॉमन monocyte progenitors, cMoPs)6 को साझा सतह मार्कर अभिव्यक्ति के आधार पर एक ही कोशिकाओं को दिखाई . हालांकि, हम हाल ही में प्रदर्शित किया कि monocytes स्वतंत्र रूप से GMPs और MDPs द्वारा उत्पादित कर रहे हैं, और एकल सेल आरएनए अनुक्रमण7द्वारा सांसदों और cMoPs के बीच भेद करने में सक्षम थे.
हम हाल ही में संशोधित Weissman “सीएमपी” और “जीएमपी” गेटिंग रणनीति C57BL के 6 उपभागों की पहचान करने के लिए/6J माउस अस्थि मज्जा अलग oligopotent और वंश-प्रतिबद्ध माइलॉयड जनक सबसेट युक्त. हम पहले की रिपोर्ट है कि Ly6C और CD115 के लिए धुंधला oligopotent GMPs के अलगाव परमिट, साथ ही साथ granulocyte progenitors (जीपीएस) और monocyte progenitors (दोनों सांसदों और cMoPs, जो वर्तमान में हम अलग करने में असमर्थ हैं) से “जीएमपी” अंश2 (LKS – CD34+ FcγRहाय गेट; चित्रा 1) । हम बाद में प्रदर्शन किया है कि MDPs मुख्य रूप से “सीएमपी” अंश में पाया जाता है (LKS– CD34+ FcγRलो गेट), जो भी शामिलFlt3 + CD115lo और Flt3– सबसेट7 (चित्रा 1 ). सीएमपी-Flt3+ CD115lo भिन्न पैदावार दोनों GMPs और MDPs अपनाने पर स्थानांतरण. सीएमपी-Flt3– सबसेट progenitors सीएमपी-Flt3+ CD115लो कोशिकाओं और GMPs के बीच मध्यवर्ती होने के लिए दिखाई देते हैं. MDPs के विपरीत, दोनों सीएमपी-Flt3+ CD115लो और सीएमपी-Flt3– भिन्न भी megakaryocyte और एरिथ्रोसाइट क्षमता के अधिकारी.
यह नोट करने के लिए महत्वपूर्ण है, तथापि, कि यह वर्तमान में स्पष्ट नहीं है कि क्या “सीएमपी” भिन्न progenitors होते हैं कि वास्तव में oligopotent हैं (जैसे, सीएमपी के भीतर व्यक्तिगत कोशिकाओं-Flt3+ CD115lo अंश कि अधिकारी न्युट्रोफिल, monocyte, डीसी, megakaryocyte, और एरिथ्रोसाइट क्षमता), या वैकल्पिक रूप से, और अधिक प्रतिबंधित वंश क्षमता के साथ progenitors का एक मिश्रण शामिल हैं । कॉलोनी बनाने की परख (methylcellulose संस्कृतियों) granulocyte के साथ कोशिकाओं से पता चला (न्युट्रोफिल), एरिथ्रोसाइट, monocyte और megakaryocyte क्षमता (GEMM कोशिकाओं) में “सीएमपी”, सीएमपी-Flt3+ CD115lo और सीएमपी-Flt3– भिन्न1 ,7, लेकिन डीसी क्षमता के आकलन की अनुमति नहीं है । इसके विपरीत, कॉलोनी बनाने की परख oligopotent GMPs के अस्तित्व को प्रदर्शित किया (दोनों न्युट्रोफिल और monocyte क्षमता के साथ progenitors) “जीएमपी” अंश1,2में, और यह हाल ही में एकल सेल द्वारा समर्थित है transcriptomic विश्लेषण8. यह वर्तमान में ज्ञात नहीं है, तथापि, क्या इन oligopotent GMPs भी अंय granulocytes (इयोस्नोफिल्स, बेसोफिल, और मस्तूल कोशिकाओं) का उत्पादन ।
इन अध्ययनों के आधार पर, अब हम प्रदर्शन कैसे 7 सतह मार्करों (सी-किट, Sca-1, CD34, FcγR, Flt3, Ly6C और CD115) की पहचान और oligopotent और वंश की प्रतिबद्ध माइलॉयड progenitors के इन 6 सबसेट को अलग करने के लिए इस्तेमाल किया जा सकता है । यहां वर्णित प्रोटोकॉल में इन विट्रो संस्कृति परख (methylcellulose या तरल संस्कृतियों) के लिए लागू किया जा सकता है, में vivo अपनाने चूहों में स्थानांतरण प्रयोगों, और आणविक विश्लेषण (थोक और एकल सेल आरएनए अनुक्रमण, पश्चिमी सोख्ता, आदि) ।
प्रोटोकॉल 3 चरणों के होते हैं: 1) अस्थि मज्जा कोशिकाओं के एक एकल सेल निलंबन की तैयारी, 2) टेम progenitors के लिए संवर्धन (चुंबकीय-सक्रिय सेल छंटाई), और 3) पहचान, और अलगाव अगर वांछित, जनक के प्रवाह द्वारा सबसेट cytometry (एक विश्लेषक या एक सॉर्टर, के रूप में उपयुक्त का उपयोग करके) । पहला कदम femurs और euthanized चूहों के tibias से अस्थि मज्जा कोशिकाओं का अलगाव है और अन्य पहले वर्णित प्रोटोकॉल9के समान है. अगला, नमूना स्टेम और जनक कोशिकाओं एरिथ्रोसाइट्स, न्यूट्रोफिल, monocytes, लिम्फोसाइटों, आदि के सेल सतह मार्करों के खिलाफ एंटीबॉडी का एक कॉकटेल का उपयोग करने के लिए समृद्ध है , विभेदित कोशिकाओं को चूस । यह अनिवार्य नहीं है, लेकिन दृढ़ता से जनक सबसेट का पता लगाने का अनुकूलन की सिफारिश की है, और जनक पहचान और प्रवाह cytometry के लिए आवश्यक समय के लिए जरूरत एंटीबॉडी की मात्रा को कम करने के लिए. वंश घट प्रोटोकॉल नीचे का वर्णन चुंबकीय-सक्रिय कक्ष छँटाई (एमएसीएस) एक चूहे वंश सेल कमी किट का उपयोग (जो CD5 के खिलाफ biotinylated एंटीबॉडी शामिल हैं, CD45R (B220), CD11b, जीआर-1 (Ly6G/ग), 7-4, और तेर-११९, प्लस विरोधी बायोटिन microbeads) और एक स्वचालित चुंबकीय विभाजक । अंतिम चरण की पहचान है (और छंटाई, यदि वांछित) जनक उपसमुच्चय के प्रवाह cytometry द्वारा । एंटीबॉडी पैनल नीचे वर्णित (भी तालिका 1देखें) 4 पराबैंगनीकिरण (४०५ एनएम, ४८८ एनएम, ५६१ एनएम, ६४० एनएम) के साथ एक प्रवाह cytometer (विश्लेषक या सॉर्टर) में इस्तेमाल किया जा करने के लिए डिजाइन किया गया है ।
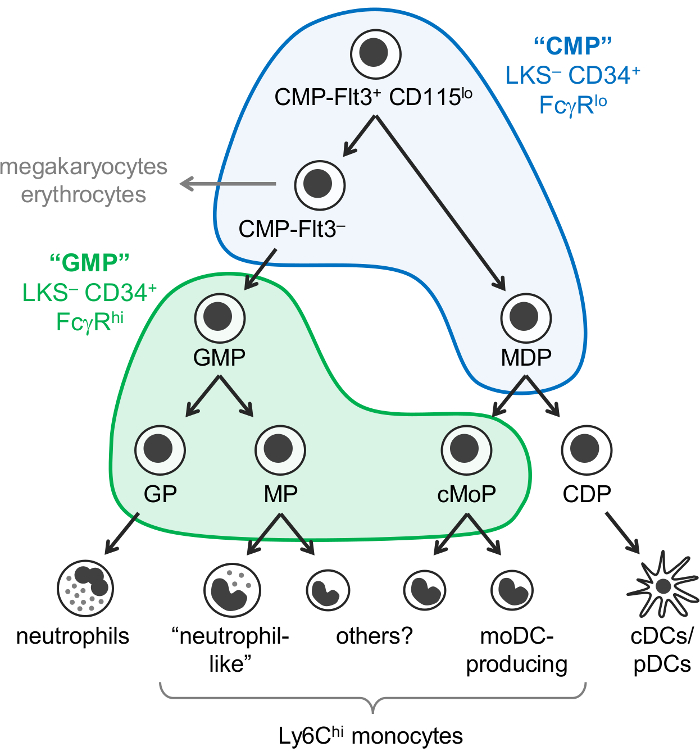
चित्रा 1: न्युट्रोफिल, monocyte और डीसी progenitors और भेदभाव रास्ते । myelopoiesis7 के हाल ही में संशोधित मॉडल “CMPs” (नीला) और “GMPs” (हरा)1 मढ़ा के लिए Weissman गेट्स के साथ, सचित्र है । यह आंकड़ा Yáñez एट अल. २०१७7से संशोधित किया गया है । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
Protocol
Representative Results
Discussion
माउस माइलॉयड जनक पहचान के लिए Weissman गेटिंग रणनीति1 लगभग 20 वर्षों के लिए immunologists और hematologists के लिए सोने के मानक किया गया है, लेकिन यह अब स्पष्ट है कि “सीएमपी” और “जीएमपी” गेट्स बहुत विषम और अधिक सटीक रहे है ग?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
इस प्रोटोकॉल को देवदारों-सिनाई मेडिकल सेंटर (HSG), अमेरिकन एसोसिएशन ऑफ Immunologists (प्र और HSG) से इम्यूनोलॉजी फैलोशिप में एक कॅरिअर, और एक विद्वान पुरस्कार से बोर्ड ऑफ गवर्नर्स का पुनर्उत्पादक चिकित्सा संस्थान से धन का उपयोग कर विकसित किया गया था अमेरिकन सोसायटी ऑफ रुधिर (प्र.). हम देवदारों पर प्रवाह Cytometry कोर धंयवाद-FACS छंटाई के साथ सहायता के लिए सिनाई चिकित्सा केंद्र ।
Materials
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
References
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).

