식별 및 Oligopotent 및 계보 커밋된 골수성 창시자 마우스 골 수에서 격리
Summary
식별 하 고 자석의 조합 및 형광 정렬 (맥 및 FACS)를 사용 하 여 murine 골에서 골수성 창시자의 6 하위 집합을 격리 하는 방법을 보여 줍니다. 이 프로토콜은 생체 외에서 문화 분석 (스 또는 액체 문화), 입양 전송 실험 vivo에서 및 RNA/단백질 분석에 대 한 사용할 수 있습니다.
Abstract
골수성 창시자 호 중구, monocytes 및 모 수석 세포 (DCs)에서 확인 하 고 혈액 및 면역 분석에 대 한 생쥐의 골 수에서 분리 수 있습니다. 예를 들어 골수성 조상 인구의 세포 및 분자 속성의 연구 leukemic 변환, 기본 메커니즘을 밝힐 수 또는 면역 시스템 병원 체 노출에 응답 하는 방법을 보여 줍니다. 이전 많은 분야에서 상당한 진보를 사용 하는 골수성 조상 식별에 대 한 설명된 흐름 cytometry 전략 하지만 그들을 식별 하는 분수는 아주 이질적인. 가장 일반적으로 사용 되는 제어 전략 정의 골 분수 원하는 인구에 대 한 풍성 하 게 하지만 또한 “오염” 창시자의 많은 수를 포함 합니다. 우리의 최근 학문이이 많이 해결 선물이 여기 프로토콜 oligopotent의 6 부분 모집단의 격리를 허용 하 고 혈통 커밋된 골수성 창시자 2에서 설명한 골 분수. 3 단계는 프로토콜에 설명 합니다: 1) 절연 골 수의 세포, 2) 농축 조 혈 창시자 자기 활성화 셀 정렬 (맥에 의해 혈통 소모), 및 3) 식별 골수성 조상 cytometry (를 포함 하 여 하위 집합에 대 한 형광 활성화 된 세포 분류, FACS, 원하는 경우). 이 이렇게 조상 정량화 및 생체 외에서 그리고 vivo에서 응용 프로그램의 다양 한 절연을 허용 하 고 경로 및 neutrophil, monocyte, 및 DC 차별화의 메커니즘에 새로운 통찰력을 나왔고 이미 있다.
Introduction
Monocytes, 호 중구, 및 모 수석 세포 (DCs)는 주로 골 수에서 조 혈 창시자에서 myelopoiesis 라는 프로세스에 의해 발생 하는 골수성 세포. 일반적인 골수성 창시자 (CMPs) 골수성 세포로 없으며, 적혈구, 하지만 하지 림프 세포 생산 가능성이 있다. CMPs에서 파생 됩니다, granulocyte monocyte 창시자 (GMPs) granulocytes 그리고 monocytes, 생산 하지만 잃은 megakaryocyte 잠재적인 적혈구. Monocytes 그리고 클래식 plasmacytoid Dc (cDCs/Pdc) monocyte DC 창시자 (MDPs), CMPs. 서서히 제한 혈통 잠재력의 궁극적으로 혈통 커밋된 결과 의해 생산으로 알려진 일반적인 창시자에서 발생을 또한 생각 됩니다 창시자: granulocyte 창시자, monocyte 창시자, 및 수지상 세포 창시자 (그림 1).
와 이즈 맨과 동료 보고 CMPs 린– c-키트+ Sca-1– CD34 (LKS–)에서 발견 되는+ FcγRlo 의 분수 마우스 골 수, GMPs LKS– CD34에 포함 하는 동안+ FcγR 안녕하세요 분수1. 그러나, 이러한 “CMP”와 “GMP” 분수는 매우 이질적인. 예를 들어, “GMP” 분수 또한 포함 되어 혈통 커밋된 granulocyte 창시자 monocyte 창시자1,2. MDPs 했다 별도로 보고 CX3CR1+ Flt3+ CD115+ CD34 및 FcγR3,4익스프레스 창시자. MDPs는 cDC/pDC 생산 일반적인 DC 창시자 (Cdp), c-Kit (CD117)의 저수준을 표현 하기 위해 보고 하 고 LKS– 분수5에 포함 되지 않습니다.
그것은 이전 monocytes (CMP-GMP-민주당-monocyte) 단일 경로 통해 발생 간주 되었다. 제작한 GMPs (monocyte 창시자, MPs 라는)이 모델, monocyte 커밋된 창시자와 일치2 및 MDPs (라는 일반적인 monocyte 창시자, cMoPs)6 공유 표면 마커 식에 근거 하 여 동일한 셀 표시 . 그러나, 우리가 최근에 monocytes는 생산 하지 독립적으로 GMPs와 MDPs, 시연 하 고 단일 셀 RNA 시퀀싱7MPs와 cMoPs 사이 구별을 수 있었다.
우리는 최근에 다른 oligopotent 및 골수성 조상 계보 커밋된 하위 집합을 포함 하는 C57BL/6J 마우스 골 수의 6 subfractions 식별 하는 이즈 맨 “CMP” 및 “GMP” 제어 전략 수정. 처음 보고는 oligopotent GMPs granulocyte 창시자 (GPs) 및 monocyte 창시자 (MPs 및 cMoPs, 우리는 현재 별도 수)의 절연을 허용 Ly6C 및 CD115에 대 한 얼룩 “GMP” 분수2 (LKS에서 – CD34+ FcγR안녕하세요 게이트; 그림 1)입니다. 우리는 그 후 MDPs는 주로 “CMP” 분수 있는 시연 (LKS– CD34+ FcγRlo 게이트), 또한 Flt3 포함+ CD115lo 와 Flt3– 하위 집합7 (그림 1 ). CMP Flt3+ CD115lo 분수 입양 전송 시 GMPs와 MDPs를 생성합니다. CMP-Flt3– 하위 집합 CMP Flt3+ CD115lo 셀 사이의 GMPs 중간체 처럼 창시자를 포함 합니다. MDPs, 달리 CMP Flt3+ CD115lo 와 CMP Flt3– 분수 또한가지고 megakaryocyte 및 잠재적인 적혈구.
단, 그 그것은 현재 불분명 여부 “CMP” 분수 정말 oligopotent (예: 개별 셀 CMP Flt3+ CD115lo 분수 내 neutrophil, 소유 하는 창시자를 포함 하는 것이 중요 하다 monocyte, DC, megakaryocyte, 및 잠재적인 적혈구), 또는 양자 택일로, 더 제한 된 혈통 잠재력 창시자의 혼합물을 구성. 분석 실험 (스 문화)를 형성 하는 식민지 공개 셀 granulocyte (호 중구), 적혈구, monocyte와 megakaryocyte 잠재적인 (GEMM 세포) “CMP”에서 CMP Flt3+ CD115lo 분수 CMP Flt3– 1 ,7, 하지만 DC 잠재력의 평가 허용 하지 않습니다. 대조적으로, 분석 실험을 형성 하는 식민지 “GMP” 분수1,2, oligopotent GMPs (neutrophil와 잠재적인 monocyte 창시자)의 존재를 증명 하 고이 최근 단일 셀에 의해 지원 됩니다. transcriptomic 분석8. 그러나 그것은 현재 알 수 없습니다,, 또한 다른 granulocytes (호 산 구는, basophils 그리고 돛대 세포)을 생산 하는이 oligopotent GMPs 여부.
우리 지금 보여주는 이러한 연구에 따라 어떻게 7 표면 마커 (c 키트, Sca-1, CD34, FcγR, Flt3, Ly6C 및 CD115) 사용할 수 있습니다 식별 하 고 이러한 6 하위 집합 oligopotent 및 계보 커밋된 골수성 창시자의 분리. 여기에 설명 된 프로토콜 생체 외에서 문화 분석 (스 또는 액체 문화)에 대 한 적용 될 수 있다 vivo에서 입양 전송 실험 쥐, 및 분자 분석 (대량 및 단일 셀 RNA 시퀀싱, 부 럽, 등).
프로토콜 구성 3 단계: 골의 단일 세포 현 탁 액의 준비 1) 세포, 조 혈 창시자 (자석 활성화 된 세포 분류), 및 3) 식별, 격리의 흐름에 의해 조상 하위 집합 원하는 경우 2) 농축 cytometry (또는 사용 하는 분석기는 다소 적절 한). 첫 번째 단계는 화관에서 골 수 세포의 분리 및 안락사 마우스의 tibias 이며 다른 앞에서 설명한 프로토콜9와 비슷합니다. 다음으로, 샘플 줄기와 조상 세포 적혈구, 호 중구, monocytes, lymphocytes, 등 의 세포 표면 표식에 대 한 항 체의 칵테일을 사용 하 여 차별화 된 세포를 고갈에 대 한 농축입니다. 이것은 필수, 하지만 조상 하위 집합의 검색을 최적화 하 고 cytometry에 필요한 시간과 조상 식별에 필요한 항 체의 양을 줄이기 위해 강력 하 게 권장 하지. Magnetic-Activated 셀 정렬 (맥) 마우스 계보 셀 고갈 키트를 사용 하 여 아래 계보 고갈 프로토콜에 설명 합니다 (CD5, CD45R에 대하여 biotinylated 항 체를 포함 된 (B220), CD11b, Gr-1 (Ly6G/C), 7-4, 그리고 Ter-119, 안티 비오 틴 플러스 microbeads)와 자동된 자석 분리기. 마지막 단계는 id (및 필요한 경우 정렬) cytometry에 의해 조상 하위 집합의. 항 체 패널 아래에 설명 된 4 레이저 분석기 (다소) 교류 cytometer에서 사용 하도록 설계 되었습니다 ( 표 1참조) (405 nm, 488 nm, 561 nm, 640 nm).
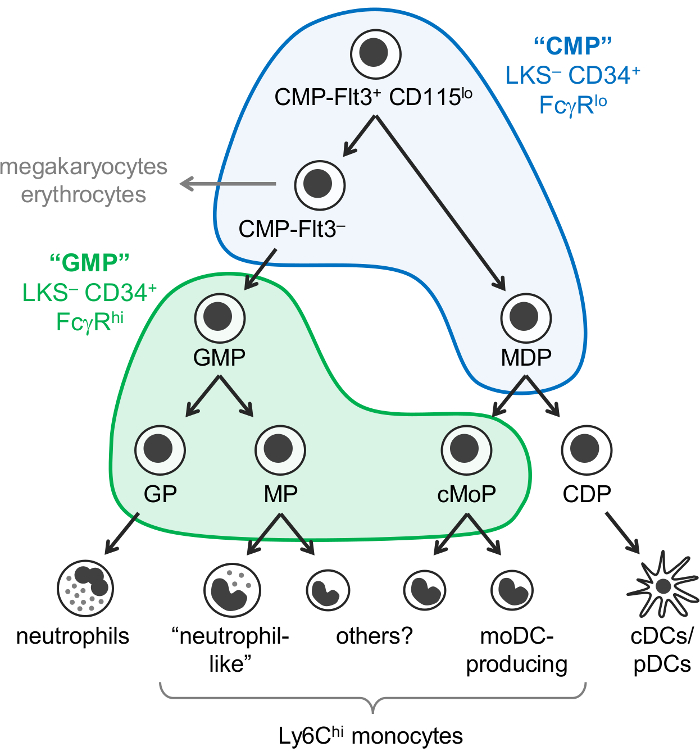
그림 1: Neutrophil, monocyte와 DC 창시자와 차별화 경로. 와 이즈 맨 게이츠 “CMPs” (파란색)와 “GMPs” (녹색)1 중첩에 대 한 myelopoiesis7 의 최근 수정된 모델은 나와 있습니다. 이 그림은 Yáñez 외. 20177에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Protocol
Representative Results
Discussion
와 이즈 맨 마우스 골수성 조상 식별1 전략 게이팅 immunologists에 대 한 황금 표준 hematologists 거의 20 년 동안 왔지만 그것은 명백한 “CMP”와 “GMP” 게이츠는 매우 이질적인 더 정확한 지금 제어 전략 필요 합니다. 우리는 여기에 설명 된 프로토콜 특정 골수성 창시자의 더 정확한 정량화 및 myelopoiesis 통로 조사에 대 한 C57BL/6J 쥐에 oligopotent 및 계보 커밋된 하위 집합의 식별을 허용 골수?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 프로토콜 (바깥 HSG)를, Immunologists의 미국 협회에서 면역학 화목에서 경력 및 학술 상 수상 (HSG)을 보드의 총재 재생 의학 연구소에서 삼목 시 나이 의료 센터에 자금을 사용 하 여 개발 되었다 (하의) 혈액학의 미국 사회. FACS 정렬 지원에 감사 삼목 시 나이 의료 센터에서 Flow Cytometry 코어 하 고.
Materials
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
References
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).

