Identificação e isolamento de oligopotentes e confirmada por linhagem mieloides progenitores da medula óssea de rato
Summary
Demonstramos como identificar e isolar 6 subconjuntos de progenitores mieloides de murino medula óssea usando uma combinação de magnética e fluorescência classificação (MACS e FACS). Este protocolo pode ser usado para ensaios em vitro cultura (culturas metilcelulose ou líquido), na vivo experiências de transferência adotiva e análises de RNA/proteína.
Abstract
Progenitores mieloides que rendem os neutrófilos, monócitos e células dendríticas (DCs) podem ser identificados em e isolados da medula óssea de ratos para análises hematológicas e imunológicas. Por exemplo, estudos das propriedades moleculares e celulares das populações do progenitor mieloide podem revelar os mecanismos subjacentes a transformação leucêmicas, ou demonstrar como o sistema imunológico responde à exposição do patógeno. Anteriormente, estratégias de citometria de fluxo descrito para identificação de progenitoras mieloides permitiram avanços significativos em muitos campos, mas as frações que eles identificam são muito heterogêneas. As estratégias associadas mais comumente usadas definem frações de medula óssea que são enriquecidas para as populações desejadas, mas também contêm um grande número de progenitores “contaminar”. Nossos estudos recentes resolveram grande parte desta heterogeneidade e apresentamos aqui o protocolo permite o isolamento de 6 subpopulações de oligopotentes e confirmada por linhagem mieloides progenitores de 2 descrito anteriormente fracções de medula óssea. O protocolo descreve 3 estágios: 1) isolamento da medula óssea de células, 2) enriquecimento de progenitores hematopoiéticos magnético-ativado da pilha classificando (depleção de linhagem por MACS), e 3) identificação dos subconjuntos de progenitoras mieloides por citometria de fluxo (incluindo fluorescência-ativado da pilha classificação, FACS, se desejado). Esta abordagem permite a quantificação do progenitor e isolamento para uma variedade de aplicações em vitro e em vivo e já rendeu o romance insight caminhos e mecanismos de diferenciação de DC, monócitos e neutrófilos.
Introduction
Monócitos, neutrófilos e células dendríticas (DCs) são células mieloides que surgem a partir de progenitores hematopoiéticos, principalmente na medula óssea, por um processo chamado myelopoiesis. Comuns progenitores mieloides (CMPs) têm potencial para produzir células mieloides, bem como megacariócitos e eritrócitos, mas células não linfoides. Progenitores de granulócitos-monócitos (GMPs), que são derivados da CMPs, produção de granulócitos e monócitos, mas perderam megacariócito e potencial de eritrócitos. Monócitos e clássica e plasmocitoide DCs (conjuntos/PDC) também são pensados para surgir a partir de progenitores comuns conhecidas como progenitores de monócitos-DC (MDPs), que são produzidas pelos CMPs. Gradual restrição do potencial de linhagem em última análise, resulta em linhagem confirmada progenitores: progenitores de granulócitos, progenitores de monócitos e progenitores de células dendríticas (Figura 1).
Weissman e colegas relataram que o CMPs são encontrados no Lin– c-Kit+ Sca-1– CD34 (LKS–)+ FcγREis fração da medula óssea de rato, enquanto GMPs constam o CD34 LKS– + FcγR Oi fração1. No entanto, estas frações “CMP” e “GMP” são muito heterogêneas. Por exemplo, a fração “GMP” também contém progenitores confirmada linhagem granulócitos e monócitos progenitores1,2. MDPs separadamente foram relatados para ser CX3CR1+ Flt3+ CD115+ progenitores que também expressam CD34 e FcγR3,4. MDPs dão origem a cDC/pDC-produzindo comum DC progenitores (CDPs), que têm sido relatados para expressar níveis mais baixos de c-Kit (CD117) e não estão incluídos na fração LKS– 5.
Supunha-se anteriormente que os monócitos surgirem através de um caminho único (CMP-GMP-MDP-monócitos). Consistente com este modelo, confirmada por monócitos progenitores produzido pela PGM (chamado progenitores de monócitos, MPs)2 e MDPs (chamadas comum progenitores de monócitos, cMoPs)6 parecem ser as mesmas células com base na expressão do marcador de superfície compartilhada . No entanto, recentemente demonstrou que os monócitos são produzidos de forma independente por GMPs e MDPs e foram capazes de distinguir entre MPs e cMoPs pela única célula de sequenciamento de RNA7.
Recentemente, nós modificamos o Weissman “CMP” e estratégia associada “GMP” para identificar 6 subfractions de C57BL/6J medula óssea de rato contendo diferentes oligopotentes e confirmada por linhagem mieloide progenitor subconjuntos. Primeiro, informou que a mancha para Ly6C e CD115 permite o isolamento de GMPs oligopotentes, bem como progenitores de colônias de granulócitos (GPs) e progenitores monócito (MPs e cMoPs, que não conseguimos separar) do “GMP” fração2 (LKS – CD34+ FcγROi portão; A Figura 1). Posteriormente demonstrámos que MDPs são encontrados predominantemente na fração “CMP” (CD34 LKS– + FcγRo portão), que também contém Flt3+ CD115lo e Flt3– subconjuntos7 (Figura 1 ). O CMP-Flt3+ Eis CD115 fração produz tanto GMPs e MDPs mediante transferência adotiva. O subconjunto de CMP-Flt3– contém progenitores que parecem ser os intermediários entreo CMP-Flt3+ CD115 células e PGM. Ao contrário de MDPs, tanto o CMP-Flt3+ CD115Eis e frações CMP-Flt3– também possuem megacariócito e eritrócitos potenciais.
É importante observar, no entanto, que é atualmente incerto se as frações “CMP” contêm progenitores que verdadeiramente são oligopotentes (por exemplo, células individuais dentro da CMP-Flt3+ Eis CD115 fração que possuem neutrófilos, monócitos, DC, megacariócito e potencial de eritrócitos), ou alternativamente, compreendem uma mistura de progenitores com potencial de linhagem mais restrita. Formadoras de ensaios (culturas de metilcelulose) revelaram células com (neutrófilos) granulócitos, eritrócitos, monócitos e megacariócito potencial (células GEMM) na “CMP”, CMP-Flt3+ CD115Eis e frações CMP-Flt3– 1 ,7, mas não permitem a avaliação do potencial de DC. Em contraste, formadoras de ensaios demonstraram a existência de oligopotentes GMPs (progenitores com neutrófilos e monócitos potencial) no “GMP” fração1,2, e isto é suportado pelo recente unicelulares análise de transcriptomic8. Não atualmente se sabe, no entanto, se essas GMPs oligopotentes também produzem outros granulócitos (eosinófilos, basófilos e mastócitos).
Baseado nestes estudos, agora demonstraremos como 7 superfície marcadores (c-Kit, Sca-1, CD34, FcγR, Flt3, Ly6C e CD115) pode ser usado para identificar e isolar estes 6 subconjuntos de oligopotentes e confirmada por linhagem mieloides progenitores. O protocolo descrito aqui pode ser aplicado para ensaios em vitro cultura (culturas metilcelulose ou líquido), na vivo transferência adotiva as experiências em ratos e análise molecular (sequenciamento de RNA em massa e de célula única, mancha ocidental, etc.).
O protocolo consiste em 3 fases: 1) preparação de uma suspensão de célula da medula óssea de células, 2) enriquecimento de progenitores hematopoiéticos (classificação magnética-ativado da pilha) e 3) a identificação e isolamento, se desejado, de subconjuntos de progenitor pelo fluxo cytometry (usando um analisador ou um classificador, conforme o caso). O primeiro passo é o isolamento de células de medula óssea de fêmures e tíbias de ratos sacrificados e é similar a outros protocolos descritos anteriormente,9. Em seguida, a amostra é enriquecida por células estaminais e progenitoras usando um coquetel de anticorpos contra marcadores de superfície celular de eritrócitos, neutrófilos, monócitos, linfócitos, etc., para esgotar as células diferenciadas. Isto não é obrigatório, mas fortemente recomendado para otimizar a deteção de subconjuntos do progenitor e reduzir a quantidade de anticorpos necessários para a identificação de progenitor e o tempo necessário para citometria de fluxo. O protocolo de esgotamento de linhagem abaixo descreve Magnetic-Activated célula classificação (MACS) usando um Mouse linhagem celular depleção Kit (que contém anticorpos biotinilado contra CD5, CD45R (B220), CD11b, Gr-1 (Ly6G/C), 7-4 e Ter-119, além de anti-biotina microbeads) e um separador magnético automatizado. A etapa final é a identificação (e classificação, se desejado) de subconjuntos do progenitor por citometria de fluxo. O painel de anticorpos descritos abaixo (Veja também a tabela 1) foi concebido para ser usado em um citômetro de fluxo (analisador ou classificador) com 4 lasers (405 nm, 488 nm, 561 nm, 640 nm).
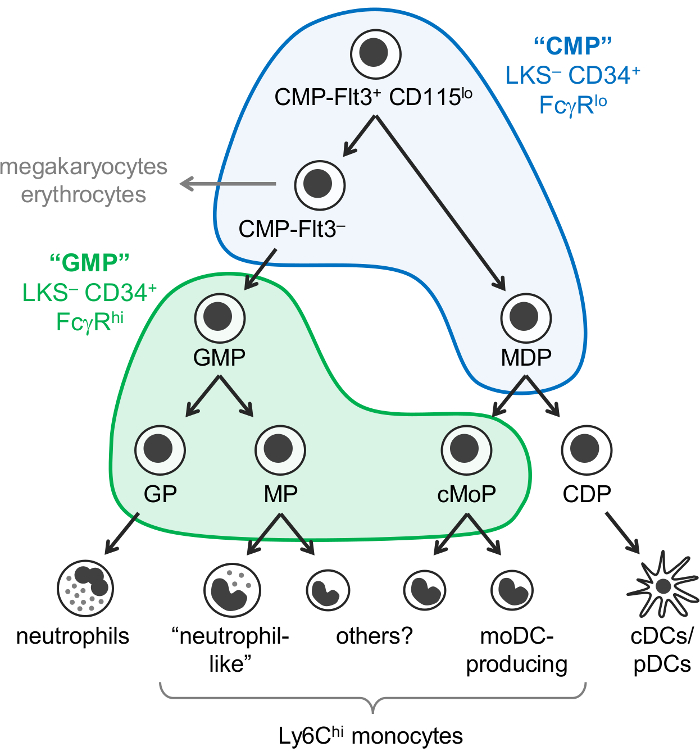
Figura 1: neutrófilos, monócitos e DC progenitores e vias de diferenciação. O modelo recentemente revisado de myelopoiesis7 é ilustrado, com os portões de Weissman para “CMPs” (azuis) e “PGM” (verde)1 sobrepostos. Esta figura foi modificada de Yáñez et al . 20177. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O Weissman gating estratégia para rato progenitoras mieloides identificação1 tem sido o padrão-ouro para imunologistas e hematologistas há quase 20 anos, mas agora é evidente que o gates “CMP” e “GMP” são muito heterogêneos e mais precisos são necessárias estratégias associadas. O protocolo que descrevemos aqui permite a identificação de oligopotentes e confirmada por linhagem subconjuntos em camundongos C57BL/6J para quantificação mais precisa dos progenitores mieloides específica…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este protocolo foi desenvolvido usando fundos do Conselho de Governadores regenerativa medicina Instituto no Cedars-Sinai Medical Center (HSG), um carreiras em comunhão de Imunologia da associação americana de imunologistas (para AY e HSG) e um prêmio de estudioso da a sociedade americana de Hematologia (para AY). Agradecemos o núcleo de citometria de fluxo no Cedars-Sinai Medical Center de assistência com a classificação de FACS.
Materials
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
References
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).

