Identifikation og isolering af Oligopotent og afstamning-begået myeloide ophav fra mus knoglemarv
Summary
Vi demonstrere, hvordan til at identificere og isolere 6 delmængder af myeloide stamceller fra murine knoglemarven ved hjælp af en kombination af magnetiske og fluorescens sortering (MACS og FACS). Denne protokol kan bruges til i vitro kultur assays (methylcellulose eller flydende kulturer), i vivo adoptiv overførsel eksperimenter og RNA/protein analyser.
Abstract
Myeloide stamceller, der giver neutrofiler, monocytter og dendritiske celler (DCs) kan identificeres i og isoleret fra knoglemarven af mus til hematological og immunologiske analyser. For eksempel, kan undersøgelser af de cellulære og molekylære egenskaber af myeloide stamceller befolkninger afsløre underliggende leukemic transformation mekanismer, eller demonstrere hvordan immunsystemet reagerer på patogen eksponering. Tidligere beskrevet flow flowcytometri strategier for myeloide stamceller identifikation har gjort betydelige fremskridt på mange områder, men fraktioner de identificere er meget heterogen. De mest almindeligt anvendte gating strategier definere knoglemarv fraktioner, der er beriget til de ønskede befolkninger, men også indeholder store mængder af “forurener” stamfaderen. Vores nylige undersøgelser har løst en stor del af denne forskelligartethed, og den protokol, vi præsenterer her tillader dyrkning af 6 delpopulationer af oligopotent og afstamning-begået myeloide stamceller fra 2 tidligere beskrevet knoglemarv fraktioner. Protokollen beskriver 3 stadier: 1) isolering af knoglemarv celler, 2) berigelse for hæmatopoietisk stamfaderen ved magnetisk aktiveret celle sortering (lineage udtynding af MLA), og 3) identifikation af myeloide stamceller delmængder af flowcytometri (herunder Fluorescens-aktiveret celle sortering, FACS, hvis det ønskes). Denne fremgangsmåde tillader stamfader kvantificering og isolation for en række in vitro og i vivo applikationer, og har allerede givet roman indsigt i veje og mekanismer af neutrofile, monocyt og DC differentiering.
Introduction
Neutrofile og monocytter og dendritiske celler (DCs) er myeloide celler, der opstår fra hæmatopoietisk progenitorceller, primært i knoglemarven, ved en proces kaldet myelopoiesis. Fælles myeloide stamceller (Kystforvaltningsplaner) har potentiale til at producere myeloide celler, samt megakaryocytes og erytrocytter, men ikke lymfoide celler. Granulocyt-monocyt stamfaderen (GMPs), som er afledt af Kystforvaltningsplaner, producere granulocytter og monocytter, men har mistet megakaryocyte og erytrocyt potentielle. Monocytter og klassisk og plasmacytoid DCs (cDCs/fremdaterede) menes også at opstå fra fælles ophav kendt som monocyt-DC stamfaderen (MDP’er), som er produceret af Kystforvaltningsplaner. gradvis begrænsning af lineage potentiale i sidste ende resulterer i slægt-begået ophav: granulocyt progenitorceller, monocyt ophav og dendritiske celle stamfaderen (figur 1).
Weissman og kolleger rapporteret at Kystforvaltningsplaner findes i Lin– c-Kit+ Sca-1– (LKS–) CD34+ FcγRlo brøkdel af musen knoglemarven, mens GMPs er indeholdt i LKS– CD34+ FcγR Hej fraktion1. Men disse “CMP” og “GMP” brøker er meget heterogen. For eksempel, indeholder “GMP” brøkdel også afstamning-begået granulocyt ophav og monocyt stamfaderen1,2. MDP’er separat blev rapporteret til at være CX3CR1+ Flt3+ CD115+ progenitorceller, som også udtrykker CD34 og FcγR3,4. MDP’er give anledning til cDC/pDC-producerende fælles DC stamfaderen (CDPs), som er blevet rapporteret at udtrykke lavere niveauer af c-Kit (CD117) og er ikke inkluderet i LKS– brøkdel5.
Tidligere var det antaget at monocytter opstår via en enkelt vej (CMP-GMP-MDP-monocyt). Overensstemmelse med denne model, monocyt-begået stamfaderen produceret af GMPs (opkaldt monocyt progenitorceller, MPs)2 og MDP’er (opkaldt fælles monocyt progenitorceller, cMoPs)6 synes at være de samme celler på grundlag af fælles overflade markør udtryk . Dog, vi for nylig demonstreret at monocytter produceres uafhængigt af GMPs og MDP’er, og var i stand til at skelne mellem parlamentsmedlemmer og cMoPs af encellede RNA sekventering7.
Vi har for nylig ændret Weissman “CMP” og “GMP” gating strategi for at identificere 6 subfractions af C57BL/6J mus knoglemarv indeholdende forskellige oligopotent og afstamning-begået myeloide stamceller undersæt. Vi første gang rapporteret, at farvning for Ly6C og CD115 tillader dyrkning af oligopotent GMPs, samt granulocyt stamfaderen (GPs) og monocyt stamfaderen (både MPs og cMoPs, som vi er i øjeblikket ude af stand til at adskille) fra “GMP” fraktion2 (LKS – CD34+ FcγRHej gate; Figur 1). Vi viste efterfølgende, at MDP’er findes overvejende i “CMP” fraktion (LKS– CD34+ FcγRlo gate), som også indeholder Flt3+ CD115lo og Flt3– delmængder7 (figur 1 ). CMP-Flt3+ CD115lo brøkdel udbytter både GMPs og MDP’er ved adoptiv overførsel. CMP-Flt3– delmængde indeholder stamfaderen, der synes at være mellemprodukter mellem CMP-Flt3+ CD115lo celler og GMPs. I modsætning til MDP’er besidder både den CMP-Flt3+ CD115lo og CMP-Flt3– fraktioner også megakaryocyte og erytrocyt potentielle.
Det er vigtigt at bemærke, at det er i øjeblikket uklart, om “CMP” fraktioner indeholder stamfaderen, der virkelig er oligopotent (f.eks. individuelle celler i CMP-Flt3+ CD115lo brøkdel der besidder neutrofile, monocyt, DC, megakaryocyte og erytrocyt potentielle), eller alternativt, omfatter en blanding af stamfaderen med mere begrænset lineage potentiale. Kolonidannende assays (methylcellulose kulturer) afslørede celler med granulocyt (neutrofile), erytrocyt, monocyt og megakaryocyte potentielle (CLAUSS celler) i “CMP”, CMP-Flt3+ CD115lo og CMP-Flt3– fraktioner1 ,7, men tillader ikke vurderingen af DC potentiale. Derimod kolonidannende assays påvist eksistensen af oligopotent GMPs (ophav med både neutrofile og monocyt potentielle) i “GMP” fraktion1,2, og dette er understøttet af de seneste single-celle transkriptom analyse8. Det vides i øjeblikket ikke, men om disse oligopotent GMPs også producere andre granulocytter (eosinofile, basofile og mastceller).
Baseret på disse undersøgelser, vi nu demonstrere kan hvordan 7 overflade markører (c-Kit, Sca-1, CD34, FcγR, Flt3, Ly6C og CD115) bruges til at identificere og isolere disse 6 delmængder af oligopotent og afstamning-begået myeloide stamceller. Protokollen beskrevet her kan anvendes til in vitro- kultur assays (methylcellulose eller flydende kulturer), i vivo adoptiv overførsel eksperimenter i mus og molekylær analyse (bulk og encellede RNA sekventering, Western blotting, etc.).
Protokollen består af 3 faser: 1) udarbejdelse af en enkelt cellesuspension af knoglemarv celler, 2) berigelse for hæmatopoietisk stamfaderen (magnetisk aktiveret celle sortering), og 3) identifikation og isolation, hvis det ønskes af stamfader delmængder af flow flowcytometri (ved hjælp af et analyseapparat eller et sorteringsanlæg, som passende). Det første skridt er isolering af knoglemarv celler fra lårben og skinneben af aflivede mus og svarer til andre tidligere beskrevet protokoller9. Næste, prøven er beriget til stilken og stamfader celler ved hjælp af en cocktail af antistoffer mod celle overflade markører af erytrocytter, neutrofiler, monocytter, lymfocytter, osv., nedbryder de differentierede celler. Dette er ikke obligatorisk, men anbefales kraftigt at optimere påvisning af stamfader delmængder og reducere mængden af antistoffer til stamfader identifikation og den nødvendige tid til flowcytometri. Lineage udtynding protokol nedenfor beskriver Magnetic-Activated celle sortering (MLA) ved hjælp af en mus afstamning celle nedbrydningen Kit (som indeholder biotinylated antistoffer mod CD5, CD45R (B220), CD11b, Gr-1 (Ly6G/C), 7-4, og Ter-119, plus anti-biotin microbeads) og en automatiseret magnetisk separator. Det sidste trin er at identificere (og sortering, hvis det ønskes) af stamfader delmængder ved flowcytometri. Panelet antistof beskrevet nedenfor (Se også tabel 1) er udviklet til at blive brugt i et flow forskellige (analyzer eller sorteringsanlæg) med 4 lasere (405 nm, 488 nm, 561 nm, 640 nm).
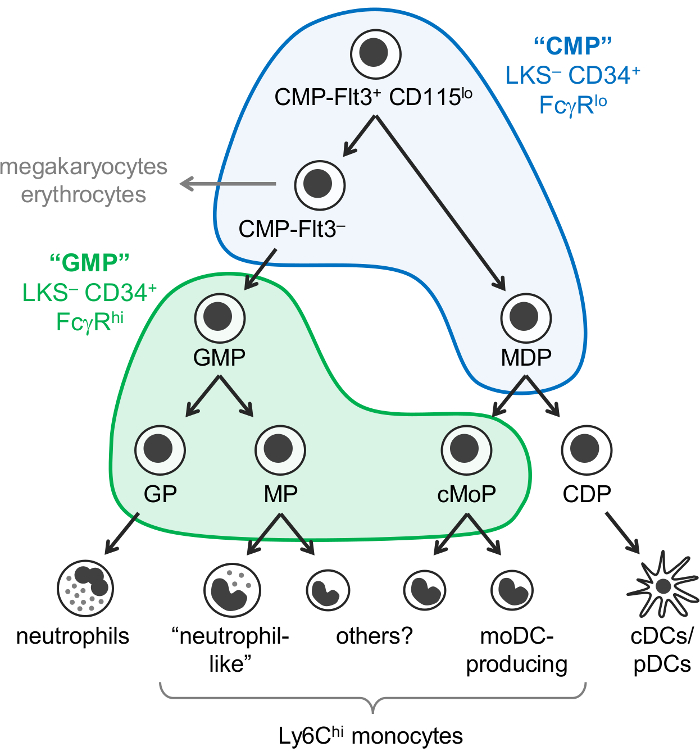
Figur 1: neutrofile, monocyt og DC ophav og differentiering veje. Den seneste reviderede model af myelopoiesis7 illustreres med Weissman gates for “Kystforvaltningsplaner” (blå) og “GMPs” (grøn)1 overlejret. Dette tal er blevet ændret fra Yáñez et al. 20177. Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Weissman gating strategi for musen myeloide stamceller identifikation1 har været guldstandarden for immunologists og Hematologer for næsten 20 år, men det er nu tydeligt, at “CMP” og “GMP” gates er meget heterogen og mere præcise gating strategier er nødvendige. Den protokol, som vi har beskrevet her tillader identifikation af oligopotent og afstamning-begået delmængder i C57BL/6J mus for mere præcis kvantificering af specifikke myeloide stamceller og kortlægning af myelopoiesis veje, sam…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne protokol blev udviklet ved hjælp af midler fra Board af guvernører regenerativ medicin Institut på Cedars-Sinai Medical Center (til HSG), en karriere i immunologi fellowship fra American Association for Immunologists (til AY og HSG) og en Scholar Award fra den American Society of Hematology (til AY). Vi takker Flow flowcytometri Core på Cedars-Sinai Medical Center for bistand med FACS sortering.
Materials
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
References
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).

