Identifiering och isolering av Oligopotent och härstamning-begått myeloida från mus benmärg
Summary
Vi visar hur att identifiera och isolera 6 delmängder av myeloida från murina benmärg med en kombination av magnetiska och fluorescens sortering (Mac och FACS). Detta protokoll kan användas för in vitro- kultur analyser (metylcellulosa eller vätska kulturer), in-vivo överföring experiment och RNA och protein analyser.
Abstract
Myeloida som ger neutrofiler, monocyter och dendritiska celler (DCs) kan identifieras i och isolerad från benmärgen hos möss för hematologiska och immunologiska analyser. Exempelvis kan studier av de cellulära och molekylära egenskaperna hos myeloida stamceller populationer avslöja mekanismerna bakom leukemiska transformation, eller demonstrera hur immunförsvaret reagerar på patogen exponering. Tidigare beskrivna flöde flödescytometri strategier för myeloida stamceller identifiering har aktiverat betydande framsteg på många områden, men de fraktioner som de identifierar är mycket heterogen. De vanligaste Usenets strategierna definiera benmärgen fraktioner som är berikad för önskad befolkningen, men också innehåller ett stort antal ”förorena” stamfäder. Vår nyligen genomförda studier har löst mycket av denna heterogenitet, och det protokoll som vi presenterar här tillåter isolering av 6 subpopulations av oligopotent och härstamning-begått myeloida från 2 tidigare beskrivits benmärgen fraktioner. Protokollet beskrivs 3 faser: 1) isolering av benmärg celler, 2) berikning för hematopoetiska progenitorceller genom magnetisk-aktiverad cell sortering (härstamning utarmning av Mac-datorer), och 3) identifiering av myeloida stamceller delmängder av flödescytometri (inklusive fluorescens-aktiverad cell sortering, FACS, om så önskas). Denna metod tillåter stamceller kvantifiering och isolering för en mängd olika in vitro – och in-vivo -program, och har redan gett roman insikt vägar och mekanismer av neutrofiler, monocyt och DC differentiering.
Introduction
Monocyter och neutrofiler dendritiska celler (DCs) är myeloida celler som uppstår från hematopoetiska progenitorceller, främst i benmärgen, genom en process som kallas myelopoiesis. Gemensamma myeloida (CMPs) har potential att producera myeloida celler, samt megakaryocyter och erytrocyter, men inte lymfoida celler. Granulocyt-monocyt stamfäder (god tillverkningssed), som härledas från CMPs, producera granulocyter och monocyter, men har förlorat megakaryocyt och erytrocyt potentiella. Monocyter och klassisk och dess DCs (cDCs/PDC) är också tänkt att uppstå från gemensamma stamfäder kallas monocyt-DC stamfäder (MDPs), som produceras av CMPs. successiv inskränkning av härstamning potential i slutändan resulterar i härstamning-begått föräldraparets: granulocyt stamfäder, monocyt stamfäder och dendritiska cellen stamfäder (figur 1).
Weissman och kollegor rapporterade att CMPs finns i Lin– c-Kit+ Sca-1– (LKS–) CD34+ FcγRlo bråkdel av mus benmärgen, medan god tillverkningssed ingår i den LKS– CD34+ FcγR Hej bråkdel1. Men är dessa ”CMP” och ”GMP” fraktioner mycket heterogen. Exempelvis innehåller ”GMP” fraktionen också härstamning-begått granulocyt stamfäder och monocyt föräldraparets1,2. MDPs rapporterades separat vara CX3CR1+ Flt3+ CD115+ stamfäder som också uttrycka CD34 och FcγR3,4. MDPs ge upphov till cDC/pDC-producerande gemensamma DC stamfäder (CDP), som har rapporterats att uttrycka lägre nivåer av c-Kit (CD117) och ingår inte i LKS– del5.
Tidigare antogs det att monocyter uppstå via en enda väg (CMP-GMP-MDP-monocyt). Konsekvent med denna modell, monocyt-begått stamfäder som produceras av god tillverkningssed (heter monocyt progenitorceller, MPs)2 och MDPs (heter gemensamma monocyt progenitorceller, cMoPs)6 verkar vara samma celler på grundval av delade ytan markör uttryck . Dock vi nyligen visat att monocyter produceras oberoende av god tillverkningssed och MDPs, och kunde urskilja mellan parlamentsledamöter och cMoPs av encelliga RNA-sekvensering7.
Vi ändrade nyligen den Weissman ”CMP” och ”GMP” Usenets strategi för att identifiera 6 och av C57BL/6J mus benmärgen som innehåller olika oligopotent och härstamning-begått myeloida stamceller deluppsättningar. Första rapporterade vi att färgning för Ly6C och CD115 tillåter isoleringen av oligopotent god tillverkningssed, och granulocyt stamfäder (GPs) samt monocyt stamfäder (MPs och cMoPs, som vi för närvarande inte att separera) från ”GMP” bråkdel2 (LKS – CD34+ FcγRHej gate; (Se figur 1). Vi visade senare att MDPs finns huvudsakligen i ”CMP” fraktionen (LKS– CD34+ FcγRlo gate), som också innehåller Flt3+ CD115lo och Flt3– delmängder7 (figur 1 ). Den CMP-Flt3+ CD115lo bråkdel ger både god tillverkningssed och MDPs vid överföring. Delmängden CMP-Flt3– innehåller stamfäder som verkar vara intermediärer mellan CMP-Flt3+ CD115lo celler och god tillverkningssed. Till skillnad från MDPs äger både CMP-Flt3+ CD115lo och CMP-Flt3– fraktioner också megakaryocyt och erytrocyt potentiella.
Det är viktigt att Observera dock att det är för närvarande oklart om ”CMP” fraktioner innehåller stamfäder som verkligen är oligopotent (t.ex. enskilda celler inom den CMP-Flt3+ CD115lo bråkdel som besitter neutrofiler, monocyt, DC, megakaryocyt och erytrocyt potentiella), eller alternativt kan bestå av en blandning av föräldraparets med mer begränsad härstamning potential. Kolonibildande analyser (metylcellulosa kulturer) avslöjade celler med granulocyt (neutrofila), erytrocyt, monocyt och megakaryocyt potentiella (GEMM celler) i ”CMP”, CMP-Flt3+ CD115lo och CMP-Flt3– fraktioner1 ,7, men tillåter inte bedömningen av DC potential. Däremot kolonibildande analyser visat förekomsten av oligopotent god tillverkningssed (föräldraparets med både neutrofila och monocyt potentiella) i ”GMP” bråkdel1,2, och detta stöds av senaste encelliga transcriptomic analys8. Det är för närvarande okänt, men huruvida dessa oligopotent genetiskt modifierade växter producerar även andra granulocyter (eosinofiler, basofiler och mastceller).
Baserat på dessa studier, visar vi nu kan hur 7 yta markörer (c-Kit, Sca-1, CD34, FcγR, Flt3, Ly6C och CD115) användas för att identifiera och isolera dessa 6 undergrupper av oligopotent och härstamning-begått myeloida. Protokollet beskrivs här kan användas för in vitro- kultur analyser (metylcellulosa eller vätska kulturer), in-vivo överföring experiment på möss, och molekylär analys (bulk och encelliga RNA-sekvensering, Western blotting, etc.).
Protokollet består av 3 steg: (1) förberedelse av en enda cellsuspension av benmärg celler, 2) berikning för hematopoetiska progenitorceller (magnetisk-aktiverad cell sortering), och 3) identifiering och isolering om så önskas, av stamceller delmängder av flöde flödescytometri (med en analysator eller en sorterare, i förekommande fall). Det första steget är isoleringen av benmärgsceller från lårbenet och skenbenet euthanized möss och liknande till andra tidigare beskrivna protokoll9. Nästa, provet är berikad för stamceller och stamceller celler med en cocktail av antikroppar mot cell yta markörer av neutrofiler, lymfocyter, monocyter, erytrocyter, etc., för att tömma de differentierade cellerna. Detta är inte obligatoriskt, men rekommenderas starkt att optimera upptäckten av stamceller delmängder, och att minska mängden av antikroppar som behövs för identifiering av stamceller och den tid som krävs för flödescytometri. Lineage utarmning protokollet nedan beskriver Magnetic-Activated Cell sortering (Mac) med hjälp av en mus härstamning Cell utarmning Kit (som innehåller biotinylerade antikroppar mot CD5, CD45R (B220), CD11b, Gr-1 (Ly6G/C), 7-4, och Ter-119, plus anti biotin Mikrokulor) och en automatiserad magnetiska avskiljare. Det sista steget är att identifiera (och sortering, om så önskas) av stamceller delmängder av flödescytometri. Panelen antikropp beskrivs nedan (se även tabell 1) har utformats för att användas i en flödescytometer (analyzer eller sorterare) med 4 lasrar (405 nm, 488 nm, 561 nm, 640 nm).
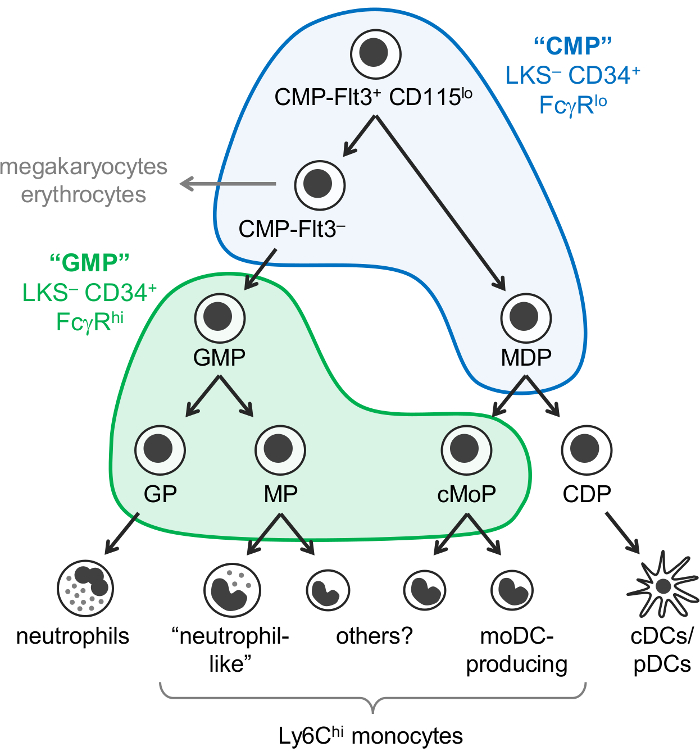
Figur 1: antal neutrofiler, monocyt och DC stamfäder och differentiering vägar. Den nyligen reviderade modellen av myelopoiesis7 illustreras, med Weissman grindarna för ”CMPs” (blå) och ”genetiskt modifierade växter” (grön)1 överlagras. Denna siffra har ändrats från Yáñez et al. 20177. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Den Weissman gating strategi för mus myeloida stamceller identifiering1 har varit guldmyntfoten för Immunologer och hematologer för nästan 20 år, men det framgår nu att ”CMP” och ”GMP” grindarna är mycket heterogen och mer exakt Usenets strategier behövs. Det protokoll som vi har beskrivit här tillåter identifiering av oligopotent och härstamning-begått delmängder i C57BL/6J möss för mer exakt kvantifiering av specifika myeloida och kartläggning av myelopoiesis vägar, liks…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta protokoll har utvecklats med medel från styrelsen av guvernörer regenerativ medicin institutet vid Cedars-Sinai Medical Center (HSG), en karriär inom immunologi fellowship från den amerikanska Association av Immunologer (till AY och HSG) och en Scholar Award från American Society hematologi (till AY). Vi tackar Flow flödescytometri kärnan på Cedars-Sinai Medical Center för hjälp med FACS sortering.
Materials
| Mouse: Wild-type C57BL/6J (CD45.2) | The Jackson Laboratories | Cat#JAX:000664 | |
| Lineage Cell Depletion Kit, mouse | Miltenyi Biotec | Cat#130-090-858 | |
| Rat anti-mouse CD34 (clone RAM34) FITC | BD Biosciences | Cat#553733 | |
| Rat anti-mouse CD16/CD32 (FcγR; clone 93) APC-Cy7 | BioLegend | Cat#101327 | |
| Rat anti-mouse Ly6A/E (Sca-1; clone 108113) PE-Cy7 | BioLegend | Cat#108114 | |
| Rat anti-mouse CD117 (c-Kit; clone 2B8) Pacific Blue | BioLegend | Cat#105820 | |
| Rat anti-mouse Ly6C (clone HK1.4) PerCP-Cy5.5 | BioLegend | Cat#128012 | |
| Rat anti-mouse CD115 (clone AFS98) PE | BioLegend | Cat#135506 | |
| Rat anti-mouse CD135 (Flt3; clone A2F10.1) APC | BD Biosciences | Cat#560718 | |
| CountBright Absolute Counting Beads | Thermo Fisher Scientific | Cat#C36950 | |
| AutoMACS Separator | Miltenyi Biotec | N/A | Use the "deplete" program |
| BD LSRFortessa | BD Biosciences | N/A | 5 lasers, 15 colors |
| BD FACS Aria III cell sorter | BD Biosciences | N/A | 5 lasers, 13 colors |
| FlowJo | FlowJo, LLC | https://www.flowjo.com | For further analysis of the .fcs files |
References
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Yáñez, A., Ng, M. Y., Hassanzadeh-Kiabi, N., Goodridge, H. S. IRF8 acts in lineage-committed rather than oligopotent progenitors to control neutrophil vs monocyte production. Blood. 125 (9), 1452-1459 (2015).
- Auffray, C., et al. CX3CR1+ CD115+ CD135+ common macrophage/DC precursors and the role of CX3CR1 in their response to inflammation. Journal of Experimental Medicine. 206 (3), 595-606 (2009).
- Fogg, D. K., et al. A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science. 311 (5757), 83-87 (2006).
- Onai, N., et al. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nature Immunology. 8 (11), 1207-1216 (2007).
- Hettinger, J., et al. Origin of monocytes and macrophages in a committed progenitor. Nature Immunology. 14 (8), 821-830 (2013).
- Yáñez, A., et al. Granulocyte-monocyte progenitors and monocyte-dendritic cell progenitors independently produce functionally distinct monocytes. Immunity. 47 (5), 890-902 (2017).
- Olsson, A., et al. Single-cell analysis of mixed-lineage states leading to a binary cell fate choice. Nature. 537 (7622), 698-702 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), (2016).
- Yáñez, A., Goodridge, H. S. Interferon regulatory factor 8 and the regulation of neutrophil, monocyte, and dendritic cell production. Current Opinion in Hematology. 23 (1), 11-17 (2016).
- Manz, M. G., Miyamoto, T., Akashi, K., Weissman, I. L. Prospective isolation of human clonogenic common myeloid progenitors. Proceedings of the National Academy of Sciences of the United States of America. 99 (18), 11872-11877 (2002).

