ثلاثة الإجراءات المختبرية لتقييم مختلف مظاهر الاندفاع في الفئران
Summary
نحن نقدم ثلاثة بروتوكولات تقييم أشكال مختلفة من الاندفاع في الفئران والثدييات الصغيرة الأخرى. تقييم إجراءات اختيار تزامنية الميل إلى خصم قيمة النتائج المتأخرة. التعزيز التفاضلي معدلات منخفضة والتمييز سالب ميزة تقييم القدرة على تثبيط الاستجابة مع أو بدون عقاب لاستجابات غير مناسبة، على التوالي.
Abstract
هذه المادة توفر دليلاً للتوصيل وتحليل البروتوكولات الثلاثة على أساس تكييف لتقييم الاندفاع في الفئران. الاندفاع مفهوم ذات مغزى لأنها مرتبطة بالأحوال النفسية في البشر ومع السلوك مهايئ في الحيوانات غير البشرية. ويعتقد أن الاندفاع يتكون من عوامل منفصلة. وهناك بروتوكولات مختبر الموضوعة لتقييم كل من هذه العوامل باستخدام المعدات الآلية الموحدة. خصم التأخير يرتبط بالعجز أن الدافع وراء تأخر النتائج. ويتم تقييم هذا العامل من خلال اختيار تزامنية البروتوكولات، التي تتألف من تقديم الفرد باختيار حالة تنطوي مكافأة فورية ومكافأة أكبر ولكن تأخر. العجز تثبيط استجابة يرتبط بالعجز حجب الردود متفوق. التعزيز التفاضلي معدلات منخفضة (DLR) وبروتوكولات التمييز سالب ميزة تقييم عامل العجز تثبيط استجابة للاندفاع. السابق يفرض شرطا لفرد بدوافع التي تنتظر معظم فترة الحد أدنى من الوقت لرد على مكافأة. هذه الأخيرة تقوم بتقييم قدرة الأفراد على الامتناع عن الغذاء التماس الردود عندما يقدم إشارة لعدم وجود الغذاء. والهدف من هذه البروتوكولات هو بناء تدبير كمي موضوعي من الاندفاع، الذي يعمل على إجراء مقارنات عبر الأنواع، مما يتيح إمكانية البحث متعدية الجنسيات. وتشمل مزايا هذه البروتوكولات الخاصة بهم سهلة الإعداد والتطبيق، والتي تنبع من كمية صغيرة نسبيا من المعدات اللازمة والطابع الآلي لهذه البروتوكولات.
Introduction
يمكن تصور الاندفاع كأحد أبعاد سلوكية المرتبطة بنتائج مهايئ1. وعلى الرغم من استخدام هذا المصطلح على نطاق واسع، هناك لا توافق عالمي في الآراء على تعريف دقيق لها. وفي الواقع، حددت العديد من المؤلفين الاندفاع بإعطاء أمثلة لسلوكيات متهورة أو عواقبها، بدلاً من تحديد الجوانب المميزة التي تحكم هذه الظاهرة. على سبيل المثال، الاندفاع يفترض أن تنطوي على عدم قدرة على الانتظار، وخطة، وتمنع السلوكيات متفوق، أو عدم الاكتراث بالنتائج تأخر2، واعتبر من مشكلة عدم حصانة أساسية لسلوك الإدمان3. باري وروبنز4 اتسمت الاندفاع كحدوث المشارك من الدوافع القوية، بمتغيرات ترتيبي والظرفية، واختلال العمليات المثبطة. تعريف مختلف قدم دالي وروبنز، الذي ذكر أن الاندفاع يمكن اعتباره نزعة إلى الإجراءات السريعة، وغالباً ما سابق لأوانه، دون تبصر المناسبة5. حتى الآن، تعريف آخر للاندفاع، اقترحها سوسا ودوس سانتوس6، هو اتجاه سلوك الذي ينحرف الكائن حي من تعظيم المكافآت المتاحة نظراً المكتسبة من نفوذ للكائن الاستجابة عن طريق المحفزات المناسبة وتتصل تلك المكافآت.
بسبب العمليات السلوكية المتصلة بالاندفاع، ينطوي على الركيزة العصبية هياكل مشتركة مع السلوك دوافع وصنع القرار وتحديد قيمة المكافأة. ويؤيد ذلك من الدراسات التي تبين أن الهياكل في مسار كورتيكو-سترياتال (مثلاً، نواة accumbens [بريدًا] وقشرة prefrontal [الثلاثين]، اللوزة، وكودات بوتامين [CPU])، فضلا عن النظام العصبي مونوامينيرجيك تصاعدي، المشاركة في التعبير عن السلوك المتهور7. ومع ذلك، الركيزة العصبية من الاندفاع أكثر تعقيداً من ذلك. على الرغم من أن تشارك بريدًا والهيدروكربون المشبع بالفلور في السلوك المتهور، هذه الهياكل هي جزء من نظام أكثر تعقيداً، وهي تتألف أيضا من هياكل فرعية التي لها وظائف مختلفة (للحصول على وثائق أكثر تفصيلاً، انظر دالي وروبنز5).
بغض النظر عن الخلافات حول طبيعته والركيزة البيولوجية، هذا البعد السلوكي ومن المعروف أن تختلف باختلاف الأفراد، وفي هذه الحالة يمكن أن يعتبر كسمة، وداخل الأفراد، وفي هذه الحالة فإنه يمكن اعتبار دولة8. وقد اعترف منذ وقت طويل الاندفاع كسمة من سمات بعض الأحوال النفسية، مثل اضطراب نقص الانتباه-العجز/فرط النشاط (ADHD)، وإساءة استعمال المواد المخدرة، والحلقات هوسي9. يبدو أن هناك توافقاً في آراء عالية أن الاندفاع وتتكون من عدة عوامل منفصلين، بما في ذلك عدم استعداد للانتظار (أي تأخير خصم)، العجز عن الامتناع عن ردود متفوق (أي، المثبطة العجز)، صعوبة التركيز على ذات الصلة المعلومات (أي عدم الاهتمام)، وتميل إلى الدخول في حالات محفوفة بالمخاطر (أي التماس الإحساس)5،،من1011. كل من هذه العوامل يمكن تقييمها من خلال المهام السلوكية الخاصة، التي يتم تعيينها عادة إلى فئتين عريضتين: تثبيط الاختيار واستجابة (قد يكون لهذه التسميات المختلفة بين كل التصنيفات صاحبي). بعض الميزات الهامة لهذه المهام السلوكية هي أنه يمكن تطبيقها عبر عدة أنواع من الحيوانات2 ، وأنها تسمح لدراسة الاندفاع في الظروف المختبرية التي تسيطر عليها.
النمذجة بعدا سلوكية مع الحيوانات غير البشرية مختبر يحتوي على عدد من المزايا بما في ذلك إمكانية قياس الاتجاهات السلوكية محددة وتطبيقية، السماح للباحثين إلى حد كبير الحد من المتغيرات المؤثرة الأخرى (على سبيل المثال، التلوث من أحداث الحياة الماضية4) وتنفيذ المعالجات التجريبية مثل الإدارة الدوائية المزمنة، أداء آفات عصبية، أو التلاعب الجيني. لدى معظم هذه البروتوكولات الإصدارات التماثلية للبشر، والتي تجعل من السهل مقارنة5. الأهم من ذلك، استخدام المماثلات هذه البروتوكولات المختبر في البشر فعالة للمساعدة في تشخيص الظروف النفسية، مثل إعاقة (لا سيما عندما يكون أكثر من بروتوكول التطبيقية12).
مثل أي قياس النفسية الأخرى، يجب أن بروتوكولات مختبر لتقييم الاندفاع الامتثال لمعايير معينة من أجل تحقيق الهدف المتمثل في توفير نظرة ثاقبة الظاهرة قيد الدراسة. تعتبر نموذجا مناسباً للسلوك المتهور مختبر البروتوكول ينبغي أن تكون موثوقة، وتمتلك (على الأقل في بعض درجة) الوجه وبناء، و/أو صحة التنبؤية13. موثوقية يمكن أن يعني أن تأثير على القياس أن النسخ المتماثل إذا كان يجري تلاعب مرتين أو أكثر، أو أن القياس يتسق مع مرور الزمن أو عبر مختلف الحالات14،15. الميزة السابقة ستكون مفيدة بشكل خاص للدراسات التجريبية، في حين أن هذا الأخير سيكون ذلك لدراسات علائقية14. صحة الوجه يشير إلى درجة فيها ما يقاس تشبه الظاهرة التي من المفترض أن تكون على غرار ما يجري، على سبيل المثال، تتأثر المتغيرات ذاتها. صحة التنبؤية يشير إلى قدرة مقياس للتنبؤ بالأداء المستقبلي في البروتوكولات، التي تهدف إلى قياس نفسه أو بنية ذات صلة. وأخيراً، صلاحية بناء يشير إلى ما إذا كان البروتوكول يستنسخ السلوك الذي نظرياً سليمة فيما يتعلق بالعملية أو العمليات التي يفترض أن تشارك في هذه الظاهرة قيد الدراسة. ومع ذلك، على الرغم من هذه الميزات مرغوب فيه للغاية، ينبغي توخي الحذر عند تفيد بأن بروتوكول غير صالح بحتة استناداً إلى هذه المعايير16.
وهناك عدة بروتوكولات لقياس الاندفاع في الظروف المختبرية. ومع ذلك، يعرض هذه المادة سوى ثلاث من هذه الأساليب: خيار تزامنية، التعزيز التفاضلي معدلات منخفضة، والتمييز سمة سلبية. إجراءات تزامنية تهدف إلى تقييم خصم تأخير (أي الصعوبة من تأخير النتائج التحكم في سلوك) المكون من الاندفاع. الأساس المنطقي لهذا البروتوكول هو مواجهة المواضيع مع اثنين من المكافآت التي تختلف في الحجم وتأخير17. بديل واحد يقدم مكافأة فورية صغير (يسمى عاجلاً أصغر، SS) والآخر يقدم مكافأة أكبر ولكن تأخر (يسمى أكبر في وقت لاحق، ليرة لبنانية). يمكن استخدام نسبة الردود إلى أن البديل SS كفهرس للاندفاع18. في التعزيز التفاضلي الإجراءات معدلات منخفضة، عامل الاندفاع إلى تقييم استجابة تثبيط (أي عدم القدرة على حجب الردود متفوق) عندما توجد عقوبة سالبة لطوارئ عند الاستجابة غير مناسبة. الأساس المنطقي لهذا البروتوكول هو إدخال المواضيع إلى وضع الذي السبيل الوحيد للحصول على مكافآت وقفه المجيبة على19. أخيرا، يقيم إجراءات التمييز سالب ميزة تثبيط استجابة عندما يكون هناك لا عقوبة صريحة على الاستجابة غير مناسبة. الأساس المنطقي لهذا البروتوكول (المعروف أيضا تكييف Pavlovian تثبيط أو A + AX-الداخلي) لتقييم المواضيع القدرة على حجب الردود لا لزوم لها20.
تبرز هذه الإجراءات في المقارنة للغير كوجود بعض ميزات مريحة. على سبيل المثال، الإجراءات المعروضة هنا مناسبة لتجري في الدوائر مكيف مجهز بالحد الأدنى (يعرف أيضا باسم ‘مربع سكينر’). ويبين الشكل 1 رسم تخطيطي لدائرة تكييف نموذجي. تكييف الدوائر أدوات مفيدة للبحث بسبب عدد من المزايا. وهي تسمح الآلي جمع كمية كبيرة نسبيا من البيانات، وتحقيق الحد الأقصى من عدد المواضيع المقررة للوحدة ل الزمان والمكان21. وعلاوة على ذلك، تتطلب الدراسات السلوكية التي أجريت في تكييف الدوائر تدخل الباحث الحد الأدنى، مما يقلل من الوقت والجهد استثمر موظفي المختبر، خلافا لسائر الأساليب المتاحة (مثلاً، غير الآلي تي-متاهات، تحول مجموعة مربعات) 21-التقليل إلى أدنى حد من التدخل الباحثين تساعد أيضا في تقليل التحيز الباحثين، وتقليل آثار منحنى التعلم، والباحثين، وتخفيض الناجمة عن التعامل مع التشديد على22. الدوائر تكييف نموذجية موحدة إلى حد ما ليتم استخدامها مع القوارض الحجم المتوسط، مثل الفئران (R. النرويجي)، لكن يمكن أن تستخدم لدراسة الأصناف الأخرى، مثل الجرابيات مماثلة الحجم (مثلاً، البيفينتريس دال، وكراسيكاوداتا ل. 23). هناك أيضا التجارية تكييف الدوائر تكييفها للاصغر حجماً (مثل الفئران [موسكولوس م.]) وأكبر (مثلاً، المقدمات غير البشرية) الأنواع. إعداد وتنفيذ البروتوكولات المقدمة في هذه المقالة تتطلب الحد الأدنى من مهارات البرمجة والطلب عدد منخفض جداً من مدخلات يمكن بلوغه وأجهزة الإخراج، خلافا لطرق بديلة أكثر تعقيداً (مثل، 5-اختيار وقت رد الفعل المسلسل المهمة [5- كسرت]24 وتتبع علامة25).
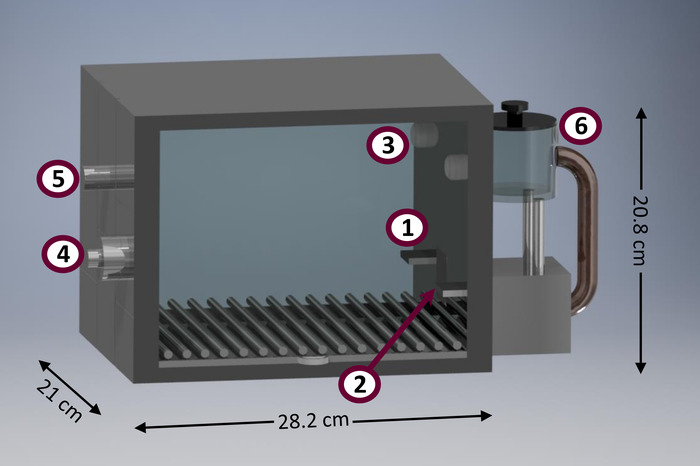
رقم 1: رسم تخطيطي تكييف نموذج الدائرة. وتشمل المكونات الرئيسية لدائرة تكييف: رافعة (1) الأيسر، وعاء (2) الأغذية (مجهزة الأفقي الثنائيات الأشعة تحت الحمراء للكشف عن إدخالات الرأس)، الضوء محللي (3)، (4) المتكلم للهجة الانبعاثات (الرؤية الخلفية)، (5) البيت الخفيفة (الرؤية الخلفية)، (6) الغذاء موزع. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
Representative Results
Discussion
هذه المادة تقدم وصفاً لمجموعة متنوعة من البروتوكولات لفحص الاندفاع في الفئران. وقيل أن هذه البروتوكولات خاصة هي المفضلة لسهولة البرمجة وتحليل البيانات، وتتطلب أجهزة التشغيل والحوافز أقل من البدائل الأخرى المتاحة. وهناك العديد من الخطوات الحاسمة للتنفيذ الفعال لهذه البروتوكولات، مثل (1) …
Disclosures
The authors have nothing to disclose.
Acknowledgements
نود أن نشكر ماتا فلورنسيا، ماريا إيلينا تشافيس، برغش ميغيل وتابيا وأليخاندرو لتوفير المساعدة التقنية. كما نود أن نشكر “فرانسيس غوردون سارة” لبلدها تعليقات مفيدة على مشروع سابقة من هذه المادة، وفلاديمير اوردونيا يرجى توفير البيانات الخام من ورقة منشورة. وبفضل نالين كلاوديو لإنشاء الرسم البياني في الشكل 1. نحن ممتنون للمديرية للبحوث في الجامعة الإيبيرية الأمريكية سيوداد دي مكسيكو للتمويل الفيديو المنتجة للنفقات وتصحيح التجارب المطبعية/تحرير الخدمات.
Materials
| 25 Pin Cables | Med Associates | SG-213F | Connect smart control cards to smart control panels |
| 40 Pin Ribbon Cable | Med Associates | DIG-700C | Connects the computer with the interface cabinet |
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| Conductor Cables | Med Associates | SG-210CP-8 | Provide power to the smart control panels via the rack mount power supply |
| Food dispenser with pedestal | Med Associates | ENV-203M-45 (12937) | Silently provides 45 mg food pellets |
| Head-Entry Detector | Med Associates | ENV-254-CB | Uses an infrared photo-beam to detect head entries into the food receptacle |
| House Light | Med Associates | ENV-215M | For providing diffuse illumination inside the chamber |
| Interface Cabinet | Med Associates | SG-6080D | Pod that can hold up to eight smart control cards |
| Med-PC IV Software | Med Associates | SOF-735 | Translate codes into commands for operating outputs and recording/storing input information |
| Multiple tone generator | Med Associates | ENV-223 (597) | For controlling the frequency of the tones |
| Panel fillers | Med Associates | ENV-007-FP | For filling modular walls when devices are not used |
| Pellet Receptacle | Med Associates | ENV-200R2M | Receives and holds food pellets delivered by the dispenser |
| Rack Mount Power Supply | Med Associates | DIG-700F | Provides power to the interface cabinet |
| Retractable Lever | Med Associates | ENV-112CM (10455) | Detects lever-pressing responses; projects into the chamber or retracts as needed |
| Smart Control Cards | Med Associates | DIG-716 | Controls up to eight inputs and four outputs of a conditioning chamber |
| Smart Control Panels | Med Associates | SG-716 (3341) | Connect smart cards to the devices within the conditioning chambers |
| Speaker | Med Associates | ENV-224AM | For providing tones inside the chamber |
| Standard Modular Chambers for Rat | Med Associates | ENV-008 | Made of aluminum channels designed to hold modular devices |
| Standard sound-, light-, and temperature isolating shells | Med Associates | ENV-022MD | Serve to harbor each conditioning chamber |
| Stimulus Light | Med Associates | ENV-221M | For providing a round focalized light stimulus |
| Three Pin Cables | Med Associates | SG-216A-2 | Connects smart control panel with each of the input and output devices in the conditioning chambers |
References
- Loxton, N. J. The role of reward sensitivity and impulsivity in overeating and food addiction. Current Addiction Reports. 5 (2), 212-222 (2018).
- Richards, J. B., Gancarz, A. M., Hawk, L. W., Bardo, M. T., Fishbein, D. H., Milich, R. . Inhibitory control and drug abuse prevention. , (2011).
- Gullo, M. J., Loxton, N. J., Dawe, S. Impulsivity: Four ways five fectors are not basic to addiction. Addictive Behaviors. 39 (11), 1547-1556 (2014).
- Bari, A., Robbins, T. W. Inhibition and impulsivity: Behavioral and neural basis of response control. Progress in Neurobiology. 108, 44-79 (2013).
- Dalley, J. W., Robbins, T. W. Fractionating impulsivity: neuropsychiatric implications. Nature Reviews Neuroscience. 18 (3), 158-171 (2017).
- Sosa, R., dos Santos, C. V. Toward a unifying account of impulsivity and the development of self-control. Perspectives in Behavior Science. , 1-32 (2018).
- King, J. A., Tenney, J., Rossi, V., Colamussi, L., Burdick, S. Neural substrates underlying impulsivity. Annals of the New York Academy of Sciences. 1008 (1), 160-169 (2003).
- Stayer, R., Ferring, D., Schmitt, M. J. States and traits in psychological assessment. European Journal of Psychological Assessment. 8 (2), 79-98 (1992).
- Moeller, F. G., Barratt, E. S., Dougherty, D. M., Schmitz, J. M., Swann, A. C. Psychiatric aspects of impulsivity. American Journal of Psychiatry. 158, 1783-1793 (2001).
- Evenden, J. L. Varieties of impulsivity. Psychopharmacology. 146 (4), 348-361 (1999).
- Winstanley, C. A. The utility of rat models of impulsivity in developing pharmacotherapies for impulse control disorders. British Journal of Pharmacology. 164 (4), 1301-1321 (2011).
- Solanto, M. V., et al. The ecological validity of delay aversion and response inhibition as measures of impulsivity in AD/HD: A supplement to the NIMH multimodal treatment study of AD/HD. Journal of Abnormal Child Psychology. 29 (3), 215-218 (2001).
- van der Staay, F. J. Animal models of behavioral dysfunctions: Basic concepts and classifications, and an evaluation strategy. Brain Research Reviews. 52, 131-159 (2006).
- Hedge, C., Powell, G., Summer, P. The reliability paradox: Why robust cognitive tasks do not produce reliable individual differences. Behavioral Research Methods. , 1-21 (2017).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85, 935-956 (2010).
- Sjoberg, E. Logical fallacies in animal model research. Behavior and Brain Functions. 13 (1), (2017).
- Rachlin, H. Self-control: Beyond commitment. Behavioral and Brain Sciences. 18 (01), 109 (1995).
- Logue, A. W. Research on self-control: An integrating framework. Behavioral and Brain Sciences. 11 (04), 665 (1988).
- Kramer, T. J., Rilling, M. Differential reinforcement of low rates: A selective critique. Psychological Bulletin. 74 (4), 225-254 (1970).
- Sosa, R., dos Santos, C. V. Conditioned inhibition and its relationship to impulsivity: Empirical and theoretical considerations. The Psychological Record. , (2018).
- Gallistel, C. R., Balci, F., Freestone, D., Kheifets, A., King, A. Automated, quantitative cognitive/behavioral screening of mice: For genetics, pharmacology, animal cognition and undergraduate instruction. Journal of Visualized Experiments. (84), (2014).
- Skinner, B. F. A case history in scientific method. American Psychologist. 11 (5), 221-233 (1956).
- Papini, M. R. Associative learning in the marsupials Didelphis albiventris and Lutreolina crassicaudata. Journal of Comparative Psychology. 102 (1), 21-27 (1988).
- Leonard, J. A. 5 choice serial reaction apparatus. Medical Research Council of Applied Psychology Research. , 326-359 (1959).
- Robinson, T. E., Flagel, S. B. Dissociating the Predictive and Incentive Motivational Properties of Reward-Related Cues Through the Study of Individual Differences. Biological Psychiatry. 65 (10), 869-873 (2009).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies?. Journal of Pharmacology and Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Toth, L. A., Gardiner, T. W. Food and water restriction protocols: Physiological and behavioral considerations. Journal of the American Association for Laboratory Animal Science. 39 (6), 9-17 (2000).
- Deluty, M. Z. Self-control and impulsiveness involving aversive events. Journal of Experimental Psychology: Animal Behavior Processes. 4, 250-266 (1978).
- Cabrera, F., Robayo-Castro, B., Covarrubias, P. The ‘huautli’ alternative: Amaranth as reinforcer in operant procedures. Revista Mexicana de Análisis de la Conducta. 36, 71-92 (2010).
- Ferster, C. B., Skinner, B. F. . Schedules of reinforcement. , (1957).
- Orduña, V., Valencia-Torres, L., Bouzas, A. DRL performance of spontaneously hypertensive rats: Dissociation of timing and inhibition of responses. Behavioural Brain Research. 201 (1), 158-165 (2009).
- Freestone, D. M., Balci, F., Simen, P., Church, R. Optimal response rates in humans and animals. Journal of Experimental Psychology: Animal Behavior and Cognition. 41 (1), 39-51 (2015).
- Sanabria, F., Killeen, P. R. Evidence for impulsivity in the Spontaneously Hypertensive Rat drawn from complementary response-withholding tasks. Behavioral and Brain Functions. 4 (1), 7 (2008).
- van den Bergh, F. S., et al. Spontaneously hypertensive rats do not predict symptoms of attention-deficit hyperactivity disorder. Pharmacology, Biochemistry, and Behavior. 83, 11 (2006).
- Topping, J. S., Pickering, J. W. Effects of punishing different bands of IRTs on DRL responding. Psychological Reports. 31 (19-22), (1972).
- Richards, J. B., Sabol, K. E., Seiden, L. S. DRL interresponse-time distributions: quantification by peak deviation analysis. Journal of the Experimental Analysis of Behavior. 60 (2), 361-385 (1993).
- Orduña, V. Impulsivity and sensitivity to amount and delay of reinforcement in an animal model of ADHD. Behavioural Brain Research. 294, 62-71 (2015).
- Harmer, C. J., Phillips, G. D. Enhanced conditioned inhibition following repeated pretreatment with d -amphetamine. Psychopharmacology. 142 (2), 120-131 (1999).
- Lister, S., Pearce, J. M., Butcher, S. P., Collard, K. J., Foster, G. Acquisition of conditioned inhibition in rats is impaired by ablation of serotoninergic pathways. European Journal of Neuroscience. 8, 415-423 (1996).
- Meyer, H. C., Bucci, D. J. The contribution of medial prefrontal cortical regions to conditioned inhibition. Behavioral Neuroscience. 128 (6), 644-653 (2014).
- McNicol, D. . A primer of signal detection theory. , (1972).
- Carnero, S., Morís, J., Acebes, F., Loy, I. Percepción de la contingencia en ratas: Modulación fechneriana y metodología de la detección de señales. Revista Electrónica de Metodología Aplicada. 14 (2), (2009).
- López, H. H., Ettenberg, A. Dopamine antagonism attenuates the unconditioned incentive value of estrus female cues. Pharmacology, Biochemistry, and Behavior. 68, 411-416 (2001).
- Schotte, A., Janssen, P. F. M., Megens, A. A. H. P., Leysen, J. E. Occupancy of central neurotransmitter receptors by risperidone, clozapine and haloperidol, measured ex vivo. Brain Research. 631 (2), 191-202 (1993).
- van Hest, A., van Haaren, F., van de Poll, N. Haloperidol, but not apomorphine, differentially affects low response rates of male and female wistar rats. Pharmacology, Biochemistry, and Behavior. 29, 529-532 (1988).
- Finnegan, K. T., Ricaurte, G., Seiden, L. S., Schuster, C. R. Altered sensitivity to d-methylamphetamine, apomorphine, and haloperidol in rhesus monkeys depleted of caudate dopamine by repeated administration of d-methylamphetamine. Psychopharmacology. 77, 43-52 (1982).
- Britton, K. T., Koob, G. F. Effects of corticotropin releasing factor, desipramine and haloperidol on a DRL schedule of reinforcement. Pharmacology, Biochemistry, and Behavior. 32, 967-970 (1989).
- Maricq, A. V., Church, R. The differential effects of haloperidol and metamphetamine on time estimation in the rat. Psychopharmacology. 79, 10-15 (1983).
- Dalley, J. W., et al. Nucleus accumbens D2/3 receptors predict trait impulsivity and cocaine reinforcement. Science. 315, 1267-1270 (2007).
- Cole, B. J., Robbins, T. W. Effects of 6-hydroxydopamine lesions of the nucleus accumbens septi on performance of a 5-choice serial reaction time task in rats: Implications for theories of selective attention and arousal. Behavior and Brain Research. 33, 165-179 (1989).
- Reynolds, B., de Wit, H., Richards, J. B. Delay of gratification and delay discounting in rats. Behavioural Processes. 59 (3), 157-168 (2002).
- Evenden, J. L., Ryan, C. N. The pharmacology of impulsive behavior in rats: The effects of drugs on response choice with varying delays of reinforcement. Psychopharmacology. 128, 161-170 (1996).
- Autor, S. M., Hendry, D. P. . Conditioned reinforcement. , (1969).
- van den Broek, M. D., Bradshaw, C. M., Szabadi, E. Behaviour of ‘impulsive’ and ‘non-impulsive’ humans in a temporal differentiation schedule of reinforcement. Personality and Individual Differences. 8 (2), 233-239 (1987).
- McGuire, P. S., Seiden, L. S. The effects of tricyclicantidepressants on performance under a differential-reinforcement-of-low-rates schedule in rats. Journal of Pharmacology and Experimental Therapeutics. 214 (3), 635-641 (1980).
- O’Donnell, J. M., Seiden, L. S. Differential-reinforcement-of-low-rates 72-second schedule: Selective effects of antidepressant drugs. Journal of Pharmacology and Experimental Therapeutics. 224 (1), 80-88 (1983).
- Seiden, L. S., Dahms, J. L., Shaughnessy, R. A. Behavioral screen for antidepressants: The effects of drugs and electroconvulsive shock on performance under a differential-reinforcement-of-low-rates schedule. Psychopharmacology. 86, 55-60 (1985).
- He, Z., Cassaday, H. J., Howard, R. C., Khalifa, N., Bonardi, C. Impaired Pavlovian conditioned inhibition in offenders with personality disorders. The Quarterly Journal of Experimental Psychology. 64 (12), 2334-2351 (2011).
- He, Z., Cassaday, H. J., Bonardi, C., Bibi, P. A. Do personality traits predict individual differences in excitatory and inhibitory learning?. Frontiers in Psychology. 4, 1-12 (2013).
- Bucci, D. J., Hopkins, M. E., Keene, C. S., Sharma, M., Orr, L. E. Sex differences in learning and inhibition in spontaneously hypertensive rats. Behavioural Brain Research. 187 (1), 27-32 (2008).
- Gershon, J. A meta-analytic review of gender differences in ADHD. Journal of Attention Disorders. 5, 143-154 (2012).
- Mobini, S., et al. Effects of lesions of the orbitofrontal cortex on sensitivity to delayed and probabilistic reinforcement. Psychopharmacology. 160 (3), 290-298 (2002).
- Bouton, M. E., Nelson, J. B. Context-specificity of target versus feature inhibition in a negative-feature discrimination. Journal of Experimental Psychology: Animal Behavior Processes. 20 (1), 51-65 (1994).
- Bouton, M. E., Nelson, J. B., Schmajuk, N., Holland, P. . Occasion setting: Associative learning and cognition in animals. , 69-112 (1998).
- Rescorla, R. A. Pavlovian conditioned inhibition. Psychological Bulletin. 72 (2), 77-94 (1969).
- Miller, R. R., Matzel, L. D., Bower, G. H. . The psychology of learning and motivation. , (1988).
- Williams, D. A., Overmier, J. B., Lolordo, V. M. A reevaluation of Rescorla’s early dictums about conditioned inhibition. Psychological Bulletin. 111 (2), 275-290 (1992).
- Papini, M. R., Bitterman, M. E. The two-test strategy in the study of inhibitory conditioning. Psychological Review. 97 (3), 396-403 (1993).
- Sosa, R., Ramírez, M. N. Conditioned inhibition: Critiques and controversies in the light of recent advances. Journal of Experimental Psychology: Animal Behavior and Cognition. , (2018).
- Fox, A. T., Hand, D. J., Reilly, M. P. Impulsive choice in a rodent model of attention-deficit/hyperactivity disorder. Behavioural Brain Research. 187, 146-152 (2008).
- Foscue, E. P., Wood, K. N., Schramm-Sapyta, N. L. Characterization of a semi-rapid method for assessing delay discounting in rodents. Pharmacology, Biochemistry, and Behavior. 101, 187-192 (2012).
- Brucks, D., Marshall-Pescini, S., Wallis, L. J., Huber, L., Range, F. Measures of Dogs’ Inhibitory Control Abilities Do Not Correlate across Tasks. Frontiers in Psychology. 8, (2017).
- McDonald, J., Schleifer, L., Richards, J. B., de Wit, H. Effects of THC on Behavioral Measures of Impulsivity in Humans. Neuropsychopharmacology. 28 (7), 1356-1365 (2003).
- Reynolds, B., Ortengren, A., Richards, J. B., de Wit, H. Dimensions of impulsive behavior: Personality and behavioral measures. Personality and Individual Differences. 40 (2), 305-315 (2006).
- Dellu-Hagedorn, F. Relationship between impulsivity, hyperactivity and working memory: a differential analysis in the rat. Behavioral and Brain Functions. 2 (10), 18 (2006).
- López, P., Alba, R., Orduña, V. Individual differences in incentive salience attribution are not related to suboptimal choice in rats. Behavior and Brain Research. 341 (2), 71-78 (2017).
- Ho, M. Y., Al-Zahrani, S. S. A., Al-Ruwaitea, A. S. A., Bradshaw, C. M., Szabadi, E. 5-Hydroxytryptamine and impulse control: prospects for a behavioural analysis. Journal of Psychopharmacology. 12 (1), 68-78 (1998).
- Sagvolden, T., Russell, V. A., Aase, H., Johansen, E. B., Farshbaf, M. Rodent models of attention-deficit/hyperactivity disorder. Biological Psychiatry. 57, 9 (2005).
- Tomie, A., Aguado, A. S., Pohorecky, L. A., Benjamin, D. Ethanol induces impulsive-like responding in a delay-of-reward operant choice procedure: impulsivity predicts autoshaping. Psychopharmacology. 139 (4), 376-382 (1998).
- Monterosso, J., Ainslie, G. Beyond discounting: possible experimental models of impulse control. Psychopharmacology. 146 (4), 339-347 (1999).
- Burguess, M. A., Rabbit, P. . Methodology of frontal and executive function. , 81-116 (1997).
- Watterson, E., Mazur, G. J., Sanabria, F. Validation of a method to assess ADHD-related impulsivity in animal models. Journal of Neuroscience Methods. 252, 36-47 (2015).
- Hackenberg, T. D. Of pigeons and people: some observations on species differences in choice and self-control. Brazilian Journal of Behavior Analysis. 1 (2), 135-147 (2005).
- Asinof, S., Paine, T. A. The 5-choice serial reaction time task: A task of attention and impulse control for rodents. Journal of Visualized Experiments. (90), e51574 (2014).
- Masaki, D., et al. Relationship between limbic and cortical 5-HT neurotransmission and acquisition and reversal learning in a go/no-go task in rats. Psychopharmacology. 189, 249-258 (2006).
- Bari, A., et al. Prefrontal and monoaminergic contributions to stop-signal task performance in rats. The Journal of Neuroscience. 31, 9254-9263 (2011).
- Flagel, S. B., Watson, S. J., Robinson, T. E., Akil, H. Individual differences in the propensity to approach signals vs goals promote different adaptations in the dopamine system of rats. Psychopharmacology. 191, 599-607 (2007).
- Swann, A. C., Lijffijt, M., Lane, S. D., Steinberg, J. L., Moeller, F. G. Trait impulsivity and response inhibition in antisocial personality disorder. Journal of Psychiatric Research. 43 (12), 1057-1063 (2009).
- Lawrence, A. J., Luty, J., Bogdan, N. A., Sahakian, B. J., Clark, L. Impulsivity and response inhibition in alcohol dependence and problem gambling. Psychopharmacology. 207 (1), 163-172 (2009).
- Dougherty, D. M., et al. Behavioral impulsivity paradigms: a comparison in hospitalized adolescents with disruptive behavior disorders. Journal of Child Psychology and Psychiatry. 44 (8), 1145-1157 (2003).
- Rosval, L., et al. Impulsivity in women with eating disorders: Problem of response inhibition, planning, or attention. International Journal of Eating Disorders. 39 (7), 590-593 (2006).
- Huddy, V. C., et al. Reflection impulsivity and response inhibition in first-episode psychosis: relationship to cannabis use. Psychological Medicine. 43 (10), 2097-2107 (2013).

