Tre laboratorieprocedurer for vurdering af forskellige manifestationer af impulsivitet i rotter
Summary
Vi præsenterer tre protokoller, der vurderer forskellige former for impulsivitet i rotter og andre små pattedyr. Intertemporale valg procedurer evaluere tendens til at diskontere værdien af forsinket resultater. Differential forstærkning af lave priser og funktion-negativ forskelsbehandling evaluere svar hæmning kapacitet med og uden straf for upassende reaktioner, henholdsvis.
Abstract
Denne artikel indeholder en vejledning til overledning og analyse af tre conditioning-baserede protokoller til at evaluere impulsivitet i rotter. Impulsivitet er en meningsfuld begreb, fordi det er forbundet med psykiatriske lidelser hos mennesker og med problemadfærd hos ikke-menneskelige dyr. Det menes, at impulsivitet er sammensat af forskellige faktorer. Der er laboratorium protokoller udtænkt for at vurdere hver af disse faktorer ved hjælp af standardiserede automatiseret udstyr. Forsinkelse diskontering er forbundet med den manglende evne til at være motiveret af forsinket resultater. Denne faktor er evalueret gennem intertemporale valg protokoller, der består af præsentere enkelt med en valg situation, der involverer en umiddelbar belønning og en større men forsinket belønning. Svar hæmning underskud er forbundet med den manglende evne til at tilbageholde prepotent svar. Differential forstærkning af lave priser (DLR) og funktion-negativ forskelsbehandling protokoller vurdere responsfaktoren hæmning underskud af impulsivitet. Den tidligere pålægger en betingelse til en motiveret person, hvor de fleste vente en minimumsperiode for en reaktion at blive belønnet. Sidstnævnte evaluerer enkeltpersoner kapacitet til at afholde sig fra mad søger svar, når et signal manglen på fødevarer præsenteres. Formålet med disse protokoller er at konstruere et objektivt kvantitative mål for impulsivitet, som tjener til at gøre cross-arter sammenligninger, giver mulighed for Translationel forskning. Fordele ved disse særlige protokoller omfatter deres nem opsætning og anvendelse, hvilket skyldes de relativt små beløb af nødvendige udstyr og den automatiske karakter af disse protokoller.
Introduction
Impulsivitet kan være udtænkt som en adfærdsmæssige dimension tilknyttet utilpasset resultater1. Trods den udbredte brug af dette begreb er der ingen universel enighed på sin præcise definition. Faktisk har flere forfattere defineret impulsivitet ved at give eksempler på impulsiv adfærd eller deres konsekvenser i stedet for at afgrænse, hvilke særlige aspekter styre fænomenet. For eksempel, impulsivitet antages for at indebære manglende evne til at vente, planlægge, hæmme prepotent adfærd, eller en ufølsomhed til forsinket resultater2, og det har været betragtet som en kerne sårbarhed til vanedannende opførsel3. Bari og Robbins4 har karakteriseret impulsivitet som samtidig forekomsten af stærke impulser, bliver udløst af variablerne dispositional og situationsfornemmelse, og dysfunktionel hæmmende processer. En anden definition blev leveret af Dalley og Robbins, der erklærede, at impulsivitet kan betragtes som en disposition til hurtig, ofte forhastet, handlinger uden passende indsigt5. Endnu, en anden definition af impulsivitet, foreslået af Sosa og dos Santos6, en opførsel tendens, der afviger en organisme fra maksimering tilgængelige belønninger på grund af den erhvervede kontrol udøves over organismen reagerer ved stimuli i øvrigt relateret til disse belønninger.
På grund af de adfærdsmæssige processer relateret til impulsivitet, indebærer substratet neurofysiologiske strukturer til fælles med de motiverede adfærd, beslutningstagning og belønning værdiansættelse. Dette understøttes af undersøgelser, der viser, at strukturerne i cortico-striatal vej (f.eks., nucleus accumbens [NAc], præfrontal cortex [PFC], amygdala og spiegelske putamen [CPU]), samt den opstigende monoaminergic neurotransmitter system, deltage i udtryk for impulsiv adfærd7. Den neurale substrat af impulsivitet er imidlertid mere kompleks end. Selvom NAc og PFC er involveret i impulsiv adfærd, disse strukturer er en del af et mere komplekst system, og også er sammensat af ofringer, som har forskellige funktioner (for mere detaljerede dokumentation, se Dalley og Robbins5).
Uanset kontroverser om dens natur og biologisk bæremateriale, denne adfærdsmæssige dimension er kendt for at variere på tværs af individer, i hvilket tilfælde det kan betragtes som en landsforræder, og inden for enkeltpersoner, i hvilket tilfælde det kan betragtes som en stat8. Impulsivitet har længe været anerkendt som en funktion af nogle psykiatriske lidelser som attention-deficit/hyperactivity disorder (ADHD), stofmisbrug og maniske episoder9. Der synes at være stor enighed om, at impulsivitet er sammensat af flere dissocierbart faktorer, herunder uvilje mod at vente (dvs. forsinkelse diskontering), manglende evne til at afstå prepotent svar (dvs. hæmmende underskud), svært ved at fokusere på relevante oplysninger (dvs., uopmærksomhed), og en tendens til at engagere sig i risikable situationer (dvs., sensation søger)5,10,11. Hver af disse faktorer kan vurderes gennem adfærdsmæssige specialopgaver, som tildeles normalt to brede kategorier: valg og svar hæmning (disse kan have forskellige etiketter mellem hver forfatternes taksonomier). Nogle vigtige funktioner i sådanne adfærdsmæssige opgaver er at de kunne anvendes på tværs af flere dyrearter2 og at de giver mulighed for at studere impulsivitet i kontrolleret laboratorieforhold.
Modellering en adfærdsmæssige dimension med laboratoriet ikke-menneskelige dyr har en række fordele, herunder muligheden for måling specifikke, værk adfærdsmæssige tendenser, giver forskerne i høj grad reducere konfunderende variabler (f.eks. forurening af tidligere liv begivenheder4) og gennemføre eksperimentelle manipulationer såsom kronisk farmakologiske administration, udfører neurotoksiske læsioner eller genetiske manipulationer. De fleste af disse protokoller har analoge versioner til mennesker, som laver sammenligninger let5. Vigtigere, er ved hjælp af analoger af disse protokoller, laboratorium i mennesker effektiv til at støtte diagnosen af psykiatriske sygdomme som ADHD (især når mere end én protokol er anvendt12).
Ligesom alle andre psykologiske måling, skal laboratorium protokoller for vurdering af impulsivitet overholde bestemte kriterier med henblik på at nå målet om at give indsigt i fænomenet under undersøgelsen. Betragtes som en passende model af impulsiv adfærd et laboratorium protokol skal være pålidelige, og besidder (i det mindste i en vis grad) ansigt, konstruktion, og/eller forudsigende gyldighed13. Pålidelighed kunne antyde at indvirkning på målingen vil replikere hvis en manipulation er gennemført to eller flere gange, eller at målingen er konsekvent over tid eller på tværs af forskellige situationer14,15. Den tidligere funktion ville være særligt nyttigt for eksperimentelle undersøgelser, mens sidstnævnte ville være så for correlational undersøgelser14. Ansigt validitet refererer til den grad hvor hvad måles ligner det fænomen, som formodes at være modelleret, om at være eksempelvis påvirket af de samme variabler. Forudsigende gyldighed refererer til en foranstaltning evne til at forudsige fremtidige præstationer i protokoller, som sigter mod at måle den samme eller en relateret konstruktion. Endelig refererer konstruere validitet til om protokollen gengiver adfærd, der er teoretisk lyd om processen eller processerne, der antages for at være involveret i fænomenet under undersøgelsen. Men selv om disse meget attråværdig egenskaber, bør man være forsigtig når om, at en protokol er gyldig udelukkende baseret på disse kriterier16.
Der er flere protokoller til at måle impulsivitet i laboratoriet indstillinger. Men, denne artikel præsenterer kun tre sådanne metoder: intertemporale valg, differential forstærkning af lave priser, og funktion-negativ forskelsbehandling. Intertemporale procedurer har til formål at vurdere forsinkelse diskontering (dvs. er vanskeligheden at forsinket resultater til at styre funktionsmåden) komponent af impulsivitet. Den grundlæggende tankegang i denne protokol er konfrontere emner med to belønninger, der varierer i både omfang og forsinkelse17. En alternativ giver et lille øjeblikkelig belønning (benævnte mindre hurtigere, SS) og den anden giver en større men forsinket belønning (betegnes større senere, LL). Andelen af svar til SS alternativ kan bruges som et indeks af impulsivitet18. Differential styrkelse af lave priser procedurer, impulsivitet vurderes faktor er svar hæmning (dvs. manglende evne til at tilbageholde prepotent svar) når der er en negativ straf beredskabsplaner på upassende reaktion. Begrundelsen for denne protokol indfører emner til en situation, hvor den eneste måde at opnå belønninger er at afbryde deres besvarende19. Endelig, feature-negativ forskelsbehandling procedure evaluerer svar hæmning når der ikke er nogen eksplicit straf på upassende reaktion. Begrundelsen for denne protokol (også kendt som pavlovsk aircondition hæmning eller A +/ AX-procedure) er at evaluere emner evne til at tilbageholde unødvendige svar20.
Disse procedurer skiller sig ud i sammenligning til andre som har nogle praktiske funktioner. For eksempel, er de procedurer, der præsenteres her egnet til føres i minimalt udstyret condition kamre (også kendt som ‘ den Skinner box”). Figur 1 viser et diagram over et typisk conditioning kammer. Conditioning kamre er nyttig forskningsinstrumenter på grund af en række fordele. De tillader automatiseret indsamling af en relativt stor mængde data, maksimere antallet af fag vurderet til enhed af tid og rum21. Derudover adfærdsmæssige undersøgelser i conditioning kamre kræver minimal forsker intervention, hvilket reducerer tid og kræfter investeret af Bioanalytikere, i modsætning til andre tilgængelige metoder (f.eks. ikke-automatisk T-labyrinter, sæt-shifting kasser) 21. minimere forskernes intervention også medvirke til at reducere forskernes bias, faldende effekter af forskernes indlæringskurve, og en reduktion af håndtering-induceret stress22. Typiske conditioning kamre er forholdsvis standardiseret til at blive brugt med mellemlang mellemstore gnavere, som rotter (R. norvegicus), men kan anvendes til at studere andre taxa, ligesom tilsvarende størrelse pungdyr (f.eks. D. albiventris, og L. crassicaudata 23). der er også kommercielle conditioning kamre tilpasset mindre (fx mus [M. musculus]) og større (f.eks., ikke-menneskelige primater) arter. At etablere og gennemføre de protokoller, der er præsenteret i denne artikel kræver minimal programmering færdigheder og kræver et meget lavt antal af opnåelige input og output-enheder, i modsætning til mere avancerede alternative metoder (fx 5-valg seriel reaktionstid opgave [5- CSRTT]24 og tegn-tracking25).
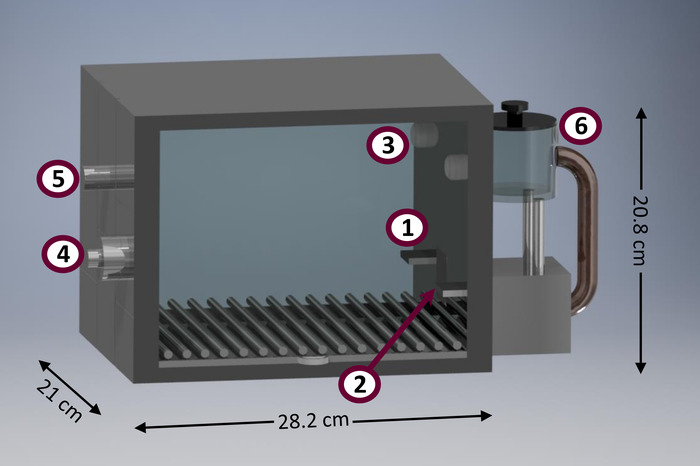
Figur 1: Diagram af en conditioning kammer prototype. Hovedbestanddelene af conditioning afdeling omfatter: (1) venstre løftestang, (2) fødevarer beholder (udstyret med lateral infrarød dioder til at registrere poster i hovedet), (3) focalized lys, (4) taler for tone emission (bagfra), (5) hus lys (bagfra), (6) fødevarer dispenser. Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Denne artikel givet en beskrivelse af diverse forskellige protokoller for screening impulsivitet i rotter. Det hævdes, at disse særlige protokoller er foretrukket for deres lethed i programmering og data analyse og kræver færre drifts- og stimulus enheder end andre alternativer. Der er flere afgørende skridt til en effektiv gennemførelse af disse protokoller, såsom (1) giver en problemformulering, (2) at vælge en passende undersøgelse design, (3) programmering den valgte protokol, (4) gennemfører undersøgelsen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi vil gerne takke Florencia Mata, María Elena Chávez, Miguel Burgos og Alejandro Tapia teknisk bistand. Vi vil også gerne takke Sarah Gordon Frances for hendes nyttige kommentarer på et tidligere udkast af denne artikel og Vladimir Orduña for venligt leverer rå data fra en offentliggjort papir. Tak til Claudio Nallen til at oprette diagrammet i figur 1. Vi er taknemmelige for Dirección de Investigación af Universidad Iberoamericana Ciudad de México finansiering korrekturlæsning/redigering tjenester og video produktion udgifter.
Materials
| 25 Pin Cables | Med Associates | SG-213F | Connect smart control cards to smart control panels |
| 40 Pin Ribbon Cable | Med Associates | DIG-700C | Connects the computer with the interface cabinet |
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| Conductor Cables | Med Associates | SG-210CP-8 | Provide power to the smart control panels via the rack mount power supply |
| Food dispenser with pedestal | Med Associates | ENV-203M-45 (12937) | Silently provides 45 mg food pellets |
| Head-Entry Detector | Med Associates | ENV-254-CB | Uses an infrared photo-beam to detect head entries into the food receptacle |
| House Light | Med Associates | ENV-215M | For providing diffuse illumination inside the chamber |
| Interface Cabinet | Med Associates | SG-6080D | Pod that can hold up to eight smart control cards |
| Med-PC IV Software | Med Associates | SOF-735 | Translate codes into commands for operating outputs and recording/storing input information |
| Multiple tone generator | Med Associates | ENV-223 (597) | For controlling the frequency of the tones |
| Panel fillers | Med Associates | ENV-007-FP | For filling modular walls when devices are not used |
| Pellet Receptacle | Med Associates | ENV-200R2M | Receives and holds food pellets delivered by the dispenser |
| Rack Mount Power Supply | Med Associates | DIG-700F | Provides power to the interface cabinet |
| Retractable Lever | Med Associates | ENV-112CM (10455) | Detects lever-pressing responses; projects into the chamber or retracts as needed |
| Smart Control Cards | Med Associates | DIG-716 | Controls up to eight inputs and four outputs of a conditioning chamber |
| Smart Control Panels | Med Associates | SG-716 (3341) | Connect smart cards to the devices within the conditioning chambers |
| Speaker | Med Associates | ENV-224AM | For providing tones inside the chamber |
| Standard Modular Chambers for Rat | Med Associates | ENV-008 | Made of aluminum channels designed to hold modular devices |
| Standard sound-, light-, and temperature isolating shells | Med Associates | ENV-022MD | Serve to harbor each conditioning chamber |
| Stimulus Light | Med Associates | ENV-221M | For providing a round focalized light stimulus |
| Three Pin Cables | Med Associates | SG-216A-2 | Connects smart control panel with each of the input and output devices in the conditioning chambers |
References
- Loxton, N. J. The role of reward sensitivity and impulsivity in overeating and food addiction. Current Addiction Reports. 5 (2), 212-222 (2018).
- Richards, J. B., Gancarz, A. M., Hawk, L. W., Bardo, M. T., Fishbein, D. H., Milich, R. . Inhibitory control and drug abuse prevention. , (2011).
- Gullo, M. J., Loxton, N. J., Dawe, S. Impulsivity: Four ways five fectors are not basic to addiction. Addictive Behaviors. 39 (11), 1547-1556 (2014).
- Bari, A., Robbins, T. W. Inhibition and impulsivity: Behavioral and neural basis of response control. Progress in Neurobiology. 108, 44-79 (2013).
- Dalley, J. W., Robbins, T. W. Fractionating impulsivity: neuropsychiatric implications. Nature Reviews Neuroscience. 18 (3), 158-171 (2017).
- Sosa, R., dos Santos, C. V. Toward a unifying account of impulsivity and the development of self-control. Perspectives in Behavior Science. , 1-32 (2018).
- King, J. A., Tenney, J., Rossi, V., Colamussi, L., Burdick, S. Neural substrates underlying impulsivity. Annals of the New York Academy of Sciences. 1008 (1), 160-169 (2003).
- Stayer, R., Ferring, D., Schmitt, M. J. States and traits in psychological assessment. European Journal of Psychological Assessment. 8 (2), 79-98 (1992).
- Moeller, F. G., Barratt, E. S., Dougherty, D. M., Schmitz, J. M., Swann, A. C. Psychiatric aspects of impulsivity. American Journal of Psychiatry. 158, 1783-1793 (2001).
- Evenden, J. L. Varieties of impulsivity. Psychopharmacology. 146 (4), 348-361 (1999).
- Winstanley, C. A. The utility of rat models of impulsivity in developing pharmacotherapies for impulse control disorders. British Journal of Pharmacology. 164 (4), 1301-1321 (2011).
- Solanto, M. V., et al. The ecological validity of delay aversion and response inhibition as measures of impulsivity in AD/HD: A supplement to the NIMH multimodal treatment study of AD/HD. Journal of Abnormal Child Psychology. 29 (3), 215-218 (2001).
- van der Staay, F. J. Animal models of behavioral dysfunctions: Basic concepts and classifications, and an evaluation strategy. Brain Research Reviews. 52, 131-159 (2006).
- Hedge, C., Powell, G., Summer, P. The reliability paradox: Why robust cognitive tasks do not produce reliable individual differences. Behavioral Research Methods. , 1-21 (2017).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85, 935-956 (2010).
- Sjoberg, E. Logical fallacies in animal model research. Behavior and Brain Functions. 13 (1), (2017).
- Rachlin, H. Self-control: Beyond commitment. Behavioral and Brain Sciences. 18 (01), 109 (1995).
- Logue, A. W. Research on self-control: An integrating framework. Behavioral and Brain Sciences. 11 (04), 665 (1988).
- Kramer, T. J., Rilling, M. Differential reinforcement of low rates: A selective critique. Psychological Bulletin. 74 (4), 225-254 (1970).
- Sosa, R., dos Santos, C. V. Conditioned inhibition and its relationship to impulsivity: Empirical and theoretical considerations. The Psychological Record. , (2018).
- Gallistel, C. R., Balci, F., Freestone, D., Kheifets, A., King, A. Automated, quantitative cognitive/behavioral screening of mice: For genetics, pharmacology, animal cognition and undergraduate instruction. Journal of Visualized Experiments. (84), (2014).
- Skinner, B. F. A case history in scientific method. American Psychologist. 11 (5), 221-233 (1956).
- Papini, M. R. Associative learning in the marsupials Didelphis albiventris and Lutreolina crassicaudata. Journal of Comparative Psychology. 102 (1), 21-27 (1988).
- Leonard, J. A. 5 choice serial reaction apparatus. Medical Research Council of Applied Psychology Research. , 326-359 (1959).
- Robinson, T. E., Flagel, S. B. Dissociating the Predictive and Incentive Motivational Properties of Reward-Related Cues Through the Study of Individual Differences. Biological Psychiatry. 65 (10), 869-873 (2009).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies?. Journal of Pharmacology and Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Toth, L. A., Gardiner, T. W. Food and water restriction protocols: Physiological and behavioral considerations. Journal of the American Association for Laboratory Animal Science. 39 (6), 9-17 (2000).
- Deluty, M. Z. Self-control and impulsiveness involving aversive events. Journal of Experimental Psychology: Animal Behavior Processes. 4, 250-266 (1978).
- Cabrera, F., Robayo-Castro, B., Covarrubias, P. The ‘huautli’ alternative: Amaranth as reinforcer in operant procedures. Revista Mexicana de Análisis de la Conducta. 36, 71-92 (2010).
- Ferster, C. B., Skinner, B. F. . Schedules of reinforcement. , (1957).
- Orduña, V., Valencia-Torres, L., Bouzas, A. DRL performance of spontaneously hypertensive rats: Dissociation of timing and inhibition of responses. Behavioural Brain Research. 201 (1), 158-165 (2009).
- Freestone, D. M., Balci, F., Simen, P., Church, R. Optimal response rates in humans and animals. Journal of Experimental Psychology: Animal Behavior and Cognition. 41 (1), 39-51 (2015).
- Sanabria, F., Killeen, P. R. Evidence for impulsivity in the Spontaneously Hypertensive Rat drawn from complementary response-withholding tasks. Behavioral and Brain Functions. 4 (1), 7 (2008).
- van den Bergh, F. S., et al. Spontaneously hypertensive rats do not predict symptoms of attention-deficit hyperactivity disorder. Pharmacology, Biochemistry, and Behavior. 83, 11 (2006).
- Topping, J. S., Pickering, J. W. Effects of punishing different bands of IRTs on DRL responding. Psychological Reports. 31 (19-22), (1972).
- Richards, J. B., Sabol, K. E., Seiden, L. S. DRL interresponse-time distributions: quantification by peak deviation analysis. Journal of the Experimental Analysis of Behavior. 60 (2), 361-385 (1993).
- Orduña, V. Impulsivity and sensitivity to amount and delay of reinforcement in an animal model of ADHD. Behavioural Brain Research. 294, 62-71 (2015).
- Harmer, C. J., Phillips, G. D. Enhanced conditioned inhibition following repeated pretreatment with d -amphetamine. Psychopharmacology. 142 (2), 120-131 (1999).
- Lister, S., Pearce, J. M., Butcher, S. P., Collard, K. J., Foster, G. Acquisition of conditioned inhibition in rats is impaired by ablation of serotoninergic pathways. European Journal of Neuroscience. 8, 415-423 (1996).
- Meyer, H. C., Bucci, D. J. The contribution of medial prefrontal cortical regions to conditioned inhibition. Behavioral Neuroscience. 128 (6), 644-653 (2014).
- McNicol, D. . A primer of signal detection theory. , (1972).
- Carnero, S., Morís, J., Acebes, F., Loy, I. Percepción de la contingencia en ratas: Modulación fechneriana y metodología de la detección de señales. Revista Electrónica de Metodología Aplicada. 14 (2), (2009).
- López, H. H., Ettenberg, A. Dopamine antagonism attenuates the unconditioned incentive value of estrus female cues. Pharmacology, Biochemistry, and Behavior. 68, 411-416 (2001).
- Schotte, A., Janssen, P. F. M., Megens, A. A. H. P., Leysen, J. E. Occupancy of central neurotransmitter receptors by risperidone, clozapine and haloperidol, measured ex vivo. Brain Research. 631 (2), 191-202 (1993).
- van Hest, A., van Haaren, F., van de Poll, N. Haloperidol, but not apomorphine, differentially affects low response rates of male and female wistar rats. Pharmacology, Biochemistry, and Behavior. 29, 529-532 (1988).
- Finnegan, K. T., Ricaurte, G., Seiden, L. S., Schuster, C. R. Altered sensitivity to d-methylamphetamine, apomorphine, and haloperidol in rhesus monkeys depleted of caudate dopamine by repeated administration of d-methylamphetamine. Psychopharmacology. 77, 43-52 (1982).
- Britton, K. T., Koob, G. F. Effects of corticotropin releasing factor, desipramine and haloperidol on a DRL schedule of reinforcement. Pharmacology, Biochemistry, and Behavior. 32, 967-970 (1989).
- Maricq, A. V., Church, R. The differential effects of haloperidol and metamphetamine on time estimation in the rat. Psychopharmacology. 79, 10-15 (1983).
- Dalley, J. W., et al. Nucleus accumbens D2/3 receptors predict trait impulsivity and cocaine reinforcement. Science. 315, 1267-1270 (2007).
- Cole, B. J., Robbins, T. W. Effects of 6-hydroxydopamine lesions of the nucleus accumbens septi on performance of a 5-choice serial reaction time task in rats: Implications for theories of selective attention and arousal. Behavior and Brain Research. 33, 165-179 (1989).
- Reynolds, B., de Wit, H., Richards, J. B. Delay of gratification and delay discounting in rats. Behavioural Processes. 59 (3), 157-168 (2002).
- Evenden, J. L., Ryan, C. N. The pharmacology of impulsive behavior in rats: The effects of drugs on response choice with varying delays of reinforcement. Psychopharmacology. 128, 161-170 (1996).
- Autor, S. M., Hendry, D. P. . Conditioned reinforcement. , (1969).
- van den Broek, M. D., Bradshaw, C. M., Szabadi, E. Behaviour of ‘impulsive’ and ‘non-impulsive’ humans in a temporal differentiation schedule of reinforcement. Personality and Individual Differences. 8 (2), 233-239 (1987).
- McGuire, P. S., Seiden, L. S. The effects of tricyclicantidepressants on performance under a differential-reinforcement-of-low-rates schedule in rats. Journal of Pharmacology and Experimental Therapeutics. 214 (3), 635-641 (1980).
- O’Donnell, J. M., Seiden, L. S. Differential-reinforcement-of-low-rates 72-second schedule: Selective effects of antidepressant drugs. Journal of Pharmacology and Experimental Therapeutics. 224 (1), 80-88 (1983).
- Seiden, L. S., Dahms, J. L., Shaughnessy, R. A. Behavioral screen for antidepressants: The effects of drugs and electroconvulsive shock on performance under a differential-reinforcement-of-low-rates schedule. Psychopharmacology. 86, 55-60 (1985).
- He, Z., Cassaday, H. J., Howard, R. C., Khalifa, N., Bonardi, C. Impaired Pavlovian conditioned inhibition in offenders with personality disorders. The Quarterly Journal of Experimental Psychology. 64 (12), 2334-2351 (2011).
- He, Z., Cassaday, H. J., Bonardi, C., Bibi, P. A. Do personality traits predict individual differences in excitatory and inhibitory learning?. Frontiers in Psychology. 4, 1-12 (2013).
- Bucci, D. J., Hopkins, M. E., Keene, C. S., Sharma, M., Orr, L. E. Sex differences in learning and inhibition in spontaneously hypertensive rats. Behavioural Brain Research. 187 (1), 27-32 (2008).
- Gershon, J. A meta-analytic review of gender differences in ADHD. Journal of Attention Disorders. 5, 143-154 (2012).
- Mobini, S., et al. Effects of lesions of the orbitofrontal cortex on sensitivity to delayed and probabilistic reinforcement. Psychopharmacology. 160 (3), 290-298 (2002).
- Bouton, M. E., Nelson, J. B. Context-specificity of target versus feature inhibition in a negative-feature discrimination. Journal of Experimental Psychology: Animal Behavior Processes. 20 (1), 51-65 (1994).
- Bouton, M. E., Nelson, J. B., Schmajuk, N., Holland, P. . Occasion setting: Associative learning and cognition in animals. , 69-112 (1998).
- Rescorla, R. A. Pavlovian conditioned inhibition. Psychological Bulletin. 72 (2), 77-94 (1969).
- Miller, R. R., Matzel, L. D., Bower, G. H. . The psychology of learning and motivation. , (1988).
- Williams, D. A., Overmier, J. B., Lolordo, V. M. A reevaluation of Rescorla’s early dictums about conditioned inhibition. Psychological Bulletin. 111 (2), 275-290 (1992).
- Papini, M. R., Bitterman, M. E. The two-test strategy in the study of inhibitory conditioning. Psychological Review. 97 (3), 396-403 (1993).
- Sosa, R., Ramírez, M. N. Conditioned inhibition: Critiques and controversies in the light of recent advances. Journal of Experimental Psychology: Animal Behavior and Cognition. , (2018).
- Fox, A. T., Hand, D. J., Reilly, M. P. Impulsive choice in a rodent model of attention-deficit/hyperactivity disorder. Behavioural Brain Research. 187, 146-152 (2008).
- Foscue, E. P., Wood, K. N., Schramm-Sapyta, N. L. Characterization of a semi-rapid method for assessing delay discounting in rodents. Pharmacology, Biochemistry, and Behavior. 101, 187-192 (2012).
- Brucks, D., Marshall-Pescini, S., Wallis, L. J., Huber, L., Range, F. Measures of Dogs’ Inhibitory Control Abilities Do Not Correlate across Tasks. Frontiers in Psychology. 8, (2017).
- McDonald, J., Schleifer, L., Richards, J. B., de Wit, H. Effects of THC on Behavioral Measures of Impulsivity in Humans. Neuropsychopharmacology. 28 (7), 1356-1365 (2003).
- Reynolds, B., Ortengren, A., Richards, J. B., de Wit, H. Dimensions of impulsive behavior: Personality and behavioral measures. Personality and Individual Differences. 40 (2), 305-315 (2006).
- Dellu-Hagedorn, F. Relationship between impulsivity, hyperactivity and working memory: a differential analysis in the rat. Behavioral and Brain Functions. 2 (10), 18 (2006).
- López, P., Alba, R., Orduña, V. Individual differences in incentive salience attribution are not related to suboptimal choice in rats. Behavior and Brain Research. 341 (2), 71-78 (2017).
- Ho, M. Y., Al-Zahrani, S. S. A., Al-Ruwaitea, A. S. A., Bradshaw, C. M., Szabadi, E. 5-Hydroxytryptamine and impulse control: prospects for a behavioural analysis. Journal of Psychopharmacology. 12 (1), 68-78 (1998).
- Sagvolden, T., Russell, V. A., Aase, H., Johansen, E. B., Farshbaf, M. Rodent models of attention-deficit/hyperactivity disorder. Biological Psychiatry. 57, 9 (2005).
- Tomie, A., Aguado, A. S., Pohorecky, L. A., Benjamin, D. Ethanol induces impulsive-like responding in a delay-of-reward operant choice procedure: impulsivity predicts autoshaping. Psychopharmacology. 139 (4), 376-382 (1998).
- Monterosso, J., Ainslie, G. Beyond discounting: possible experimental models of impulse control. Psychopharmacology. 146 (4), 339-347 (1999).
- Burguess, M. A., Rabbit, P. . Methodology of frontal and executive function. , 81-116 (1997).
- Watterson, E., Mazur, G. J., Sanabria, F. Validation of a method to assess ADHD-related impulsivity in animal models. Journal of Neuroscience Methods. 252, 36-47 (2015).
- Hackenberg, T. D. Of pigeons and people: some observations on species differences in choice and self-control. Brazilian Journal of Behavior Analysis. 1 (2), 135-147 (2005).
- Asinof, S., Paine, T. A. The 5-choice serial reaction time task: A task of attention and impulse control for rodents. Journal of Visualized Experiments. (90), e51574 (2014).
- Masaki, D., et al. Relationship between limbic and cortical 5-HT neurotransmission and acquisition and reversal learning in a go/no-go task in rats. Psychopharmacology. 189, 249-258 (2006).
- Bari, A., et al. Prefrontal and monoaminergic contributions to stop-signal task performance in rats. The Journal of Neuroscience. 31, 9254-9263 (2011).
- Flagel, S. B., Watson, S. J., Robinson, T. E., Akil, H. Individual differences in the propensity to approach signals vs goals promote different adaptations in the dopamine system of rats. Psychopharmacology. 191, 599-607 (2007).
- Swann, A. C., Lijffijt, M., Lane, S. D., Steinberg, J. L., Moeller, F. G. Trait impulsivity and response inhibition in antisocial personality disorder. Journal of Psychiatric Research. 43 (12), 1057-1063 (2009).
- Lawrence, A. J., Luty, J., Bogdan, N. A., Sahakian, B. J., Clark, L. Impulsivity and response inhibition in alcohol dependence and problem gambling. Psychopharmacology. 207 (1), 163-172 (2009).
- Dougherty, D. M., et al. Behavioral impulsivity paradigms: a comparison in hospitalized adolescents with disruptive behavior disorders. Journal of Child Psychology and Psychiatry. 44 (8), 1145-1157 (2003).
- Rosval, L., et al. Impulsivity in women with eating disorders: Problem of response inhibition, planning, or attention. International Journal of Eating Disorders. 39 (7), 590-593 (2006).
- Huddy, V. C., et al. Reflection impulsivity and response inhibition in first-episode psychosis: relationship to cannabis use. Psychological Medicine. 43 (10), 2097-2107 (2013).

