Infection de Pneumococcus des cellules endothéliales humaines primaires dans le flux constant
Summary
Cette étude décrit la surveillance microscopique de l’adhérence au pneumocoque aux chaînes de facteur von Willebrand produites à la surface des cellules endothéliales primaires humaines différenciées sous l’effort de cisaillement dans des conditions définies d’écoulement. Ce protocole peut être étendu à la visualisation détaillée de structures cellulaires spécifiques et à la quantification des bactéries en appliquant des procédures d’immunostaining différentielles.
Abstract
L’interaction de Streptococcus pneumoniae avec la surface des cellules endothéliales est médiée dans le flux sanguin par l’intermédiaire de protéines mécanosensibles telles que le facteur Von Willebrand (VWF). Cette glycoprotéine modifie sa conformation moléculaire en réponse au stress de cisaillement, exposant ainsi les sites de liaison pour un large spectre d’interactions hôte-ligand. En général, la culture des cellules endothéliales primaires sous un flux de cisaillement défini est connue pour favoriser la différenciation cellulaire spécifique et la formation d’une couche endothéliale stable et étroitement liée ressemblant à la physiologie de la muqueuse interne d’un vaisseau sanguin . Ainsi, l’analyse fonctionnelle des interactions entre les agents pathogènes bactériens et la vascularisation hôte impliquant des protéines mécanosensibles nécessite l’établissement de systèmes de pompe qui peuvent simuler les forces physiologiques d’écoulement connues pour affecter la surface de cellules vasculaires.
Le dispositif microfluidique utilisé dans cette étude permet une recirculation continue et sans impulsion des fluides avec un débit défini. Le système de pompe à pression d’air contrôlé par ordinateur applique un stress de cisaillement défini sur les surfaces des cellules endothéliales en générant un flux moyen continu, unidirectionnel et contrôlé. Les changements morphologiques des cellules et l’attachement bactérien peuvent être surveillés et quantifiés au microscope en utilisant des glissières de canal spéciales conçues pour la visualisation microscopique. Contrairement à l’infection de culture cellulaire statique, qui nécessite en général une fixation de l’échantillon avant l’étiquetage immunitaire et les analyses microscopiques, les diapositives microfluidiques permettent à la fois la détection à base de fluorescence des protéines, des bactéries et des composants cellulaires après fixation de l’échantillon; coloration d’immunofluorescence sérielle; et la détection directe à base de fluorescence en temps réel. En combinaison avec des bactéries fluorescentes et des anticorps spécifiques étiquetés fluorescence, cette procédure d’infection fournit un système efficace de visualisation à composants multiples pour un large éventail d’applications scientifiques liées aux processus vasculaires.
Introduction
La pathogénie des infections à pneumocoques est caractérisée par une interaction multiforme avec une diversité de composés et composants de la matrice extracellulaire de l’hémostasie humaine, tels que le plasminogène et le VWF1,2, 3,4,5,6,7,8. Le multidomaine glycoprotéine VWF sert de régulateur clé d’une hémostase équilibrée en médiatisant le recrutement de thrombocytes et l’incorporation de fibrine sur le site de la formation vasculaire de thrombus9. L’importance de LA VWF fonctionnelle et active pour le contrôle des saignements et la cicatrisation des plaies est démontrée par la maladie de von Willebrand, un trouble héréditaire commun de la coagulation10.
Globular VWF circule dans le système sanguin humain à une concentration allant jusqu’à 14,0 g/mL11,10. En réponse à des lésions vasculaires, la libération locale de VWF par endothélial Weibel Palade Bodies (WBP) est nettement augmenté11,12. Des études antérieures montrent que l’adhésion au pneumocoque aux cellules endothéliales humaines et sa production de la pneumolysine de toxine de pore-formation stimule de manière significative la sécrétion lumineuse de VWF13. Les forces hydrodynamiques du flux sanguin induisent une ouverture structurelle des domaines VWF mécanoresponsive. À des débits de 10 dyn/cm2, la VWF se multimerise à de longues chaînes protéiques allant jusqu’à plusieurs centaines de micromètres de longueur qui restent attachées au sous-endothélium10,12.
Pour comprendre la fonction des chaînes VWF multimerized générées sous l’effort de cisaillement dans l’interaction du pneumocoque avec la surface endothéliale, une approche microfluidique d’infection de culture de cellules a été établie. Un dispositif microfluidique équipé d’un système de pompe à air contrôlé par logiciel a été utilisé. Cela a permis une recirculation continue et unidirectionnelle du milieu de culture cellulaire avec un débit défini. Par conséquent, le système a appliqué un stress de cisaillement défini sur la surface des cellules endothéliales, qui sont restés attachés à l’intérieur des diapositives de canal spécialisées. Cette approche a permis la simulation de la force de cisaillement dans le flux sanguin du système vasculaire humain, dans lequel les chaînes DE VWF sont générées sur des cellules endothéliales différenciées dans des conditions de flux constants définies. À cette fin, les cellules endothéliales ont été cultivées dans des glissements de canal spécifiques (voir Tableau des matériaux), qui ont été adaptés pour des analyses microscopiques pendant le flux. Le système de pompe microfluidique a fourni la situation de stress de cisaillement fortement définie et commandée requise pour la formation des chaînes prolongées de VWF sur la couche endothéliale de cellules confluentes. Après la stimulation de VWF-sécrétion des cellules endothéliales de veine ombilicale humaine confluently cultivées (HUVEC) par la supplémentation d’histamine, la formation de corde a été induite en appliquant un effort de cisaillement () de 10 dyn/cm2. Le stress de cisaillement est défini comme la force agissant sur la couche cellulaire. Il est calculé approximativement selon Cornish et. al.14 avec l’équation 1:
Où le stress de cisaillement en dyn/cm2, la viscosité dans (dyn)/cm2, h la moitié de la hauteur du canal, w – la moitié de la largeur du canal, et le débit en mL/min.
Le résultat de l’équation 1 dépend des différentes hauteurs et largeurs des différentes diapositives utilisées (voir Tableau des matériaux). Dans cette étude, une glissière de canal Luer de 0,4 m, ce qui a donné lieu à un facteur de glissement de chambre de 131,6, a été utilisée (voir la formule 2).
La viscosité du milieu à 37 oC est de 0,0072 dyn/cm2 et un stress de cisaillement de 10 dyn/cm2 a été utilisé. Il en est résulté un débit de 10,5 ml/min (voir la formule 3).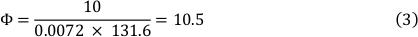
Ici, l’adaptation et l’avancement d’une procédure de culture de cellules microfluidiques utilisant un système unidirectionnel de flux laminaire pour l’étude et la visualisation des mécanismes d’infection bactérienne dans la vascularisation d’hôte est décrite en détail. La génération de chaînes VWF sur les couches endothéliales peut également être stimulée par l’utilisation d’autres systèmes de pompe qui sont capables d’appliquer un stress continu et régulier de cisaillement15.
Après la culture des cellules endothéliales primaires à la confluence dans le flux et la stimulation de la formation de chaîne de VWF, les pneumocoques exprimant la protéine rouge de fluorescence (RP)16 ont été ajoutés à la couche de cellules endothéliales sous le contrôle microscopique constant. L’attachement des bactéries aux chaînes VWF à la surface des cellules endothéliales a été visualisé et surveillé au microscope pendant jusqu’à trois heures en temps réel en utilisant des anticorps étiquetés fluorescents spécifiques à la VWF. Avec cette approche, le rôle de VWF en tant que cofactor d’adhérence favorisant l’attachement bactérien à l’endothélium vasculaire a été déterminé8.
En plus de la visualisation microscopique de la sécrétion de protéines et des changements conformationnels, cette méthode pourrait être utilisée pour surveiller les étapes individuelles des processus d’infection bactérienne en temps réel et pour quantifier la quantité de bactéries attachées à différents moments de infection. Le système de pompe spécifique contrôlé par logiciel offre également la possibilité de culture des cellules endothéliales dans des conditions de flux constants définies pour un temps allant jusqu’à plusieurs jours et permet une incubation à débit moyen pulsé défini. En outre, cette méthode peut être appliquée en utilisant différents types de cellules. L’adaptation du protocole de coloration permet également la détection et la visualisation des bactéries intériorisées dans les cellules eucaryotes.
Ce manuscrit décrit ce protocole expérimental avancé qui peut être utilisé comme une approche définie, fiable et reproductible pour une caractérisation efficace et polyvalente des processus pathophysiologiques.
Protocol
Representative Results
Discussion
La simulation de l’interaction bactérienne avec les protéines hôtes mécanosensibles telles que VWF nécessite un système de culture cellulaire perfusable qui permet la génération d’un flux défini, unidirectionnel et continu de liquides, générant ainsi un stress de cisaillement fiable . Plusieurs systèmes de pompe microfluidique ont déjà été décrits. Un examen complet de Bergmann et coll. résume les aspects clés des différents modèles de culture cellulaire en deux et trois dimensions1…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Le projet a été financé par le DFG (BE 4570/4-1) à S.B.
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
References
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

